肺保护性通气策略对高原地区肝包虫根治术患者术后氧合功能的影响
2020-11-17姜徽汪欢黄丹王纯辉顾尔伟
姜徽, 汪欢, 黄丹, 王纯辉, 顾尔伟
(1安徽医科大学第一附属医院麻醉科, 安徽 合肥 230022; 2西藏自治区山南市人民医院麻醉科, 西藏 山南 856300)
高原地区在医学上被定义为海拔超过3000 m, 并使机体产生显著生物学效应的地区。 随海拔升高, 吸入气体的氧分压下降是高原地区产生低氧血症的最主要原因[1]。 患者长期生活在高原低氧环境下, 易患慢性高原病(chronic mountain sickness, CMS), 且低氧低压会引发缺氧性肺血管收缩、 高原性肺动脉高压(high altitude pulmonary hypertension, HAPH)、 肺心病等。 肝包虫病(肝棘球蚴病)在我国牧区人群中发病率较高, 手术切除仍为最有效的治疗方式。 肝包虫病易突破膈肌侵入肺组织, 引发肺部感染, 增加术后肺部并发症(postoperative pulmonary complications, PPC)。 在西藏等高原高海拔地区氧分压降低同样容易引起围术期尤其是术后低氧血症的发生[2]。 相关研究表明, 术中实施肺保护性通气策略(lung protective ventilation strategy, LPVS)能够改善急性肺损伤(acute lung injury, ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrom, ARDS)患者的氧合状态, 改善术后肺功能并降低PPC发生率, 具有重要治疗意义[3]。 然而, 采用LPVS对高原地区长期慢性缺氧患者是否有益尚未明确。 LPVS采用: 低潮气量(VT)通气≤8 mL/kg、 呼气末正压(PEEP)通气4~10 cmH2O、 允许性高碳酸血症(pH值≥7.20)和间断使用肺复张手法[4]。 本研究拟观察基于高原地区长期慢性缺氧患者在全身麻醉中采用LPVS对术后氧合功能的影响, 为慢性缺氧患者机械通气模式提供临床参考。
1 资料和方法
1.1 一般资料
本研究已取得西藏自治区山南市人民医院医学伦理委员会批准, 与患者沟通相关方案并且签署研究知情同意书。 选取2018-07/2019-07期间西藏山南地区(海拔3600 m)拟行手术治疗的肝包虫病患者60例, 采用随机数字表法分为常规通气组(C组,n=30)、 肺保护性通气组(L组,n=30)。 年龄18~55岁, 性别不限, ASA分级Ⅰ或Ⅱ级。 排除标准: 既往有肺部手术史者; 既往有慢性阻塞性肺疾病(COPD)、 哮喘或呼吸暂停综合征者; 近2周内呼吸道感染者; ALI或ARDS及BMI>40 kg/m2; 急诊手术患者; 长期服用激素或免疫抑制剂者; 并发重症肌无力者; 合并心功能不全者。
1.2 麻醉方法
患者入室后, 常规连续监测心电图(ECG)、 心率(HR)、 血压(BP)以及脉搏血氧饱和度(SpO2)。 依次静脉给予咪达唑仑0.1~0.2 mg/kg、 舒芬太尼0.5~1.0 μg/kg、 丙泊酚1.5~2.0 mg/kg和顺式苯磺酸阿曲库铵0.15~0.20 mg/kg, 快速麻醉诱导后 3~5 min行气管插管术, 确认无误后, 机械控制呼吸, 60%吸入氧浓度。 而后行双侧腹横肌筋膜神经阻滞, 以腋中线、 平脐水平为穿刺点, 在超声引导下采用平面内技术, 通过实时成像技术, 确认穿刺针到达指定位置回抽无血后注入局部麻醉药(灭菌生理盐水5 mL+2%盐酸利多卡因注射液5 mL+1%盐酸罗哌卡因注射液10 mL, 注射药物总量为20 mL)。 麻醉维持采用持续输注丙泊酚和瑞芬太尼, 间断给予舒芬太尼和顺式苯磺酸阿曲库铵。 围麻醉期通过调整麻醉药物用量、 补液速度及血管活性药物的使用维持平均动脉压(MAP)≥65 mmHg。 L组: 设定VT=6 mL/kg, 呼吸频率(RR)14次/min, 吸呼比 (I ∶E)=1∶2, PEEP=5 cmH2O, 围麻醉期每30 min实施一次肺复张。 PEEP递增肺复张方法: 将机械通气设定为压力控制模式, 通气压力15~20 cmH2O, 初始PEEP为5 cmH2O, 每3~5个呼吸周期后增加一个 5 cmH2O, 直至PEEP达到20 cmH2O时终止, 然后恢复正常通气。 C组: 设定VT=10 mL/kg, RR 9~11次/min, I ∶E=1∶2, PEEP=0 cmH2O, 麻醉期间不进行肺复张手法。 两组患者围术期均维持呼气末二氧化碳分压(PETCO2)35~45 mmHg。 患者术后全部采用静脉自控镇痛(PCIA), 术后48 h持续镇痛。 镇痛药物: 在100 mL生理盐水中加入舒芬太尼3 μg/kg+地佐辛0.3 mg/kg+盐酸托烷司琼0.1 mg/kg, 首次负荷剂量5 mL, 持续背景输注量2 mL/h, 单次给药量为 2 mL, 锁定时间为15 min。 对于术后疼痛评分≥4分的患者可静注地佐辛5 mg。
1.3 观察指标
记录患者的麻醉时间(min)、 手术时间(min)、 术中输液量(mL)、 出血量(mL)等。 记录患者术前(T0)、 诱导后1 h(T1)、 拔管时(T2)、 术后1 d(T3)和术后3 d(T4)的SpO2, 同时在T0~T3时间点抽取手术患者的动脉血做血气分析, 分析比较2组患者对应时间点的动脉血氧分压(PaO2)、 动脉血二氧化碳分压(PaCO2)和氧合指数。 记录术后3 d内、 7 d内PPC发生情况(发生以下7种新状况中的3种及以上: 咳嗽、 咳痰增加、 胸痛、 肺水肿、 肺不张、 体温超过 38 ℃、 HR>100次/min[5])。
1.4 统计学处理

2 结果
2.1 两组患者术前、 术中情况比较
两组患者在年龄、 性别、 ASA分级、 BMI指数及术前肺功能与氧合指数方面比较, 差异无统计学意义(P>0.05, 表 1)。 比较分析2组患者手术持续时间、 全身麻醉时间、 术中液体输入量和术中出血量均无统计学意义(P>0.05, 表1)。
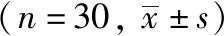
表1 两组患者术前一般资料及手术资料比较
2.2 两组患者血气结果比较
T0时间点, 2组患者SpO2、 PaO2和PaCO2比较, 组间差异无统计学意义(P>0.05)。 与C组相比, L组的SpO2在T2、 T3、 T4时间点均有升高, PaO2在T1、 T2、 T3时间点均升高, PaCO2在T1、 T3时间点均降低, 差异有统计学意义(P<0.05, 表2)。
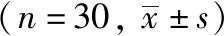
表2 两组患者SpO2 、 PaO2及PaCO2比较
2.3 两组患者氧合指数结果比较
两组患者氧合指数比较, T0时间点2组间无统计学意义(P>0.05)。 但在T1、 T2、 T3时2组间有统计学意义(P<0.05), L组的指标均高于C组(表3)。
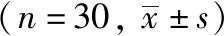
表3 两组患者氧合指数比较
2.4 两组患者术后并发症结果比较
两组患者术后3 d内和术后7 d内, L组PPC的发生率明显低于C组(P<0.05, 表4)。

表4 两组患者术后并发症结果比较 [n=30, n(%)]
3 讨论
高原地区低氧低压环境对手术患者的心肺功能储备是个巨大挑战。 吸入气体中的氧浓度降低导致肺循环中的红细胞不能与肺泡气充分平衡(弥散不平衡)、 加重通气血流比例失调, 使低氧血症的情况进一步恶化[6]。
长期暴露于低氧低压环境中, 对高原患者肺组织的结构及功能有较大影响。 低氧低压刺激会使肺血管平滑肌持续收缩, 进一步增加肺血管阻力, 最终导致肺动脉高压的形成[7]。 受肺动脉高压的影响, 与肺泡连接的毛细血管出现血-气屏障受损, 大量蛋白进入肺泡, 使得肺泡渗透压增加, 引起肺泡水肿[8]。 肺部结构的病变影响呼吸系统, 增加VT和RR, 分钟通气量增加。 过度通气降低PaCO2, 导致呼吸性碱中毒。 久居高原的健康成年人的SaO2一般为 88%左右, 机体内氧储备减少。 围术期及术后由于手术的创伤、 感染、 麻醉等多因素影响肺通气更容易发生低氧血症, 加重组织细胞缺氧, 影响重要脏器功能, 增加围术期风险。
围术期通气采用不同的潮气量各有利弊。 传统观念认为小潮气量通气可导致肺泡萎陷、 产生肺不张。 但小潮气量通气可显著降低患者肺部感染率, 有效缩短术后ICU滞留时间以及机械通气时间, 降低术后ARDS的发生率[9]。 肝包虫病患者多为高原长住居民, 常合并不同程度的肺泡水肿或肺动脉高压, 小潮气量不能满足其通气需要。 在危重症患者的呼吸支持时, 应用小潮气量通气策略, 能够有效降低全身炎症反应, 缩短机械辅助通气时间, 降低呼吸机相关的ALI的发生率。 联合PEEP能防止单纯的小潮气量机械通气策略引起的肺泡萎陷、 通气/血流失调, 使肺功能残气量增加, 改善通气/血流, 增加肺弥散功能[10]。 本研究中我们采用了小潮气量通气+PEEP, 既达到了小潮气量通气的优势, 又可避免小潮气量的缺陷。
本研究中我们同时利用肺复张手法, 重新扩张塌陷的肺泡, 能减轻肺水肿, 改善肺功能。 肺复张还可以增加肺泡Ⅱ型上皮细胞分泌表面活性剂物质, 并减少其吸收, 维持肺泡的相对稳定, 降低肺损伤。 运用肺复张可能会引起患者一过性的血流动力学改变, 且本研究采用了递增PEEP的手法进行肺复张[11], 整体上对机体的影响甚微 。
综上所述, 在高原低氧低压环境下, 肝包虫病全身麻醉患者实施LPVS, 小潮气量(VT=6 mL/kg)加5 cmH2O的PEEP, 联合肺复张手法可以改善患者术后呼吸功能, 降低全麻术后3 d内、7 d内肺部相关并发症的发生率。 因此, 对高原低氧患者在全身麻醉期间实施保护性通气策略是有益的。
