肥胖症的现代内科治疗
2020-11-17于娜朱惠娟
于娜 朱惠娟
肥胖症是因机体脂肪蓄积过多和(或)脂肪分布异常,导致体重异常增加。1975~2016年全球肥胖人数从1亿增至6.74亿[1],我国肥胖症发病率由2000年的8.6%上升至2014年的12.9%[2]。作为糖尿病、高血压、心脑血管疾病等多种慢性疾病的独立危险因素,肥胖症被视为危害人类的重要健康问题之一,肥胖症患者的诊治成为临床热点和难点。
生活方式及行为干预是肥胖症的一线治疗方案,BMI≥28.0 kg/m2且经过3个月的生活方式干预仍不能减重5%或BMI≥24.0 kg/m2合并高血糖、高血压、血脂异常等肥胖相关并发症的患者,在生活方式及行为干预基础上推荐应用药物治疗[3]。生活方式干预和药物治疗不能有效控制体重的肥胖症患者,尤其当BMI≥37.5 kg/m2时,指南建议积极外科手术治疗;当32.5 kg/m2≤BMI<37.5 kg/m2时推荐手术治疗;当27.5 kg/m2≤BMI<32.5 kg/m2且至少符合2项代谢综合征组分表现或存在肥胖合并症时,综合评估后可考虑外科手术[4]。本文旨在综述肥胖症的内科治疗进展。
一、生活方式及行为方式干预
生活方式干预主要包括饮食控制和运动干预。减少能量摄入或改善膳食结构是减重治疗的重要策略,也是药物和外科治疗肥胖症的基石。轻断食疗法可降低机体能量调节反应,防止节食引起的基础代谢率降低,可用于肥胖症患者短期减重[5]。在早期一项临床研究中,519例超重或肥胖患者接受平均时长为29.8周的轻断食治疗后,78%的患者体重下降超过18.2 kg,平均减重速度为每周1.5 kg[6]。近年来高脂肪、低碳水化合物及蛋白质的生酮饮食疗法也广泛用于减重的治疗中。纳入13项临床研究的Meta分析结果显示,801例超重或肥胖患者维持极低热量生酮饮食4周内平均体重下降10.0 kg,维持4周以上者体重降幅可达15.6 kg[7]。此外还有低碳水化合物饮食、低脂饮食及地中海饮食等干预方式被证实有助于减重。运动干预对减重并维持减重效果具有重要意义,美国心脏学会(AHA)推荐肥胖患者应长期维持每周200~300分钟的高强度运动或至少150分钟的中等强度运动以避免体重增长或减少体重反弹[8]。行为方式干预旨在提高患者减重治疗的依从性,具体形式包括动机性访谈、心理评估、认知调整、教育及策略指导等。
以饮食和运动为核心的行为减重是首选干预方式,但对于大多数肥胖症患者的长期减重效果有限,且体重反弹严重。如MAINTAIN-pc研究中178例超重或肥胖患者经饮食控制和体育运动在6个月内可维持体重持续下降,但24个月后有157例患者出现体重反弹,平均涨幅达4.22%[9]。因此,药物等内科治疗和外科手术治疗依然是肥胖症患者、尤其是存在并发症患者的重要选择。
二、减重药物
具有减重作用的药物主要靶点包括中枢神经系统抑制食欲及胃肠道抑制脂质吸收等,新作用靶点药物也在不断地被发现和投入临床试验。肥胖治疗药物中包括应用时间可超过12周的长期减重药物和使用时间小于12周的短期减重药物(表1)。
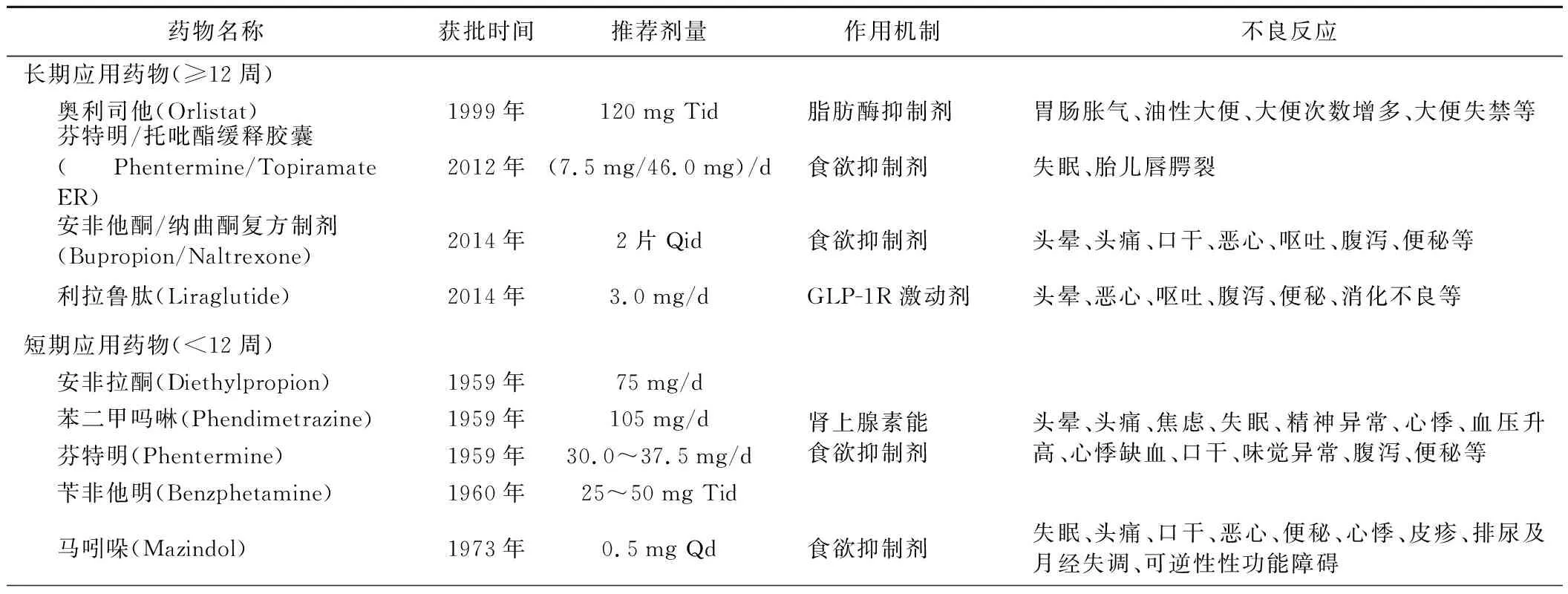
表1 减重药物分类
1.作用于中枢神经系统的药物
(1)中枢神经系统肾上腺素能药物及其复合制剂
①芬特明/托吡酯缓释胶囊(Phentermine/Topiramate ER):芬特明主要通过促进下丘脑中去甲肾上腺素及多巴胺释放和神经信号传递发挥抑制食欲的作用,美国食品药品监督管理局(FDA)批准其可用于短期减重治疗(不超过12周)。托吡酯是一种γ-氨基丁酸受体激动剂、谷氨酸能受体拮抗剂和碳酸酐酶抑制剂,可用于治疗癫痫和预防偏头痛。二者复合制剂能够显著作用于中枢神经系统抑制患者食欲,达到减重治疗目的。2012年芬特明/托吡酯缓释胶囊获FDA批准上市。分别纳入1 267例和2 487例肥胖患者的两项多中心临床研究发现,规律服用芬特明/托吡酯(15 mg/92 mg)56周的患者体重下降分别达12.2%和9.8%,而安慰剂组的减重幅度仅为1.2%~1.6%[10-11],且治疗组多种心血管疾病危险因素均改善,包括腰围、血压、血脂、空腹血糖和空腹胰岛素水平等。
②安非他酮/纳曲酮复方制剂(Bupropion/Naltrexone):安非他酮是一种多巴胺和去甲肾上腺素的再摄取抑制剂,可治疗抑郁症和用于戒烟;纳曲酮拮抗阿片依赖的反馈回路,被批准用于酒精和阿片类药物的戒断治疗,二者协同作用于下丘脑,可显著降低食欲,从而达到减少摄食、减轻体重的效果。2014年FDA批准安非他酮/纳曲酮复方制剂用于治疗肥胖症。一项纳入1 496例超重或肥胖患者的COR-Ⅱ研究发现,服用安非他酮(360 mg/d)联合纳曲酮(32 mg/d)56周的治疗组体重下降6.4%,显著高于安慰剂组1.2%,其中体重降幅高于5%患者在治疗组(55.6%)较安慰剂组(17.5%)增多,且空腹血糖水平较安慰剂组降低1.5 mg/dl,低密度脂蛋白胆固醇水平降低3.9 mg/dl,证实安非他酮/纳曲酮联合用药减重效果显著并有血脂代谢受益[12]。
③其他中枢神经系统肾上腺素能药物:多种肾上腺素能药物由于缺乏长期用药的安全性及有效性的临床研究支持,FDA批准使用但同时限定应用时间不得超过12周,如芬特明、安非拉酮(Diethylpropion)、苯二甲吗啉(Phendimetrazine)、苄非他明(Benzphetamine),前三者于1959年获批用于短期减重,苄非他明于1960年获批,其中芬特明是在美国处方量最大的短期应用减重药物。由于肥胖症是一种慢性代谢性疾病,需长期管理及治疗,短期应用药物到期停药后易引起体重反弹,且因其常见不良反应并存在滥用风险,短期减重药物在临床应用中的局限性较大,在欧洲遭到集体撤市,并未在我国获批上市。
作用于中枢肾上腺素能药物的常见不良反应类似,包括头晕、头痛、焦虑、失眠、精神异常、心悸、血压升高、口干、味觉异常、腹泻、便秘等。芬特明/托吡酯缓释胶囊常导致失眠,因此建议患者晨起服药,较低剂量起始后逐步加量,同时该药有致胎儿唇腭裂的风险,因此育龄女性服药前必须采取避孕措施并确认妊娠试验结果为阴性后方可考虑使用。
(2)中枢神经系统5-羟色胺(5-HT)能药物
氯卡色林是一种选择性的5-羟色胺2C(5-HT2C)受体激动剂,与位于弓状核的5-HT2C受体结合后可刺激黑皮质素原(POMC)神经元分泌POMC,而POMC可转化为α-黑皮质素释放激素(α-MSH),作用于黑皮质素-4受体(MC4R)发挥抑制食欲和减重的作用。氯卡色林于2012年获FDA批准后上市。多中心随机对照临床研究结果表明服用氯卡色林(20 mg/d)1年的患者中有22.6%体重下降超过10%,且空腹血糖和糖化血红蛋白水平降低,而对照组仅有9.7%的患者体重下降超过10%[13]。氯卡色林的常见不良反应表现为头晕、头痛、恶心、疲乏、口干、便秘等。一项纳入12 000例患者、中位随访时间3.3年的上市后临床研究结果发现,氯卡色林治疗组较安慰剂组患者患肿瘤的相对危险度为1.09,患恶性肿瘤相对危险度为1.16,包括恶性黑色素瘤等皮肤肿瘤、前列腺肿瘤、胃肠道肿瘤、肺癌和乳腺肿瘤等[14]。2020年2月13日氯卡色林因潜在增加肿瘤发生风险被FDA勒令撤市。
(3)中枢神经系统多靶点作用药物
马吲哚(Mazindol)是一种三环咪唑异吲哚结构化合物,作用于下丘脑的饱食中枢,可抑制去甲肾上腺素和5-HT的再摄取,增强饱腹感,减少进食和胃酸分泌,促进能量代谢。1973年FDA批准马吲哚作为减重药物上市。对重度肥胖女性患者的临床研究显示,极低热量饮食干预2~4周后患者平均体重下降6.3 kg,而联合应用马吲哚8周和12周后体重可分别进一步降低4.9 kg和6.9 kg[15]。在3例应用马吲哚治疗的Prader-Willi综合征患者中,2例患者服药后食欲明显下降并在6个月后出现体重下降[16]。使用马吲哚的常见不良反应包括口干、头痛、神经过敏、恶心、便秘、失眠、心悸、皮疹、排尿及月经失调、可逆性性功能障碍等,目前为我国第一类精神药物。
2.作用于消化系统的药物
奥利司他是一种高选择性胃肠道脂肪酶抑制,可竞争性抑制胰腺和胃肠道来源的羧基酯酶及磷脂酶A2活性,减少食物中的脂肪吸收[17]。奥利司他于1999年经FDA批准在美国上市,2001年在我国批准上市,是我国批准的唯一作用于胃肠道的减重药物。一项纳入3 305例肥胖患者的随机对照临床研究显示,在行为减重基础上,三餐时各服用奥利司他120 mg的治疗组随访4年后仍较安慰剂组有显著的减重效果,奥利司他组中有52.0%和26.2%的患者体重下降分别达5%以上和10%以上[18]。奥利司他可降低糖耐量受损患者糖尿病发病风险,改善糖尿病患者的血糖控制,亦可降低血脂水平[19]。奥利司他的常见不良反应集中在胃肠道系统,如胃肠胀气、油性大便、大便次数增多等,但通常程度较轻,可逐渐缓解。由于奥利司他可减少脂肪的吸收,长期用药可能引起亲脂性药物吸收减少、脂溶性维生素缺乏。某些药物间的相互作用也应引起注意,如维生素K吸收减少可影响华法林的合理用量,应定期监测并酌情调整药物剂量。
3.GLP-1R激动剂
胰高血糖素样肽(GLP-1)由小肠L细胞分泌,以血糖依赖的方式促进胰岛β细胞分泌胰岛素、抑制α细胞分泌胰高血糖素,参与生理血糖调节。经过人工修饰的GLP-1R激动剂(GLP-1a)较天然的GLP-1具有更好的稳定性和作用时间,2005年开始作为全新的降糖药物类型上市。临床研究发现GLP-1a可作用于下丘脑、边缘/奖赏系统和大脑皮层产生饱腹感,发挥抑制食欲的作用,同时能减缓胃排空,从而减少患者的进食量,具有减重的作用。2014年FDA批准了利拉鲁肽(Liraglutide)的肥胖症适应症。肥胖及糖尿病前期患者在应用利拉鲁肽56周后,体重平均下降8.0%,其中有63.2%和33.1%的患者体重减轻分别≥5%和≥10%,并有血糖、血压和血脂水平的改善[20]。索马鲁肽(Semaglutide)是一种长效GLP-1R激动剂,于2017年获FDA批准上市,用于2型糖尿病患者的血糖控制,半衰期达183 h,每周仅需1次皮下注射用药。在肥胖症患者开展的注射型索马鲁肽Ⅱ期临床试验中,最高日均剂量0.4 mg的索马鲁肽治疗组在52周后平均体重下降13.8%,而每日3.0 mg利拉鲁肽组和安慰剂组体重分别下降7.8%和2.3%[21],初步证实了索马鲁肽的减重效应,目前已投入Ⅲ期临床试验。其他GLP-1R激动剂及短效制剂还包括艾塞那肽、利司那肽,长效制剂如艾塞那肽长效制剂、阿必鲁肽、度拉糖肽,均于降糖治疗时呈现体重获益。贝那鲁肽和聚乙二醇洛塞那肽由我国自主研制,分别于2016年和2019年在国内批准上市用于治疗2型糖尿病,尤其适用于合并超重或肥胖的患者。GLP-1R激动剂常引起头晕、恶心、呕吐、腹泻、便秘、消化不良等胃肠道反应,程度较轻,大多数患者随着用药时间的延长可逐渐耐受和缓解。
4.作用于肾脏的药物
新型的降糖药物钠-葡萄糖转运蛋白-2抑制剂(SGLT-2i)可通过抑制近端肾小管的SGLT-2减少葡萄糖的重吸收,促进尿糖排出实现降糖作用,从而对合并超重或肥胖的糖尿病患者具有一定减重效果。2014年FDA批准达格列净(Dapagliflozin)用于2型糖尿病患者的降糖治疗。多中心临床研究结果显示,达格列净治疗组24周后较安慰剂组体重减低2.08 kg,全身脂肪含量下降1.48 kg[22]。Lundkvist等[23]研究结果发现达格列净与艾塞那肽联用24周后可使糖尿病合并超重或肥胖患者平均体重下降4.5 kg,显著优于两种药物单独应用组,并且在52周后,联合用药组的减重优势仍然稳定[24]。其他获批用于糖尿病患者的SGLT-2i还包括卡格列净、依帕列净、埃格列净等,其中卡格列净已进入超重和肥胖患者的Ⅱ期临床试验。
5.作用于脂肪组织的药物
瘦素是最早发现的由脂肪细胞分泌的脂肪因子,可作用于下丘脑和脑干孤束核,具有抑制食欲、增加机体能量消耗、调节葡萄糖代谢的作用,但肥胖症患者广泛存在瘦素抵抗而非瘦素缺乏。因此FDA批准瘦素用于先天瘦素缺乏的肥胖症患者。瘦素类似物及瘦素受体增敏剂正在被广泛研究用于大多数单纯性肥胖症患者。
6.正在研发的新型药物
(1)单分子多靶点药物:新兴的单分子多靶点药物可同时作用于一种以上的胃肠激素相关受体,发挥减重作用,较GLP-1R激动剂等单靶点药物可进一步增强患者饱腹感,减少不良反应。此类药物最常见的靶受体包括GLP-1R、胰高糖素受体(GCGR)和葡萄糖依赖型促胰岛素多肽受体(GIPR)等。一种可作用于GLP-1R/GCGR双受体的单分子激动剂MEDI0382的Ⅱa期临床试验已证实超重或肥胖的2型糖尿病患者用药41天后,试验组患者体重下降3.84 kg并伴有空腹血糖和餐后血糖水平的降低,而安慰剂组患者体重仅下降1.70 kg[25]。GLP-1R/GIPR双受体激动剂LY3298176的Ⅱa期临床试验证实该药在2型糖尿病患者平均减重效果为10%,较度拉糖肽治疗组(9%)更为显著。HM15211等GLP-1R/GIPR/GCGR三受体激动剂目前已进入Ⅰ期临床试验,其人体减重效果较双受体激动剂是否增进有待证实。
(2)MC4R激动剂:Setmelanotide等MC4R激动剂作用于下丘脑室旁核,可抑制摄食行为、增加能量消耗。在纳入55例肥胖患者的Ⅰb期临床试验中,维持应用Setmelanotide(0.01 mg·kg-1·d-1)28天的MC4R杂合子缺陷肥胖患者和MC4R正常型肥胖患者平均体重分别下降3.48 kg和3.07 kg,而安慰剂组体重未见明显降低,表明该药在MC4R基因突变和普通肥胖患者中均有减重效果[26]。目前Setmelanotide已进入Ⅱ期和Ⅲ期临床试验以进一步探讨对肥胖症的治疗作用。
三、内科器械治疗
1.胃内水球
胃内水球是在胃镜下将硅制水球置入胃中,再将生理盐水注入水球,减少胃容量,由此诱发饱腹感帮助患者控制食欲、纠正不良的饮食习惯,也可用于患者行减重手术前的生理及心理准备。除物理作用外,胃内水球还可以促进胆囊收缩素分泌引起幽门收缩,延缓胃排空,并增加胃迷走神经信号传出,增强饱腹感。胃内水球于2015年获FDA批准用于减重治疗,适用于BMI 30~40 kg/m2的患者,应用时间不超过6个月。临床研究显示超重或肥胖患者行内镜下胃内水球置入术6个月后其平均体重下降12.6 kg,其中63%的患者体重下降至少10%,且无严重并发症出现[27]。70%~90%的患者置入胃内水球1周会内出现恶心、呕吐、腹痛等不良反应,其中80%的患者可自行缓解。慢性并发症主要包括反流性食管炎、消化性溃疡、上消化道出血等,若患者症状严重持续不耐受只能提前取出水球,提前取出率在美国患者中约占4.25%[28]。
2.胃排空系统
胃排空系统是通过胃镜下胃造瘘术将造瘘管置入胃内,胃造瘘管从胃内经腹腔连接到与胃平齐的腹部皮肤端口,内部管端固定于胃内,外部管端接头保留于体外。患者在进餐后约30分钟通过外部接头吸出剩余的胃内容物并冲洗管道,可减少食物中约30%的热量摄入。FDA开展的PATHWAY研究招募了111例采用行为减重联合胃排空系统的患者为试验组,60例仅行为减重的患者为对照组,随访52周后,对照组体重下降3.6%,而试验组体重减轻12.1%[29]。2016年6月,FDA批准该系统可用于BMI 35~55 kg/m2且行为减重治疗效果欠佳的成年患者,并推荐其与行为减重相结合。胃排空系统除了与传统的内镜下胃造瘘术有相同的操作相关风险外,常见不良反应包括恶心、呕吐、低钾等电解质紊乱,术后需定期监测电解质,酌情口服质子泵抑制剂(PPI)类药物和补充钾剂。
肥胖症作为最常见的慢性代谢性疾病之一,其治疗需要较高的依从性和较长的周期。根据内科治疗方案的现有证据,肥胖症治疗应以行为减重为基础,在充分评估适应证和密切监测安全性下可结合药物或器械等重要辅助治疗手段。未来随着肥胖症相关研究的进一步深入,不断研发新的治疗手段,对于改善肥胖症的防治和预后具有重大意义。
