聚多巴胺-石墨烯气凝胶的制备及其吸附性能研究
2020-11-14张于弛夏建荣薛涵与江舒杭
张于弛,夏建荣,林 棋,薛涵与,江舒杭
(1.闽江学院海洋学院,福建 福州350108;2.福建省中国漆新型材料工程研究中心,福建 福州350108)
近年来,气凝胶材料因其密度低、比表面积大等优点而受到越来越多的关注,在不同材料的气凝胶中,石墨烯基气凝胶具有良好的吸附性能,被认为是解决日益严重的水污染问题的一种有前途的材料。不同的污染物,如染料、重金属离子和含油液体,可以通过一定的相互作用吸附在石墨烯片的表面上[1-3]。一般来说,石墨烯疏水亲油性,使得石墨烯更倾向吸附含油污染物。因此,石墨烯基气凝胶通常用于油水分离。采用氧化石墨烯(GO)还原制备的石墨烯气凝胶仍有大量的官能团存在,与水溶液中的染料分子之间存在氢键或静电相互作用,也对染料污染物具有一定的吸附能力[4-6]。Yang等人研究结果表明,GO气凝胶对亚甲基蓝和甲基紫具有较好的吸附性能[7]。然而,在气凝胶制备过程中,由于GO的长径较大,仍会出现GO片的堆积或聚集现象,三维多孔结构易坍塌,限制其使用。因此,寻找一种能同时赋予气凝胶优良结构稳定性和吸附性能的改性剂具有重要意义。
多巴胺(DA)是一种独特的模仿粘附蛋白分子,它含有邻苯二酚和氨基官能团,能同时还原和表面改性GO,在还原氧化石墨烯(RGO)表面生成聚多巴胺(PDA)层,提高气凝胶多孔结构的稳定性,使气凝胶在水体中污染物去除方面的实际应用提供了可能性[8]。本论文以多巴胺为粘合剂和还原剂,通过水热法一步还原合成GO水凝胶,冷冻干燥后得到还原型石墨烯气凝胶(GPA)。通过SEM、XRD、FT-IR、Raman及接触角对形貌结构进行表征,同时测定其对不同有机溶剂的吸附性能,并将其用于亚甲基蓝染料废水的吸附,研究对亚甲基蓝的吸附动力学和吸附平衡,以期为气凝胶在印染废水处理中的推广应用提供参考。
1 实验部分
1.1 主要试剂
氧化石墨烯(GO),来自中国科学院山西煤炭化学研究所。多巴胺,购自美国Sigma-Aldrich 公司。三羟基氨基甲烷、盐酸、氨水、甲苯、三氯甲烷、四氢呋喃、N,N二甲基甲酰胺、二甲基乙酰胺、罗丹明和亚甲基蓝,均为化学纯,购自国药集团化学试剂有限公司。所有试剂都无需纯化可直接使用。
1.2 PGA气凝胶的制备
PGA气凝胶制备步骤如下:在冰浴条件下将GO在水中超声分散1~4 h,成GO均匀分散水溶液。将多巴胺(DA)在三羟基氨基甲烷缓冲溶液中溶解,形成均匀的混合溶液,用0.1 mol·L-1的盐酸溶液调节至pH=8。将DA溶液加入分散良好的浓度为10 mg·mL-1的GO/水溶液(其中GO∶DA=1∶1),放入聚四氟乙烯衬里的高压反应釜内95 ℃,12 h水热法制备水凝胶。将水凝胶浸泡于6.7 mol·L-1氨水溶液中2~4 h,液氮中预冻5 min,之后冷冻干燥24 h可得氧化石墨烯气凝胶(PGA)。
1.3 测试及表征
FTIR表征:傅里叶红外光谱仪(iS5,美国赛默飞),扫描范围为500~4 000 cm-1;XRD表征:X射线衍射分析仪(MiniFlex600,日本理学株社),测试条件:Cu靶,Kα射线;管压40 kV,管流40 mA;扫描速率 4°/min,扫描的角度范围为 5°~40°,根据Bragg公式(d=λ/2sinθ)计算,其中d是层间距离,λ是X射线的波长(0.154 nm),θ是衍射角;Raman表征:拉曼光谱仪(Senterra R200-L,德国Bruker,),激发波长为514 nm。SEM表征:扫描电子显微镜(SU8010,日本日立),样品测试前表面经喷金处理,喷金时间为30 s;接触角表征: 动态/静态接触角仪(DSA30,德国)测量水在样品表面的接触角。
1.4 溶剂吸附性能的测定
以甲苯,N,N二甲基甲酰胺,二甲基乙酰胺,四氢呋喃,三氯甲烷5种常见溶剂为吸附剂,考察气凝胶对有机溶剂的选择性吸附能力,将气凝胶称重并浸入溶剂中,经过饱和吸附后取出称量,所有吸附实验重复3次。计算气凝胶吸附前后的质量比来评价其吸附性能,吸附容量QA(g·g-1) 计算如下式:
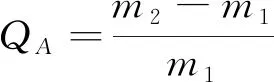
(1)
式中,质量增量为气凝胶对溶剂吸附容量,m1(g)和m2(g)分别为吸附实验前后气凝胶样品的重量。
1.5 亚甲基蓝的吸附实验
通过间歇实验测定气凝胶对亚甲基蓝的吸附量,参照文献[9]在100 mL初始浓度为20 mg·L-1的亚甲基蓝溶液中(pH=7),加入15 mg气凝胶材料,303 K下恒温振荡至平衡(约4 h)。不同的时间间隔,取2 mL悬浮液5 000 r/min离心分离,在λmax=664 nm 处测其吸光度。根据亚甲基蓝标准溶液校准曲线的线性回归方程,测定最终浓度,并根据以下方程式计算吸附染料的量。
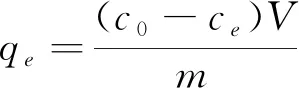
(2)
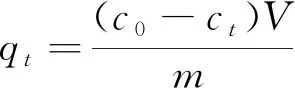
(3)
式中,qt、qe为t时,平衡时的吸附量,mg·g-1;C0、Ct、Ce分别为初始t时平衡时的亚甲基蓝浓度,mg·L-1;m为吸附剂质量,g;V为溶液体积,L。
2 结果讨论
2.1 PGA气凝胶的宏观及微观形貌
以多巴胺为黏合剂和还原剂,结合水热法可还原制备石墨烯气凝胶(PGA)。图1显示了不同步骤凝胶的宏观形态。多巴胺很容易地引发聚合,聚多巴胺可以增大石墨烯片层间的π-π相互作用和疏水作用,相邻的石墨烯片层间自组装,形成悬浮在水中的水凝胶如图1(a)所示。采用冷冻干燥除去凝胶中的水分,得到形貌稳定圆柱形(平均直径15.43 mm,长16.63 mm,重18.5 mg)的PGA见图1(b),其密度为5.95 mg·cm-3,其孔隙率达到99.0%。通常密度小于10 mg·cm-3、孔隙率大于98%的材料可视为气凝胶。PGA稳定支撑在狗尾巴草和花上,展现了它的超轻,见图1(c)。该超轻气凝胶具有薄壁的互穿三维多孔结构,如图2(c)。还原前的GO表面呈片状结构且光滑,见图2(a)。与其形成对比,图2(b)中 PGA表面呈现不均匀性且粗糙,这可能是多巴胺除还原作用外,还会在GO表面发生自聚合反应,生成聚多巴胺,涂覆在GO表面,使得PGA表面发生了明显变化。气凝胶的多孔结构使PGA具有较大的比表面积,提供更多内部相互连通的孔道,石墨烯本身的疏水性也赋予了PGA在油品及染料吸附方面的应用。

图2 样品的SEM照片

图1 气凝胶的宏观结构
2.2 XRD表征
GO与PGA的XRD谱图如图3所示,从图中可知10.2°处为GO (001)晶面的衍射峰,通过布拉格方程(2dsinθ=nλ)计算GO的层间距约为0.866 nm,较大的层间距主要是含氧官能团嵌入石墨片层后形成 GO 导致[10]。PGA的衍射峰明显向高角度偏移,移至25.8° (002)晶面,出现结晶度较差的宽峰,且强度有所减弱,说明多巴胺还原反应过程中,GO上的含氧官能团被有效地还原,层间距缩小至0.345 nm,层间距的变化也说明在多巴胺和水热还原过程中,石墨烯结构发生变化,形成气凝胶的结构[11]。
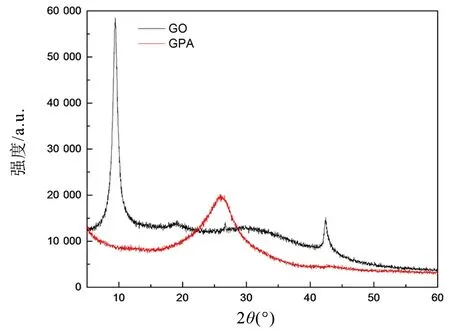
图3 GO与PGA的XRD谱图
2.3 FTIR表征
图4为GO与PGA的红外光谱图。GO在1 042,1 623,1 724和3 205 cm-1处出现了一些特征吸收带,它们分别代表C-O、C=C、C=O和-OH基团的伸缩振动[12-13],对于PGA的FTIR谱如下变化:C=C的吸收带1 623 cm-1的吸收峰发生偏移至1 615 cm-1,且强度有所增大,这是由于N-H和C=C键的重叠造成的,1 724 cm-1处的C=O特征吸收峰消失,3 000~3 600 cm-1处的吸收带也明显减弱,说明GO被有效还原。
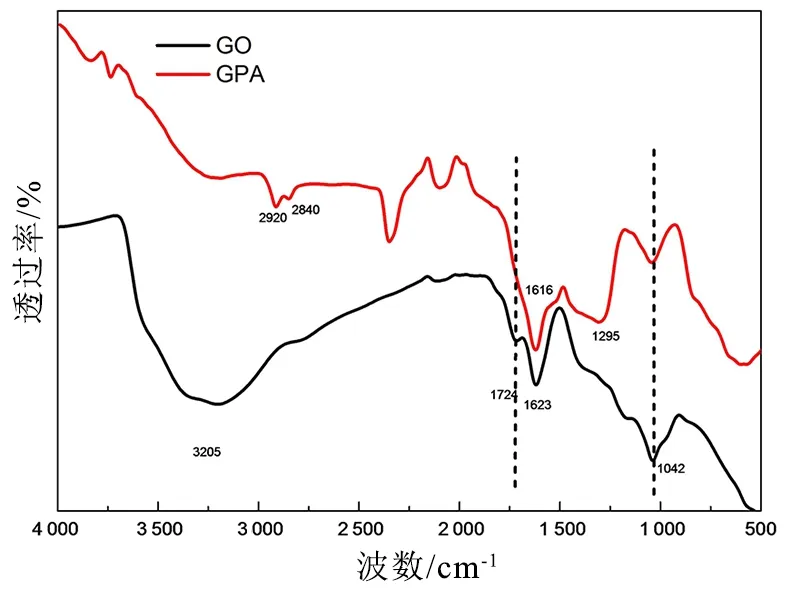
图4 GO和PGA的红外谱图
2.4 Raman表征
Raman图上的两个峰分别对应1 350 cm-1处的D带以及1 580 cm-1处的 G 带(图5)。D带峰来自sp3石墨基材料中存在的结构无序或缺陷,G带峰与 sp2碳原子在六角形碳骨架中的键拉伸振动有关,D峰/G峰的强度比(ID/IG)通常用于衡量结构的无序程度,数值越高,表明无序度越高。GO的ID/IG为0.98,经 PDA 还原后GPA 的D 峰明显增高,ID/IG为 1.21,数值明显增加,这是由于在还原过程中产生的更小尺寸的石墨烯片层,增加了边缘效应,导致无序结构的增多,GO 被有效还原。
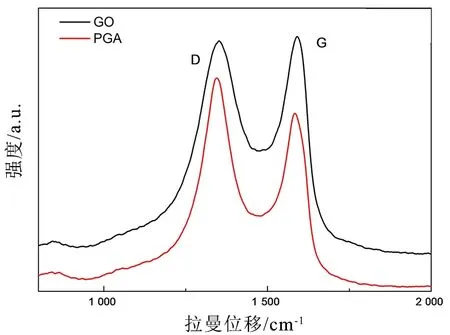
图5 GO和PGA的拉曼谱图
2.5 接触角表征
氧化石墨烯的水接触角接近0°,氧化石墨烯具有优良的亲水性能。图6 中PGA水的接触角为128°,具有明显的疏水性。归因于氧官能团数量的减少。以上结果表明,该石墨烯气凝胶PGA具有较大的比表面积、好的疏水性、低的密度(5.95 mg·cm-3)和多孔结构,可作为油/有机溶剂吸收剂的候选。
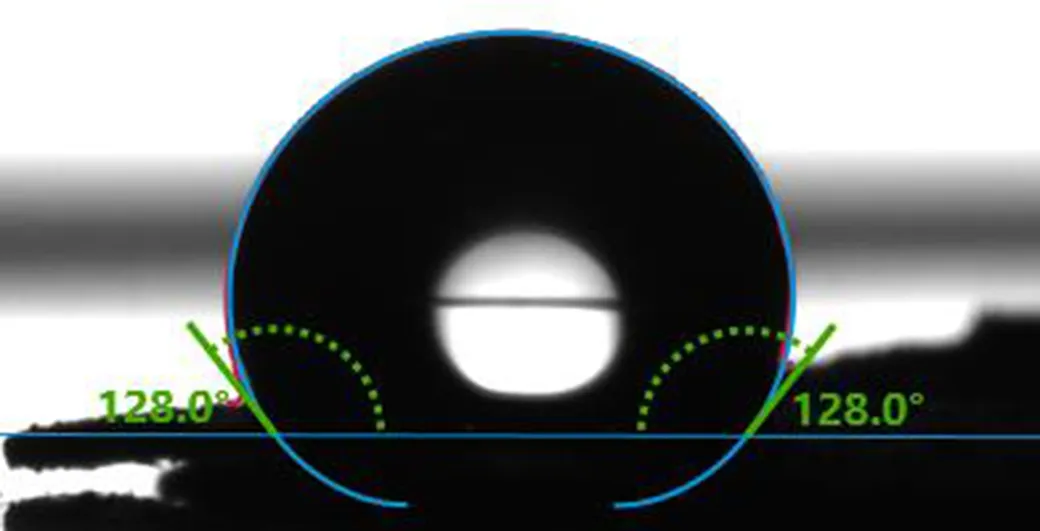
图 6 PGA的水接触角
2.6 吸油能力测试
PGA是一种重量轻,孔隙率高,亲油疏水的多孔材料,是油/有机溶剂的优良吸附剂,气凝胶的多孔结构为油/有机溶剂的进入和储存提供了很大的空间,为进一步验证气凝胶亲油性,本实验采用一块气凝胶与DMF(罗丹明染色)与三氯甲烷(罗丹明染色,在水中沉淀)接触,该材料能在几秒内迅速吸附有机溶剂,显示出对有机液体非常高的吸收效率,且对水完全不吸收,见图7(a)和图7(b)。同时还分别考察了PGA对多种有机溶剂的吸附容量,结果如图7(c)所示。气凝胶PGA对所有有机溶剂的吸附容量均超过60.0 g·g-1,其中对三氯甲烷吸附量最大,达120.5 g·g-1。

图7 PGA对有机溶剂的吸附
2.7 亚甲基蓝吸附研究
2.7.1 吸附动力学分析
对亚甲基蓝吸附研究结果见图8(a),在吸附前200 min,吸附容量随着时间的延长而增加,这是由于存在大量活性中心和较高的亚甲基蓝浓度差,随着对亚甲基蓝的吸附,吸附位点逐渐减少,达到平衡阶段。为了描述吸附机理,分别采用准一级[14]和准二级[15]吸附动力学模型对吸附过程进行拟合,相关拟合方程如下:
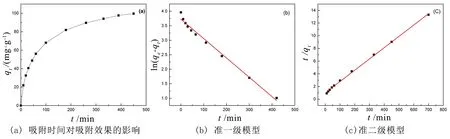
图8 亚甲基蓝的吸附动力学
准一级动力学方程
ln(qe-qt)=lnqe-k1t
准二级动力学方程
式中,k1为一级反应动力学速率常数(min-1);k2为二级反应动力学速率常数(g·(mg·min)-1);qe为吸附达到平衡时的平衡吸附量(mg·g-1);qt为t时刻的吸附量(mg·g-1);t为吸附时间(min)。
准一级动力学模型拟合曲线如图8(b),准二级动力学模型如图8(c)所示,模型参数见表1。由此可知,准二级模型的相关系数(R2)高于准一级模型。此外,与准一级(80.05 mg·g-1)相比,准二级(109.89 mg·g-1)的qe与实验数据(105.15 mg·g-1)更加接近。亚甲基蓝吸附过程很好地遵循了准二级动力学模型。
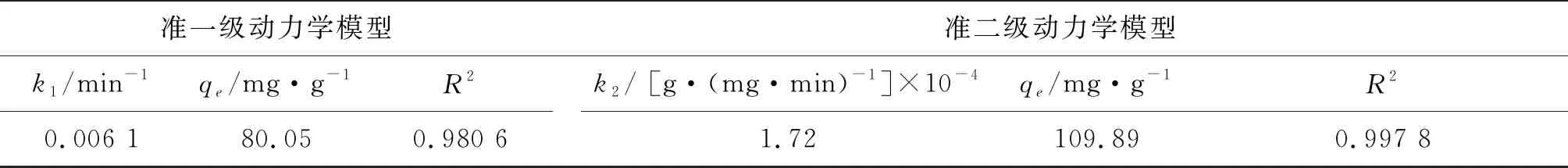
表1 准一级动力学和准二级动力学模型参数
2.7.2 吸附平衡
本研究还探讨了303.15 K温度下的吸附等温线,结果如图9(a)所示。吸附容量随亚甲基蓝的平衡浓度增大而增大,随后达到饱和状态。在相对较低的平衡浓度下,平衡容量随着平衡浓度的增大而增大,同时活性中心也随之减少。当所有的活性位点被染料分子占据后,达到饱和吸附。采用Langmuir和Freundlich两种典型的吸附等温线模型对实验数据进行拟合。Langmuir等温线模型是建立在均匀吸附剂表面单层吸附的基础上[16],其线性形式如下:
式中,Ce为平衡吸附浓度(mg·L-1);qe为平衡吸附量(mg·g-1);qmax为最大吸附量(mg·g-1);kL为吸附常数(L·mg-1)。
为了评价Langmuir模型的可行性,计算了分离因子(RL)。RL值表示Langmuir模型是有利(0
基于非均相表面多层吸附的Freundlich等温线具有以下线性方程[18]:
其中,kF(L·mg-1)为Freundlich常数,n为吸附强度。根据n值,吸附可分为难吸附(n<1)、易吸附(2≤n<10)和较难吸附(1≤n<2)3种类型。
图9(b)所示的Langmuir模型、图9(c)所示的Freundlich模型拟合结果的相关参数如表2所示。Langmuir模型比Freundlich模型更适合亚甲基蓝吸附拟合。此外,低的RL值也表明用Langmuir模型进行模拟是有利的。n<1意味着在303.15 K下吸附是可行且易进行的。基于以上分析,气凝胶对亚甲基蓝的吸附为单层吸附。
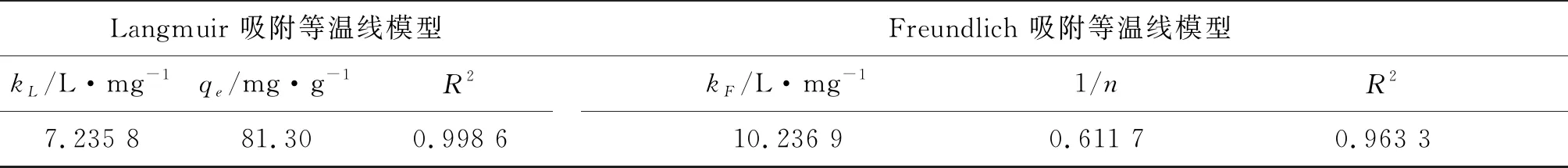
表2 Langmuir 和Freundlich 吸附等温线模型拟合参数表
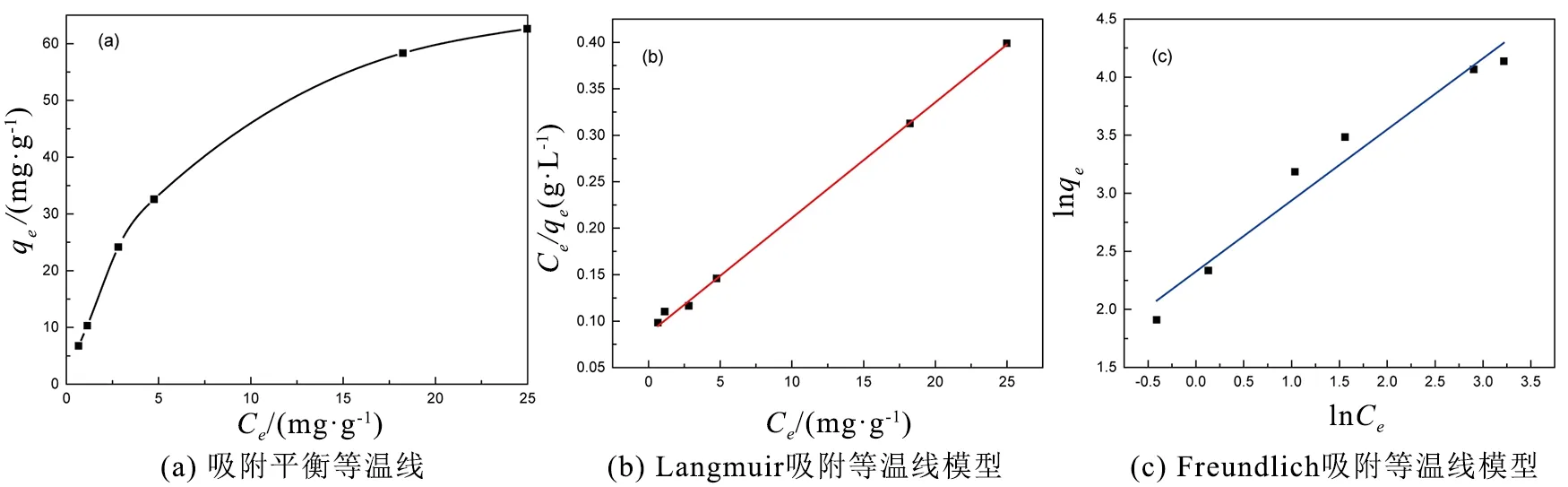
图9 亚甲基蓝的吸附等温线
3 结论
本研究以多巴胺作为黏合剂,水热法一步制备了三维结构完整、低密度(约5.95 mg·cm-3)、高疏水性(接触角128°)的气凝胶材料,其对不同的有机溶剂吸附量较大(50~120 g·g-1),且同时具有快速吸附有机溶剂的能力,对亚甲基蓝具有较好的吸附效果,其吸附遵循准二级动力学模型和Langmuir等温线模型。
