蛹虫草胞外多糖的提取工艺优化及其抗结肠癌活性研究
2020-11-14卫银侯笑笑杜笑常明昌孟俊龙刘靖宇
卫银,侯笑笑,杜笑,常明昌,2,孟俊龙,2,刘靖宇,2*
(1.山西农业大学 食品科学与工程学院,山西 太谷030801;2.黄土高原食用菌提质增效协同创新中心,山西 太谷030801)
蛹虫草(Cordyceps militaris)又名北冬虫夏草,隶属于子囊菌亚门、核菌纲、球壳目、麦角菌科,虫草属,是一种寄生在鳞翅目昆虫体内的真菌[1]。目前,我国蛹虫草已实现较大规模的生产,并在2009年被我国卫生部批准为新资源食品[2]。蛹虫草中含有多糖、虫草素、核苷、甾醇和色素等多种活性物质,具有免疫调节、抗氧化、抗衰老、改善慢性肾病和降血糖等药理活性[3~6]。其中多糖作为其最主要的生物活性物质之一,现已成为功能食品研究领域的热点[7,8]。
胞外多糖是一种可通过液体发酵技术,快速实现大量制备的菌株胞外活性代谢产物。目前,食用菌已成为制备功能性胞外多糖的重要真菌资源,其胞外多糖可作为生物反应调节剂和非特异性免疫刺激剂用于相关疾病的治疗[9~11]。现有的研究结果表明:不同提取条件对后续进行多糖提取效率、组分分离纯化,以及组分活性筛选的研究均会产生重要影响[12~14]。然而,现有蛹虫草胞外多糖的研究主要集中于对其液体发酵的最适培养基组分、液体发酵条件、生物学活性等方面[15~18],关于其胞外多糖具体提取工艺优化的研究少有报道。为此,本研究以蛹虫草液体发酵液为供试材料,通过Box-Behnken实验设计对蛹虫草胞外多糖的提取工艺进行优化,并采用MTT法检测其对结肠癌的抑制作用,以期为后续的结构鉴定和抗结肠癌活性等的相关研究提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 供试菌株
蛹虫草菌株CM-1由山西农业大学食用菌中心提供。人结直肠癌细胞株HCT-116购于中国典型培养物保藏中心(武汉)。
1.1.2供试培养基
斜面培养基:马铃薯200 g·L-1、葡萄 糖15 g·L-1、琼 脂20 g·L-1、KH2PO41 g·L-1、MgSO40.5 g·L-1;
平 板培养 基:马铃 薯100 g·L-1、葡萄 糖15 g·L-1、琼脂20 g·L-1、酵母膏5 g·L-1、KH2PO41 g·L-1、MgSO40.5 g·L-1;
发酵用液体培养基:葡萄糖20 g·L-1、酵母膏5 g·L-1、KH2PO41 g·L-1、MgSO40.6 g·L-1;
F12细胞培养基:F12复合培养基粉末、NaHCO32.438 g·L-1、胎牛血清10%、青霉素-链霉素-庆大霉素混合溶液1%、双蒸水配置。
1.1.3 主要试剂与仪器
3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑蓝(MTT)和二甲基亚砜(DMSO)购自igma-Aldrich;胰蛋白酶购自山西百奥生物技术有限公司;琼脂、酵母膏和青霉素-链霉素-庆大霉素混合溶液购自Solarbio公司;胎牛血清(FBS)购自Biological Industries;浓硫酸(优级纯)成都市科龙化工试剂厂;基本化学试剂均为国产分析纯。
LS-75HD型立式压力蒸汽灭菌锅(江阴滨江医疗设备有限公司);RGX型恒温摇床和DF-1001S型磁力搅拌器(北京中兴伟业仪器有限公司);RV10型旋转蒸发仪(德国IKA公司);MultifugeX1R型高速冷冻离心机和Orion StarA型pH计(赛默飞世尔科技有限公司);CHB-202型恒温金属浴(杭州博日科技有限公司);Cary60型紫外可见光分光光度计(安捷伦科技有限公司);HF240型CO2细胞培养箱(美国Thermo Fisher公司);TS100型倒置显微镜(尼康);Infinite F50酶标仪(瑞士Tecan公司)。
1.2 试验方法
1.2.1 蛹虫草发酵液的制备
在长势良好的PDA平板培养基上打孔(直径10 mm的圆形菌种块)若干,取3~5个菌块接种到每个装有150 mL PDA液体培养基的250 mL锥形瓶中,在25℃的恒温摇床中静置培养20 h后,以150 r·min-1的转速振荡培养144 h。将发酵培养完全的蛹虫草发酵液减压过滤,分离菌丝体与深层发酵培养液,将发酵液置于4℃下保存备用。
1.2.2 蛹虫草胞外多糖的提取
将制备好的发酵液在4 000×g下离心10 min,收集上清液,旋蒸浓缩。利用Sevage法除蛋白[12]:加入1/3体积的sevage试剂(氯仿∶正丁醇=3∶1),磁力 搅 拌器搅拌30 min,4 000×g离心15 min,收集上清液,重复操作至中间层无变性蛋白。调节所得上清液的pH,4 000×g离心15 min,收集上清液。加入无水乙醇使其终浓度达到70%,4℃下静置24 h。醇沉后的溶液7 000×g离心15 min,收集沉淀并加入少量蒸馏水溶解,冻干即可得到蛹虫草胞外多糖。
1.2.3 蛹虫草胞外多糖含量的测定
参照参考文献[12]制作标准曲线,采用苯酚-硫酸法测多糖含量。配制浓度为0.1 g·L-1的葡萄糖标准溶液,分别取标准溶液0、0.2、0.4、0.6、0.8、1 mL于试管内,用蒸馏水补至1 mL。加入5%苯酚1 mL和浓硫酸5 mL,涡旋振荡,置于30℃金属浴中反应30 min,冷却到室温,在490 nm处检测吸光值。
以葡萄糖溶液的浓度为X轴,吸光值为Y轴绘制标准曲线,得回归方程:
y=0.008 6x+0.012 1,R2=0.998 5。
准确配制蛹虫草胞外多糖溶液0.1 g·L-1,用苯酚-硫酸法测量其吸光值,根据标准曲线测定样品的多糖含量。
1.3 单因素试验
发酵液浓缩比例:在1.2.2蛹虫草胞外多糖提取方法的基础上,分别以1/2、1/3、1/4、1/5、1/6为浓缩比例,考察发酵液不同浓缩比例对胞外多糖提取量的影响。
乙醇浓度:在上述试验优化的基础上,分别以50%、60%、70%、80%、90%为醇沉浓度,考察不同乙醇浓度对胞外多糖提取量的影响。
醇沉时间:在上述试验优化的基础上,分别以6、12、18、24、30 h为醇沉时间,考察不同醇沉时间对胞外多糖提取量的影响。
发酵液pH:在上述试验优化的基础上,分别调节每组的pH为5、6、7、8、9,考察不同发酵液pH对胞外多糖提取量的影响。
以上单因素实验的每个处理均设置3个重复。
1.4 Box−Benhnken的试验设计
本试验在单因素试验的基础上,观察到醇沉时间因素所得胞外多糖产量变化幅度不明显,因此只选择浓缩比例(A)、乙醇浓度(B)、pH(C)为响应因素,以多糖提取量为响应值,设计3因素3水平的响应面分析组合试验(表1),以确定蛹虫草胞外多糖的最佳提取工艺。

表1 响应面因素水平表Table 1 Factors and levels of response surface
1.5 体外细胞试验
将制备好的蛹虫草胞外多糖溶于超纯水中,用0.22μm的滤膜过滤后调至不同浓度备用。HCT-116细胞培养在含有10%(v·v-1)胎牛血清的F12培养基中,在37℃,5% CO2的CO2培养箱中培养至对数生长期。
用MTT法[5]研 究 蛹 虫 草 胞 外 多 糖 对HCT-116细胞增殖的抑制作用。选取处于对数生长期的HCT-116结肠癌细胞,用胰蛋白酶消化后用F12培养基将细胞悬液稀释至每孔6.0×103细胞,在96孔板中每孔加入100μL细胞悬液,37℃,5%CO2培养24 h。用倒置显微镜观察细胞生长状况后,加入100μL含有不同浓度(0、0.6、1.0、1.6、2.0和2.8 g·L-1)胞外多糖的F12培养基,每个梯度设置五个复孔。37℃,5% CO2孵育48 h后,每孔加15μL的MTT试剂(5 g·L-1),继续孵育4 h。然后,吸除孔中混合液,每孔加150μL DMSO溶液以溶解细胞中的甲瓒,摇床上低速振荡10 min,在570 nm处用酶标仪测每孔的吸光值。胞外多糖对HCT-116细胞的存活率计算公式为:
存活率/%=[A1/A0]×100%
式中:A0为空白对照组在570 nm处的吸光值;A1为实验组在570 nm处的吸光值。
1.6 统计分析
数据采用平均值±标准差(x±s)表示。采用OriginPro 8.6对试验数据进行统计分析;采用Design-Expert 7.0软件对Box-Benhnken的结果进行分析。采用SPSS 16.0统计软件对IC50值进行回归分析和显著性分析。P<0.05为差异具有统计学意义。
2 结果与分析
2.1 单因素试验结果
2.1.1 发酵液浓缩比例对多糖提取量的影响
随着发酵液浓缩比例的增加,胞外多糖的提取量呈现先增加后下降的趋势(图1)。当发酵液浓缩比例为1/5时,蛹虫草胞外多糖的提取量达到最大,最大提取量为0.86 g·L-1。
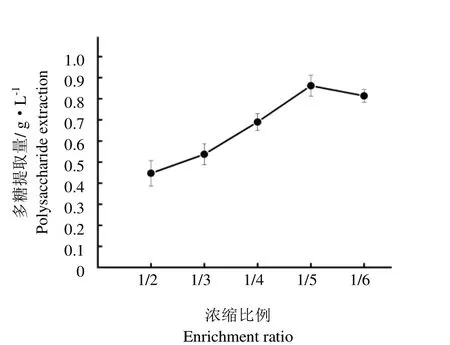
图1 浓缩比例对胞外多糖提取量的影响Fig.1 Effect of concentration ratio on the extraction rate of extracellular polysaccharide
2.1.2 乙醇浓度对多糖提取量的影响
如图2所示,蛹虫草胞外多糖的提取量随着乙醇浓度的增加而升高,但当乙醇浓度大于80%之后,提取量升高速度减缓。考虑到经济因素,因此选择80%为最佳乙醇浓度。
2.1.3 醇沉时间对多糖提取量的影响
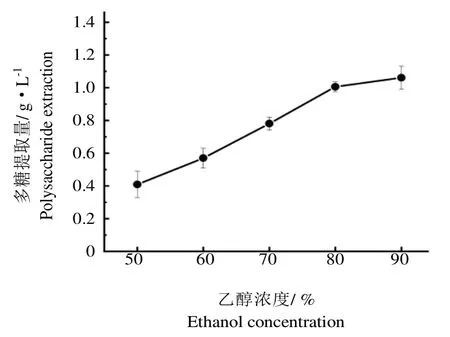
图2 乙醇浓度对胞外多糖提取量的影响Fig.2 Effect of ethanol concentration on the extraction rate of extracellular polysaccharides
在醇沉时间梯度增加的条件下,蛹虫草胞外多糖的提取量先逐渐增长后缓慢下降(图3)。当醇沉时间为24 h时,多糖达到最大提取量,最大值为0.98 g·L-1。因此选择24 h为最佳醇沉时间。
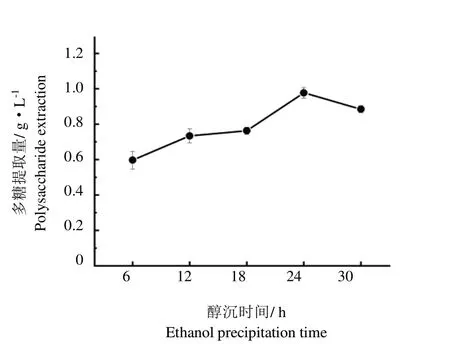
图3 醇沉时间对胞外多糖提取量的影响Fig.3 Effect of alcohol precipitation time on the extraction rate of extracellular polysaccharides
2.1.4 发酵液pH对多糖提取量的影响
如图4所示,当pH为5~8时,pH值与蛹虫草胞外多糖的提取量成正比,pH大于8时,其对多糖提取量有抑制作用。在pH为8时,蛹虫草胞外多糖的提取量达到最大,为1.584 g·L-1。

图4 pH对多糖提取量的影响Fig.4 Effect of pH on the extraction rate of polysaccharide
2.2 Box−Benhnken试验结果
综合考虑各单因素时选择醇沉时间为24 h,以浓缩比例(A)、乙醇浓度(B)、pH(C)为响应因素,多糖提取量为响应值,设计3因素3水平响应面试验。综合考虑了3个因素彼此之间的交互作用,设计表及结果见表2。回归拟合分析得到二元回归方程:
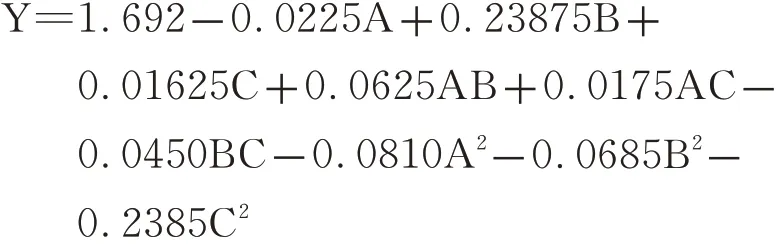
根据表3的响应面方差分析可得,B和C2对试验结果影响极显著,AB、A2及B2影响显著。试验的P值低于0.01,说明该试验的可信度在0.99以上。根据F值结果的分析,试验因素的影响顺序为乙醇浓度(B)>浓缩比例(A)>pH值(C)。

表2 响应面设计与结果Table 2 Program and experimental results of response surface
通过二维等高线图和三维响应面图分析显示(图5),随着A(浓缩比例)和C(pH)的增大,蛹虫草胞外多糖的提取量也随之增长,但A和C增大到一定程度后,胞外多糖的提取量有下降的趋势,且AC交互作用响应面图坡度较陡且二维等高线图呈椭圆形,说明对胞外多糖提取量的影响显著,与方差分析的结果一致。浓缩比例和乙醇浓度交互作用响应曲面图坡度较平缓,表明其对胞外多糖提取量的影响不显著;同时pH和乙醇浓度2个因素之间的交互作用也不明显。

表3 响应面模型的方差分析Table 3 Variance analysis of response surface quadratic model
通过Design-Expert 7.0统计软件,并结合响应曲面图和等高线图的结果综合分析,预测出蛹虫草胞外多糖最佳提取工艺为:浓缩比例0.191、醇沉时间24 h、乙醇浓度88.36%、发酵液pH7.44,在该情况下蛹虫草胞外多糖的最大提取量是1.781 g·L-1。
2.3 验证试验
采用上述最佳方案做验证试验,考虑到现实因素,将蛹虫草胞外多糖最佳提取工艺改为:浓缩比例1/5、醇沉时间24 h、乙醇浓度85%、发酵液pH 7.5。在此条件下进行验证实验,试验设置3重复,最终蛹虫草胞外多糖提取量的实验值是1.712 g·L-1,误差为3.87%,证明所建模型可靠。
2.4 体外细胞试验结果
通过体外细胞试验,考察不同给药浓度在48 h对人结直肠癌细胞株HCT-116增殖的抑制效果。结果如图6所示。由图6可见,蛹虫草胞外多糖对结肠癌细胞HCT-116显示较好的抑制效果,同时在 浓 度0~2.8 mg·mL-1范 围 内,胞 外 多 糖 对HCT-116细胞的抑制作用呈现出剂量依赖性。当浓度达到2 g·L-1时,抑制率达到58.10%。蛹虫草胞 外 多 糖 对HCT-116的IC50为1.483 g·L-1。这一结果表明:蛹虫草胞外多糖在相对较高的浓度下具有良好的抑制结肠癌细胞生长的活性,可作为辅助性抗结肠癌药物[17]。

图6 不同蛹虫草胞外多糖浓度下HCT-116结肠癌细胞的存活率Fig.6 Cell viability(HCT-116)of Cordyceps militaris extracellular polysaccharides at different concentrations
3 讨论与结论

图5 两两因素交互作用对胞外多糖提取量影响的响应曲面图和等高线图Fig.5 Response surface and contour plots of the interaction of two or two factors on the extraction of extracellular polysaccharides
本试验以蛹虫草菌株为供试材料,研究了不同提取条件下,蛹虫草液体发酵过程中胞外多糖的动态变化。且此次采用醇沉法和Sevage法提取蛹虫草胞外多糖,在单因素试验的基础上,采用Box-Behnken设计试验,得到蛹虫草胞外多糖的最佳提取工艺:发酵液浓缩比例1/5、发酵液pH 7.5、乙醇浓度85%、醇沉时间24 h,采用此工艺制备的胞外多糖提取量为1.712 g·L-1,纯度为56.39%。实验结果与侯宏波[19]运用纳膜浓缩,乙醇沉淀法制备发酵冬虫夏草胞外多糖的得率1.5 g·L-1,纯度50%相比,提取工艺更为稳定、可控、简单和高效,且胞外多糖提取量和纯度都有所提升。同时,实验结果显示:在24 h以内,蛹虫草胞外多糖的提取量随着醇沉时间的增加而增加,但当时间超过24 h,提取量呈下降趋势,这与MaXK等[20]关于烟曲霉胞外多糖产量随着沉淀时间的增加而增加的实验结果不一致。究其原因,可能是由于随着醇沉时间增加,导致部分胞外多糖溶于无水乙醇,进而使得提取量降低。发酵液pH在5~8的范围内,蛹虫草胞外多糖的提取量与pH值呈正相关。当发酵液pH为8时,胞外多糖的提取量达到最大值。而当发酵液pH为9,醇沉时锥形瓶底部会出现一层黑色粘性物质,多糖提取量明显降低,这种差异的出现可能与胞外多糖的单糖组成和化学结构有关[8,21]。
体外抗结肠癌活性分析实验的结果显示,添加蛹虫草胞外多糖48 h后,在体外可明显抑制结肠癌细胞的活性,其IC50为1.483 g·L-1,且在一定浓度范围内存在剂量依赖性。本研究成果将为蛹虫草胞外多糖结构与生理活性的深入研究,以及作为辅助性功能食品的开发提供重要的参考依据。
