草莓种间杂交后代与亲本性状比较
2020-11-14王淑珍周历萍裘劼人童建新柴伟国来文国
王淑珍,周历萍,裘劼人,童建新,余 红,柴伟国,来文国
(杭州市农业科学研究院 生物技术研究所,浙江 杭州 310024)
草莓属(Fragaria)约有25个种,分属2x、4x、5x、6x、8x、10x等不同倍性。我国是世界上野生草莓资源最丰富的国家,分布有14个种,包括9个二倍体种和5个四倍体种[1-2],分布着极有价值的珍贵类型,如白果类型、抗病类型(黄毛草莓F.nilgerrensis、五叶草莓F.pentaphylla)、芳香类型、抗寒类型(东北草莓F.mandschurica、东方草莓F.orientalis)等[1]。低倍性野生草莓资源具有抗病、抗逆、高芳香性,同时在高固形物含量、高钙钾铁元素含量和高氨基酸含量等方面也有较高的利用价值。野生草莓资源的利用是草莓新品种改良的潜力所在,是栽培品种改良的重要遗传资源[2-4]。目前生产上广泛栽培的主要是八倍体凤梨草莓(F.×ananassaDUCH.)。系谱和遗传多样性分析表明,草莓种内品种间杂交使栽培品种遗传背景狭窄,抗病性和抗逆性减弱[3]。国内外学者通过草莓种间杂交获得了具有潜在利用价值的种间杂交后代材料[1,3,5-7],例如雷家军等[1]用栽培品种哈尼(8x)和自然野生草莓黑龙江1号(5x)杂交,获得了种间杂种HH-1(6x);用汤姬(8x)和黑龙江7号(5x)得到了9x种间杂种[6]、十二倍体种间杂种YH15-10[7]等。这些种间杂交材料的获得可将野生草莓资源中的优良性状基因向栽培品种转移,丰富了优良草莓新品种选育的材料基础。本研究利用现有8x栽培种凤梨草莓资源与2x野生草莓资源进行种间杂交,通过对种间杂交后代和父母本的性状比较研究,评价和进一步利用种间杂种后代,创制丰富的优良育种材料,获得基因渐渗系。
1 材料与方法
1.1 材料
供试材料:2x森林草莓Ruegen (RG)、8x栽培品种红玉(Hongyu),RG×红玉的种间杂交后代6x RH28。材料来源于杭州市农业科学研究院。
1.2 方法
前期试验结果表明,田间自然条件下RG仅在小蕾期有少量具活力的花药,其余各阶段均未检测到花药活力,雌蕊柱头在大蕾期、开花第1天、开花第2天、开花第3天具弱可授性,其他花期柱头均不具可授性[2]。种间杂交于2017年2月下旬进行,RG×红玉正反交二组杂交组合,每组合杂交100朵花,同时对2个母本去雄10朵花套袋作为对照,观察去雄效果。杂交果实正常成熟时调查杂交结实率。采集杂交种子于当年5月下旬播种于苗床,当幼苗展开3片真叶时移栽于营养钵,于控温控湿玻璃大棚中培养,统计实生苗出苗率,并进行染色体倍性检测。2017年9月定植于栽培大棚,田间观察于2017年9月至2018年5月进行。
1.3 染色体数检测
1.3.1 根尖染色体数测定
采用1 mol·L-1HCl解离10 min,卡宝品红染色法观察根尖染色体数[5]。
1.3.2 流式细胞术测定染色体倍性
美国贝克曼Quanta.SC流式细胞仪检测染色体倍性,利用随机软件Cell Lab QuantaTM获取数据和直方图[8]。
1.4 不同倍性草莓植株叶片结构和细胞厚度测量
参照Solarbio番红-固绿染色液G1375试剂盒使用说明操作。
染色结果:细胞核和木质化细胞壁呈鲜艳的红色,细胞质和纤维素的细胞壁呈绿色。
测量与数据统计:番红-固绿染色片子在200倍或400倍镜下观察并拍照,用Image-Pro Plus 6.0软件分别测量植株叶片上表皮细胞、栅栏组织细胞、海绵组织细胞和下表皮细胞的直径,结果以均值±方差表示。
1.5 花药活力测定
采用TTC(2,3,5-氯化三苯基四氮唑)染色法测定小蕾期、中蕾期、大蕾期、开花第1~5天的花药活力,显微镜观察并统计有活力的花粉数目[2]。
1.6 植株性状观察与果实品质测定
对2个亲本和种间杂交后代进行田间性状观察,采集RG、红玉、RH28健康成熟果实,采用ATAGO便携式固形物含量测定仪进行可溶性固形物(TSS)含量测定,采用质构仪(CT3,美国Brookfield)进行硬度测定,测定方法参照文献[2,9]。
2 结果与分析
2.1 去雄结果
田间调查结果表明,去雄套袋的亲本RG和红玉均未得到正常膨大的果实和种子,说明去雄效果较好。
2.2 种间杂交结实与种子出苗情况
RG和红玉草莓正反种间杂交结实和播种实生苗出苗情况见表1。杂交结实率红玉×RG为15%,低于RG×红玉的22%;RG×红玉平均单果获种子数为9.8粒,多于红玉×RG的4.8粒;红玉×RG的实生苗出苗率为20.83%,大于RG×红玉的12.04%。由表2倍性检测结果可知,红玉×RG种间杂交后代倍性高于RG×红玉,推测倍性低种子出苗较差。

表1 不同倍性草莓种间杂交结实和种子出苗情况Table 1 Seed setting and emergence of different ploidy strawberry interspecific hybrids
2.3 种间杂交后代染色体倍性检测
分别对46株RG×红玉实生苗和15株红玉×RG实生苗进行流式细胞术染色体倍性检测,RG为CK1,红玉为CK2,结果如表2所示。RG×红玉杂交后代中2x、3x、4x、5x、6x植株占比分别为19.57%、45.65%、19.57%、13.04%、2.17%,4x以下的低倍性实生苗占了84.79%;红玉×RG杂交后代3x、4x、5x、6x植株占比分别为20.0%、26.67%、26.67%、26.67%,未检出2x植株,4x以下的低倍性实生苗占比46.67%。
采用根尖染色体数卡宝品红染色法和流式细胞术检测细胞核DNA相对含量,对2个亲本RG、红玉,以及种间杂交后代RH28植株分别进行了染色体倍性检测。结果表明,RG根尖染色体数为14条(2n=2x=14)、细胞核DNA相对含量210.7;红玉根尖染色体数为56条(2n=8x=56),细胞核DNA相对含量802.3;RH28根尖染色体数为42条(2n=6x=42),细胞核DNA相对含量612.3(图1、表2)。
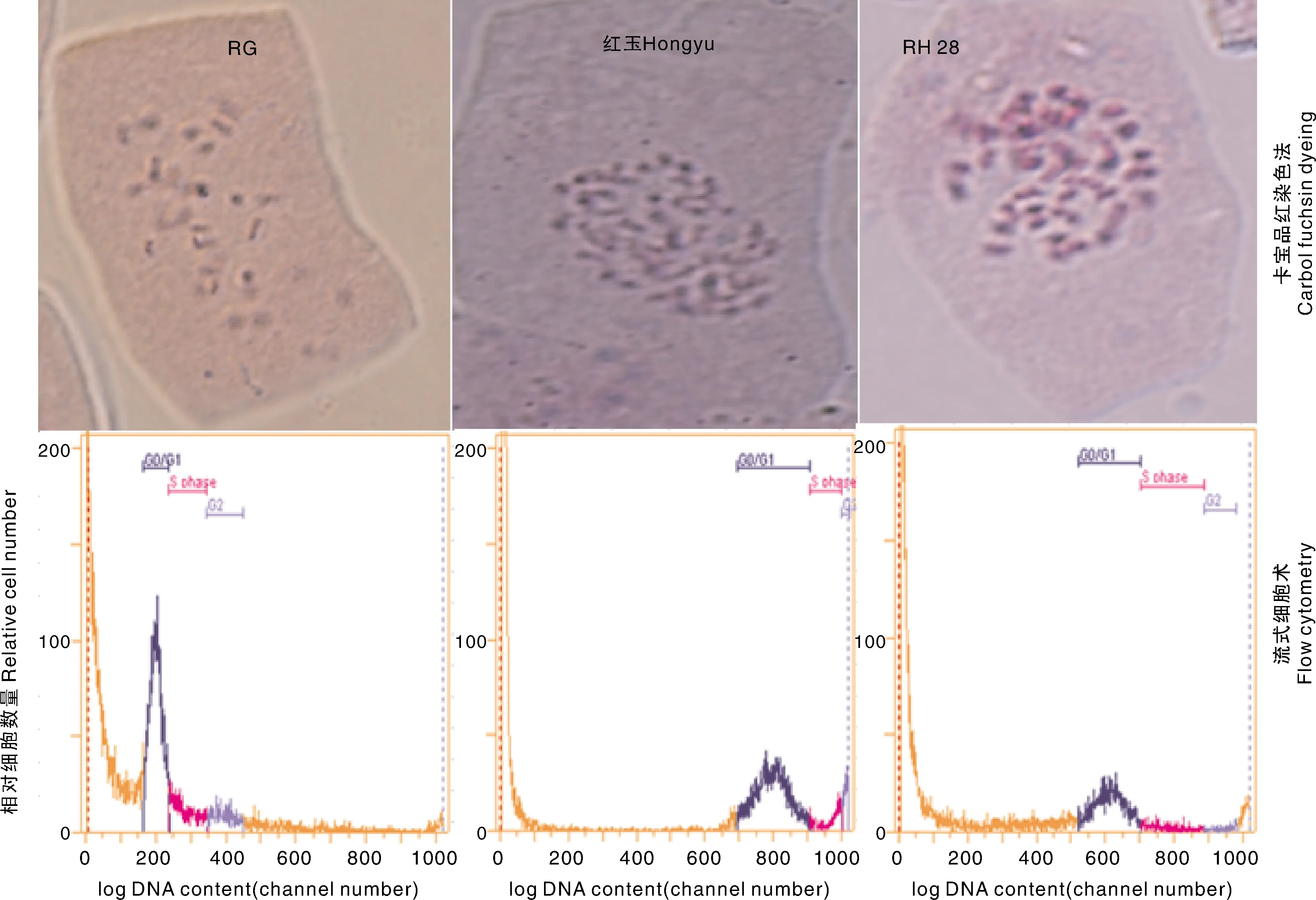
G0/G1,DNA合成前期;S ohase,DNA合成期;G2,DNA合成后期。G0/G1, DNA synthesis prophase; S ohase, DNA synthesis stage; G2, Last stage of DNA synthesis。图1 不同倍性草莓植株染色体倍性Fig.1 Chromosome ploidy of different ploidy strawberry plants

表2 种间杂交后代倍性流式细胞检测结果Table 2 Test results of flow cytometry on ploidy of interspecific hybrid progeny

续表2 Continued Table 2
2.4 不同倍性草莓植株性状比较
2.4.1 叶片组织
用番红-固绿染色法观察不同倍性(2x RG、8x红玉和6x RH28)草莓植株叶片结构,测量各细胞厚度。由表3、图2可见,红玉叶片上表皮厚度为(33.46±4.58)μm,大于RH28和RG,但差异未达显著水平(P>0.05);红玉叶片栅栏组织厚度最大,为(10.48±2.11)μm,显著(P<0.05)大于RH28和RG;红玉叶片海绵组织厚度为(11.85±1.71)μm,显著大于RG,RH28叶片海绵组织厚度居中,为(11.04±1.01)μm;红玉和RH28的叶片下表皮厚度分别为(17.53±2.15)μm和(17.36±1.85)μm,均显著大于RG。试验结果表明,叶片组织结构厚度与基因倍性成正比。

图2 不同倍性植株叶片组织电镜图Fig.2 Electron micrograph of leaf tissue of different ploidy plants

表3 不同倍性植株叶片细胞厚度比较Table 3 Comparison of cell thickness in leaves of different ploidy plants μm
2.4.2 株型、花粉活力、果实品质
从图3、表4、表5可见,RG植株矮,分枝极多,匍匐茎抽生困难;开花时花朵小,雄蕊数少,仅在小蕾期有少量具有活力的花药,花粉活力为(16.74±3.16)%,其余各阶段均未检测到花粉活力;果实软,硬度为59.8 g·cm-2,果实含水量为83.97%,口感软绵,种子外凸,TSS含量为11.5%。红玉植株匍匐茎抽生正常,可通过匍匐茎繁苗保存种源;红玉花粉活力强且花粉量多,各阶段均有一定的花粉活力,在大蕾期和开花第1天达到高峰,花粉活力分别为(49.41±3.91)%和(57.29±2.33)%;果实硬度为366.4 g·cm-2,果实含水量为93.20%,汁水丰富口感好,TSS含量为7.8%。种间杂交后代RH28植株略高于RG,分枝数少于RG,能抽生少量匍匐茎,可通过匍匐茎繁苗保存种源;花朵大小和雄蕊数介于2个亲本之间,在花期各阶段均能检测到花粉活力,花粉活力的变化趋势与红玉相同,在大蕾期和开花第1天达到高峰,花粉活力分别为(32.13±4.42)%和(35.92±3.61)%,各阶段的花粉活力小于红玉,但大于RG,这利于后续用栽培种回交提高杂交成活率;果实硬度为184.2 g·cm-2,果实含水量为89.70%,TSS含量为10.4%,种子凸于果面。

表5 不同倍性草莓的果实硬度、含水量、TSS含量比较Table 5 Hardness, water content and TSS content of different ploidy strawberries
3 结论与讨论
本研究通过不同倍性草莓的种间杂交获得了5x、6x等不同倍性草莓材料,并对六倍体种间杂种RH28的植株形态、品质性状等进行了鉴定。结果表明,2x RG和8x红玉的正反交试验中,RG×红玉的杂交结实率高于红玉×RG,这与RG作母本时严格控制授粉时间在大蕾期至开花第3天,并授予足够量的父本花粉有关,而RG作父本时其花药仅在小蕾期有弱活性,花粉量少且活性弱导致杂交结实率低下,这与王淑珍等[2]的试验结果一致。但种间杂交的不亲和性使二组杂交组合的杂交结实率远低于常规栽培品种之间(8x×8x)的杂交结实率(一般均可达90%以上)。RG×红玉杂交种子出苗率低于红玉×RG,RG×红玉杂交后代中4x以下的低倍性占了84.79%,而红玉×RG杂交后代4x以下的低倍性占比46.67%,表明出苗率与杂交后代低倍性占比高低相关,这2个试验结果印证了低倍性野生种源与栽培种杂交时易产生杂交不结实、杂交种子成活率低等不亲和现象。RG×红玉杂交后代实生苗中3x植株占比为45.65%,2x、3x合计占比约达80.00%;而红玉×RG杂交后代中未检出2x植株,3x、4x、5x、6x植株的占比较接近,这可能与杂交后代性状遗传以母本为主导相关,杂交后代染色体倍性与母本存在较大的关联性。2组种间杂交组合获得了2x、3x、4x、5x、6x等多种倍性的种间杂交后代,这应该与草莓中除正常减数配子外还存在未减数配子相关。时翠平等[4,10]研究发现,在草莓中存在未减数配子;细胞学研究结果表明,草莓2n花粉的形成主要是由于减数分裂过程中,中期2个纺锤体的定向发生改变所致,由正常的十字形变为平行形和八字形,进而形成了二分体和三分体,每个二分体产生2个2n花粉,每个三分体产生1个2n花粉和2个n花粉,此外还发现有极少量4n花粉。Bringhurst等[11]利用8x智利草莓和2x森林草莓杂交得到5x、6x、9x后代,认为5x来自双亲正常减数配子,6x来自森林草莓的未减数配子,9x来自智利草莓的未减数配子。此外,草莓属种间杂交发现偏母实生苗,研究认为它们来源于假受精的无融合生殖[7]。
种间杂交后代变异大,在创造新种质、新类型、新品种方面具有独特之处。国内外科学家已通过种间杂交得到了具有优良特质的多种倍性材料,加快了野生草莓资源的利用步伐[1,3-7,10-12]。本试验所获种间杂交后代RH28在植株叶片细胞组织结构株型、TSS含量等方面介于父母本之间,但RH28已克服了母本RG匍匐茎抽生难这一缺点,可以通过抽生匍匐茎繁殖保存种源;同时RH28改善了母本RG花粉活力低、有活力花粉时期短的缺陷,在各个阶段均有一定量的花粉活力,这为后续继续用8x栽培种回交进行渐渗系创制、选育新品种提供了基础。
试验中我们关注到在大棚常规栽培条件下二倍体野生型黄毛草莓、东北草莓只开花,不能正常结果,仅有二倍体森林草莓RG能正常结果,但RG出现了花药败育现象,花药仅在小蕾期有弱活性,这也是红玉×RG杂交结实率低的主要原因。后续我们将从形态学、生理、蛋白质组学等多方面进行研究,探寻RG花药败育的机理。种间杂种鉴定方法包括了形态学观察、染色体数目检测、同功酶鉴定、原位杂交、分子生物学技术等。流式细胞术因其快速、简便、所需样品量少等优点在染色体倍性快速鉴定中得到广泛应用,但倍性鉴定存在一定误差。卡宝品红染色法染色体倍性鉴定准确度高,但草莓属植物染色体小,多倍体种染色体数目众多,染色体观察难度大、操作技术要求高。本试验种间杂种鉴定方法采用形态学和染色体数目检测,根据流式细胞术快速鉴定结果,结合田间观察挑选部分种间杂交后代进行卡宝品红染色法倍性鉴定验证。后续我们将利用多种方法对种间杂种进行鉴定,以期挖掘更多有价值的种间杂交后代。
