SERS-HPLC联用技术对邻氨基苯硫酚与邻碘苯甲酰氯反应的监测
2020-11-13张晨杰徐敏敏袁亚仙姚建林
张 辉,张晨杰,徐敏敏,袁亚仙,姚建林
(苏州大学材料与化学化工学部,苏州215123)
高效液相色谱(HPLC)因其高效的分离性能而广泛应用于食品安全[1]、生物[2]、医药[3]及环境保护[4]等领域.然而HPLC技术存在局限性,如难以分开极性相似的混合物,难以提供结构信息等[5].联用技术的出现解决了这些问题,如与质谱(MS)联用定量测定食品组成、分析产物结构及产物收率等[6].但该联用技术对于一些未知组分的结构分析仍较困难[7,8].因此,亟待发展一种高效分离与结构鉴别的联用技术.
振动光谱可用于物质结构的鉴别.将HPLC与振动光谱技术联用可用于研究复杂多变的有机反应历程.表面增强拉曼光谱(SERS)具有高灵敏度的特点,可使信号增强10个以上数量级[9],实现单分子检测.因此,将SERS与HPLC联用可在分离基础上实现结构鉴别.目前,该联用技术已成功用于检测生物碱[10]、农药[11]、染料[12]以及药物代谢[13]等. 近年来,我们[14]已将SERS-HPLC联用技术运用在有机反应体系中,以有序Au纳米粒子二维阵列膜为基底,实现了对苯硼酸和3-溴吡啶的Suzuki偶联反应的实时连续分离和检测,同时也检测到反应副产物联苯.温度、催化剂、溶剂和酸碱度等可能导致不同历程的有机反应.目前,SERS-HPLC联用技术主要集中在固定反应条件下有机反应体系的研究.
邻氨基苯硫酚(OATP)为含有巯基(—SH)和氨基(—NH2)的双官能团分子,—SH的存在使其易在基底吸附而被SERS检测[15],此外,其在酰氯存在下极易形成硫酯化合物或酰胺化合物[16,17].催化剂一方面用于改变反应的活化能,使反应速率提高,另一方面催化剂也会参与反应,如铜催化剂活化邻位的C—H/C—N环化反应中,铜催化剂与活性位点进行配位生成稳定的铜离子络合物,通过去质子化作用完成反应[18].本文以OATP与邻碘苯甲酰氯反应为模型体系,选用具有较高可重复性的固相二维有序Au纳米粒子阵列为SERS基底,采用SERS-HPLC联用技术进行现场监测,研究该反应中的催化剂效应并解析相应的反应过程.
1 实验部分
1.1 试剂与仪器
四水合氯金酸(HAuCl4·4H2O,纯度99.9%)、二水合柠檬酸三钠(Na3C6H5O7·2H2O,纯度99.0%)、盐酸羟胺(NH2OH·HCl,纯度98.5%)、醋酸铜、三乙胺和邻碘苯甲酰氯(C7H4ClIO)均为分析纯,购自国药集团化学试剂有限公司;甲醇(色谱纯)购自伊诺凯科技有限公司;邻氨基苯硫酚(分析纯)购自麦克林生化科技有限公司;聚乙烯吡咯烷酮(PVP,Mw=10000,分析纯)购自百灵威科技有限公司;1,4-二氧六环(分析纯)购自艾览化工科技有限公司;实验用水为超纯水(电阻率≥18.2 MΩ·cm).
LabRam HR800型共聚焦显微拉曼光谱仪(法国Jobin Yvon公司,激光波长为632.8 nm,到达样品的功率约5 mW,狭缝和共焦针孔均为100 μm,物镜为奥林巴斯50X长焦镜头);UltiMate™3000型高效液相色谱仪[美国赛默飞世尔科技公司,配备自动进样器、四元泵、柱温恒温箱、Hypersil GOLD C18色谱柱(5 μm,4.6 mm×250 mm)以及可变波长紫外检测器(DAD)];Q-TOF3型质谱仪(美国布鲁克科技有限公司);AVANCE NEO 400 MHz液体超导核磁共振波谱仪(瑞士布鲁克公司).
1.2 基底制备过程
参照文献[19]方法制备15 nm金纳米粒子溶液.将1 mL 1%(质量分数)HAuCl4·4H2O的水溶液稀释为0.01%的水溶液,加热至沸腾保持回流,迅速加入2 mL 1%(质量分数)柠檬酸三钠水溶液,溶液从淡黄色逐渐变为灰色及酒红色.15 min后自然冷却至室温,即得15 nm金纳米粒子溶液.
参照文献[20]方法制备30 nm金纳米粒子.取25 mL上述金纳米粒子溶液,分别加入1 mL 1%(质量分数)的柠檬酸三钠水溶液,1 mL 1%(质量分数)PVP水溶液及20 mL 25 mmol/L的NH2OH·HCl水溶液.在常温低速搅拌下,以60 mL/h的速度滴入20 mL 0.1%(质量分数)的HAuCl4水溶液,30 min后溶液由酒红色变为粉红色最后变为紫红色,即得到30 nm左右的金纳米粒子溶液.
Au纳米粒子单层膜的制备:参照文献[21]方法,取3 mL 30 nm Au纳米粒子溶液,在自制的挥发装置中于40℃下真空干燥16 h.在气液界面逐渐形成一层致密均匀的Au纳米粒子单层膜.将纳米粒子单层膜通过提拉的方式转移至干净的硅片表面,干燥后作为SERS基底待用.
1.3 醋酸铜的催化反应
向OATP(0.22 mmol)的无水1,4-二氧六环溶液中加入Et3N(0.4 mmol). 室温下搅拌30 min后,加入Cu(OAc)2(0.01 mmol)作为催化剂,然后滴加邻碘苯甲酰氯(0.2 mmol),在110℃下反应12 h后,向溶液中加入适量饱和NaHCO3水溶液,并用乙酸乙酯萃取.产物通过柱层析分离提纯[洗脱液:n(PE)/n(EtOAc)=10∶1]. 未加Cu(OAc)2的实验用于对比研究.
1.4 SERS-HPLC联用监测
从反应体系内取0.2 mL样品,通过在采样针头处0.22 μm的过滤器滤除不溶物后,用甲醇稀释至1.5 mL,将配制好的样品置入HPLC自动进样器,用于SERS-HPLC系统检测.
2 结果与讨论
2.1 SERS-HPLC联用系统的构建
将PEEK管一端与HPLC的DAD检测器相连,另一端连接带有刻度的高压微量分流阀.设计带储液凹槽的手动旋转平台,凹槽内装有可灵活更换的修饰Au纳米粒子单层膜的硅片作为SERS基底,以便消除SERS检测的“记忆效应”.检测过程中系统流速为1 mL/min.10 μL待测液通过自动进样器注入HPLC中,具有不同保留时间的物质先后流经DAD检测器后流入拉曼光谱仪检测平台下的转盘,通过调节分流阀的流速,使流出液到达载有Au纳米粒子单层膜的硅片表面,从而快速获得SERS谱.
2.2 无催化剂条件下反应过程分析
选取OATP和邻碘苯甲酰氯为反应底物,以甲醇和水(体积比70∶30)混合溶液为流动相.首先,测定OATP标准样品的HPLC谱(图S1,见本文支持信息),观察到保留时间分别为4.2和6.4 min时的谱峰.由于—SH极易自偶联产生二硫化物而被HPLC所检测.为了验证此可能的反应产物,在标准样品中加入少量三乙胺,原保留时间为4.2 min时的吸收峰消失[图S1(B)],其源于三乙胺使二硫化物S—S键断裂[22].保留时间为6.4 min时的流出液的SERS与OATP光谱特征一致[图S1(C)],由此6.4 min时的色谱峰可指认为OATP.值得说明的是,在4 min附近时仍可观察到弱峰,SERS检测时并未观察到除溶剂外的特征谱峰,判断其为溶剂峰.
图1为OATP与邻碘苯甲酰氯反应12 h后的SERS-HPLC检测结果,保留时间为12.1和15.2 min时观察到明显的色谱峰,表明反应可能生成了两种不同产物[图1(A)].对比二者相应的光谱特征[图1(B)],发现前者(12.1 min)在1662 cm—1处检测到C=(O)—S的C=O伸缩振动峰,在1250 cm—1处观察到归属于酰胺Ⅲ谱带的特征峰.因此,12.1 min时的色谱峰归属为硫酯类化合物.后者(15.2 min)仅观察到1500 cm—1处的峰,归属于酰胺N—H的剪式振动,以及1350 cm—1处的峰,归属于仲酰胺的C—N伸缩振动,表明15.2 min时的色谱峰归属为酰胺类化合物.
当产物中存在S—S键,其因吸附金属纳米粒子而断裂形成硫-金属键[23],因此并未检测到该峰;对于硫酯,其中C(=O)—S的结构可能存在互变异构C(—O—)=S,C=S与Au纳米粒子相互作用,易测得硫代酯的SERS信号[24].两种产物SERS谱中存在相同频率的特征峰,表明产物吸附在金属表面的结构相似,据此判断保留时间为12.1和15.2 min时的产物分别为双取代酰胺键的硫酯(1b)及二硫化物与酰氯生成的酰胺(2b).
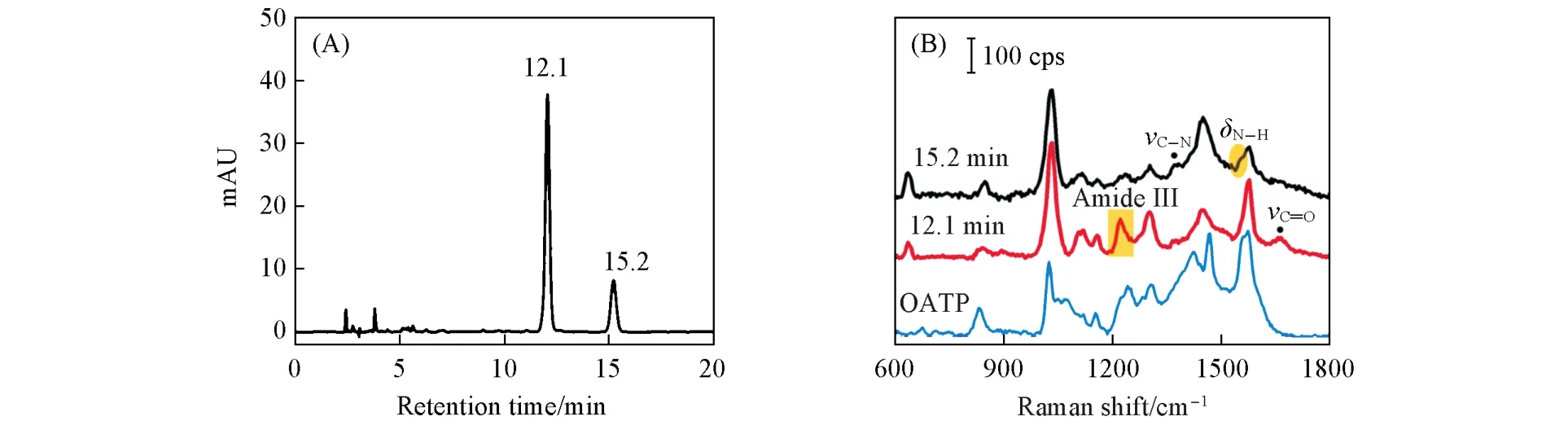
Fig.1 HPLC chromatogram of the reaction solution after 12 h without catalyst(A)and SERS spectra of the effluent at retention time of 12.1 and 15.2 min(B)
为进一步研究该反应历程,采用联用技术测定了不同反应时间内混合体系的组成.如图2(A)所示,反应初始并未观察到反应物的色谱峰,说明两种反应物混合后立即生成新物质,如在7.8 min时观察到新色谱峰,该峰强度随反应时间的增加而降低,其对应的SERS谱如图2(B)所示.图中在1250~1300 cm-1范围内观察到N—H弯曲及C—N伸缩振动相互作用的酰胺Ⅲ谱带,1370 cm-1处的谱峰归属为C—N伸缩振动,1445 cm-1处的谱峰归属为N—H的弯曲振动,此类特征峰均为酰胺Ⅱ谱带.综上可知,7.8 min时的色谱峰归属为OATP与邻碘苯甲酰氯生成的2-碘-N-(2-巯基苯基)苯甲酰胺.
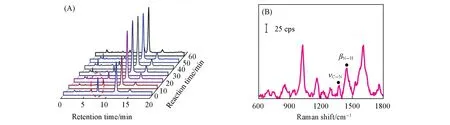
Fig.2 Time⁃dependent HPLC chromatograms of the reaction solution within 1 h(A)and SERS spectra of effluent at retention time of 7.8 min(B)
图3为反应0,2及6 h后溶液的SERS-HPLC检测结果.反应起始保留时间分别为5和6 min时流出液的SERS谱如图3(B)所示,两者光谱特征相似,但并未在HPLC中检测到对应的色谱峰[图3(A)].在8 min时流出液中检测到2-碘-N-(2-巯基苯基)苯甲酰胺的特征谱峰,反应2 h后,该色谱峰和SERS谱峰均消失,说明此物质参与反应并完全消耗.
反应2和6 h后,5,6和8 min时的流出液中未检测到除溶剂外的SERS特征谱峰,在12和15 min时对应流出液中检测到两种产物的SERS特征谱[图3(C,D)].由此可知,反应初始阶段存在少量未被HPLC检测到的反应物,SERS因极高灵敏度而可检测这些物质的特征谱峰,随反应时间延长反应物迅速被消耗而无法观察到特征SERS谱峰.
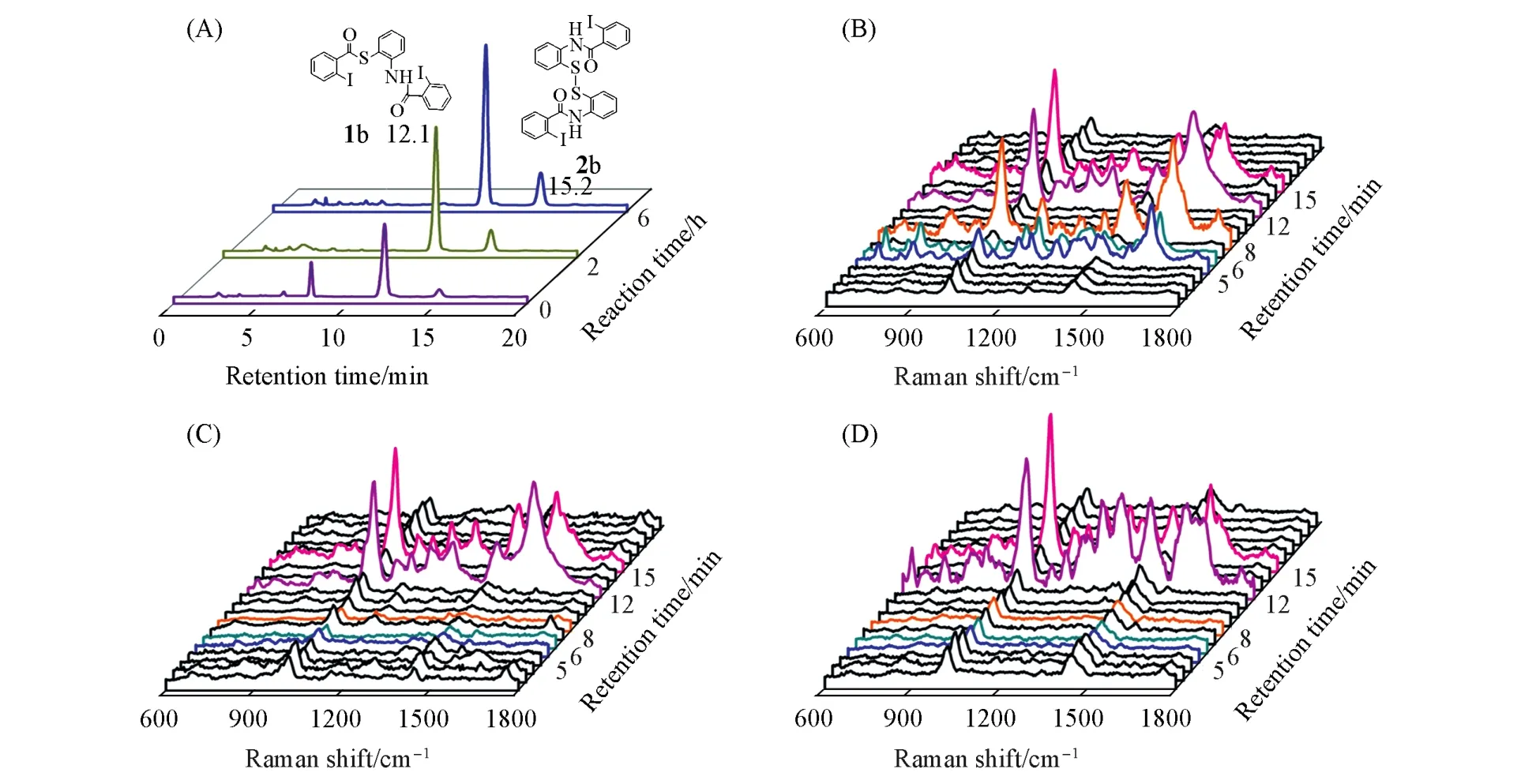
Fig.3 HPLC chromatograms of the reaction solution after 0,2 and 6 h without catalyst(A),time⁃dependent SERS spectra of effluent after 0 h(B),2 h(C)and 6 h(D)with the interval time of 1 min
2.3 催化剂条件下反应过程分析
通常,OATP与邻碘苯甲酸甲酯反应生成苯并硫氮杂卓酮[25],上述无催化剂实验中,比邻碘苯甲酸甲酯活性更高的邻碘苯甲酰氯未与OATP反应得到类似结构产物,于是引入醋酸铜为催化剂研究了上述反应行为,催化反应12 h后体系的SERS-HPLC检测结果如图4所示.由图4(A)可见,仅生成了保留时间为12.1 min时的产物,但与无催化剂下相同保留时间产物的SERS谱[图4(B)和图1(B)]对比,发现两者的谱峰特征存在明显差异.

Fig.4 HPLC chromatogram of the reaction solution after 12 h with catalyst(A)and SERS spectra of the effluent of 12.1 min reaction without(a)and with(b)catalyst(B)
由图4(B)可见,位于700 cm—1左右的谱峰归属为Ph-S-Ph类化合物的C—S伸缩振动,1760 cm—1处存在内酰胺的酰胺Ⅰ特征谱峰,700~900 cm—1范围内的谱峰归属为C—N对称伸缩振动,在650~700 cm—1范围内的谱峰归属为C(=O)—N的面内变形振动,由此可知,12.1 min时的流出液所含物质结构应为内酰胺类化合物.由于其SERS光谱与无催化剂条件下产物1b显著不同,通过薄层层析法判断两种物质极性时发现,产物3b极性略低于产物1b,由此可知,其结构中存在无可被取代的活性氢,在催化剂作用下的产物应为苯并硫氮杂卓酮类化合物(3b).
考虑到提取1 h内的反应体系易造成催化剂的损失而影响反应的进行,仅对反应0和1 h的体系进行SERS-HPLC的分离检测,发现保留时间为12.1 min时的色谱峰出现明显的肩峰,其对应于两种物质.随着反应时间延长,肩峰逐渐消失,说明产物之间存在结构互变,主产物3b由产物1b经重构而成(图S2,见本文支持信息).将初始阶段和反应1 h后流出液与标准样品的SERS光谱进行对比,表明产物3b的形成与产物1b有关(图S3和图S4,见本文支持信息).
分别对反应0,1和6 h后的溶液进行SERS-HPLC联用检测(图5).可见,反应0,1和6 h内保留时间5~10 min时检测到多个色谱峰,且在HPLC谱中未出峰的流出液也检测到SERS特征谱[图5(A)];随着反应进行,检测到SERS谱峰的时间区间逐渐减少;从SERS谱图中判断仅在反应起始阶段检测到产物1b的信号[图5(B)],反应1和6 h内在12.1 min时的流出液中仅检测到归属于产物3b的特征峰[图5(C,D)].以上现象表明催化剂存在时,体系内首先出现多种活性物质参与反应生成了产物3b,随着反应进行,反应速率加快,活性物质逐渐被消耗,体系内的物质结构发生由复杂趋向于单一的变化,最终得到产物3b.
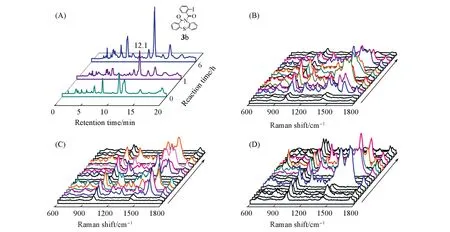
Fig.5 HPLC chromatograms of the reaction solution in 0,1 and 6 h with catalyst(A),time⁃dependent SERS spectra of effluent after 0 h(B),1 h(C)and 6 h(D)with the interval time of 1 min
2.4 催化剂条件下反应机理
OATP、2,2′-二硫代二苯胺先与邻碘苯甲酰氯反应分别形成酰胺化合物2-碘-N-(2-巯基苯基)苯甲酰胺及产物2b{N,N′-[二硫(2,1-亚苯基)]二(2-碘苯甲酰胺)},2-碘-N-(2-巯基苯基)苯甲酰胺由于其存在游离的巯基,故存在两种反应路径:(1)光照下2-碘-N-(2-巯基苯基)苯甲酰胺形成硫自由基后经偶联生成产物2b;(2)2-碘-N-(2-巯基苯基)苯甲酰胺与另一分子的邻碘苯甲酰氯反应生成产物1b.
产物1b在醋酸铜作用下,其酰胺键与催化剂形成络合物中间体Ⅰ,邻碘苯甲氨酰基自由基离去与酰胺键反应,硫自由基与催化剂形成络合物中间体Ⅱ,邻位的碘离子受到催化剂的影响离去,而活性硫自由基进攻邻位从而生成产物3b,如Scheme 1所示.
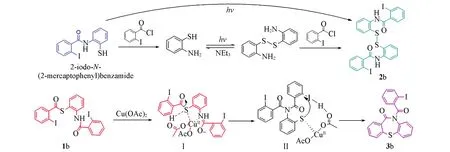
Scheme 1 Proposed reaction processes OATP and 2⁃iodobenzoly chloride with catalyst
2.5 反应产物的核磁共振波谱分析
采用核磁共振波谱(1H NMR)和质谱(MS)(图S5,见本文支持信息)对反应产物进行验证,反应后的混合溶液通过柱层析分离获得产物.
产物1b{S-[2-(2-碘苯甲酰氨基)苯基]-2-碘代苯硫酸盐}为白色固体,1H NMR(400 MHz,DMSO-d6),δ:10.20(s,1H),8.02(dd,J=7.9,1.0 Hz,1H),7.94(d,J=7.9 Hz,1H),7.84~7.73(m,2H),7.70~7.53(m,3H),7.49(d,J=4.6 Hz,2H),7.42(td,J=7.6,1.4 Hz,1H),7.32(td,J=7.7,1.6Hz,1H),7.27~7.18(m,1H).HRMS(ESI):[M+H]+:585.8833. 产物2b{N,N′-[二硫(2,1-亚苯基)]二(2-碘苯甲酰胺)}为浅黄色固体,1H NMR(400 MHz,DMSO-d6),δ:10.35(s,1H),7.96(d,J=7.9 Hz,1H),7.68(dd,J=7.7,1.8 Hz,1H),7.53(d,J=4.6 Hz,2H),7.41(d,J=7.5 Hz,1H),7.38~7.21(m,3H).HRMS(ESI):[M+H]+:708.8979.产物3b{10-(2-碘苯甲酰基)二苯并[b,f][1,4]硫氮杂-11(10H)-酮}为黄色固体,1H NMR(400 MHz,DMSO-d6),δ:7.96(dd,J=7.9,1.0 Hz,1H),7.82(dd,J=7.7,1.3 Hz,2H),7.69(ddd,J=24.1,7.9,1.3 Hz,2H),7.62~7.37(m,6H),7.18(td,J=7.7,1.7 Hz,1H).HRMS(ESI):[M+H]+:457.9689.
实际上,NMR测定对产物的纯度、用量及溶剂均有较苛刻要求,需要繁琐的分离提纯过程,且难以获得反应的动态变化信息,具有一定的局限性.而SERS-HPLC联用体系可直接检测混合样品,且所使用的样品浓度低(10—2~10—3mol/L),用量少(甚至可进行痕量检测),可快速获得随时间变化的反应行为.
综上所述,本文以Au纳米粒子单层膜为基底,构建了SERS-HPLC联用技术,实现了对邻氨基苯硫酚与邻碘苯甲酰氯的反应研究,无催化剂时反应生成产物1b和2b,在醋酸铜催化下生成3b.与传统检测手段相比,HPLC-SERS联用技术不需要复杂的提纯过程,样品需求量少及可连续分析,是一种快捷简便的分离检测技术,同时对反应体系内的活性物质可以快速捕获并推测其结构,为反应过程的解析提供了一种高效新技术.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200379.
