教学考试杂志社“优师计划”阶段性成果展示——化学反应原理相关试题选登
2020-11-13
【例1】三元催化,是指将汽车尾气排出的CO、HC(碳氢化合物)和NOx等有害气体通过氧化和还原作用转变为无害的二氧化碳、水和氮气的催化。三元催化器的载体部件是一块多孔陶瓷材料,安装在特制的排气管当中。称它是载体,是因为它本身并不参加催化反应,而是在上面覆盖着一层铂、铑、钯等贵重金属和稀土涂层。它可以把废气中的HC、CO变成水和CO2,同时把NOx分解成氮气和氧气。HC、CO是有毒气体,过多吸入会导致人死亡,而NOx会直接导致光化学烟雾的发生。
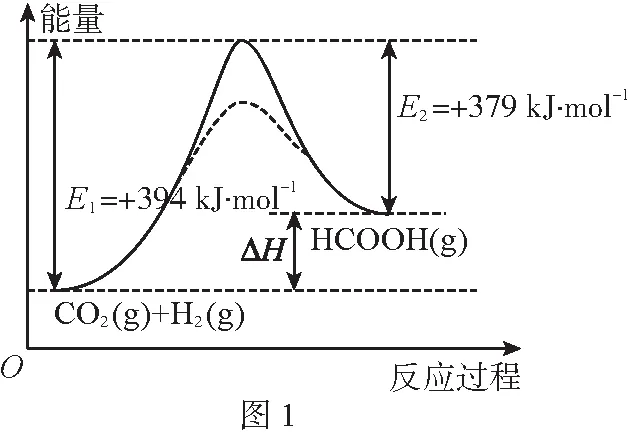
(1)图甲是1 mol NO2(g)和1 mol HC(g)反应生成N2和CO2、H2O过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是(填“增大”“减小”或“不变”,下同),ΔH的变化是,用电子式表示CO2的形成过程:________。

(2)经科学研究发现,NOx和HC是两种导致光化学烟雾的主要气体。通过三元催化后,将其转化成CO2、N2和H2O。现以NO2与CH4为研究对象,进行相关的物质转化研究:
Ⅰ.已知:在进行三元催化过程中发生以下主要反应。





物质NO2CH4N2CO2H2O体积分数0.250.250.1250.1250.25
此温度下该反应的平衡常数K=________。
(3)据研究发现,以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和HC直接转化成乙醇。将乙醇以一定的比例回收冲入汽油中变成乙醇汽油,提高燃料的利用率。

①在不同温度下催化剂的催化效率与乙醇的生成速率如图所示。250~300℃时,温度升高而乙醇的生成速率降低的原因是______________。
②为了提高该反应中HC的转化率,可以采取的措施是______________。

CO2在电极a放电的电极反应式是______________。
【答案】(1)减小 不变

(3)①温度超过250℃时,催化剂的催化效率降低 ②增大CO2的浓度(或及时将乙醇液化分离)

【解析】(1)催化剂由于改变了反应途径而改变反应所需的活化能,但焓变值只与反应体系的始末物质种类和状态有关,不受催化剂的影响;对于用电子式表示物质的形成过程,只要抓住电子式是在原子层次表示物质形成的过程即可。(2)考查的是盖斯定律和平衡常数的计算。(3)考查的是速率的影响因素和平衡的影响因素(勒夏特列原理的应用)。温度超过250℃时,催化剂的催化效率降低,所以速率会下降。(4)考查的是电化学电极反应式的书写。从图示中可以知道,CO2得到电子生成CO,再利用O2-平衡电荷和元素即可正确写出该电极反应式。

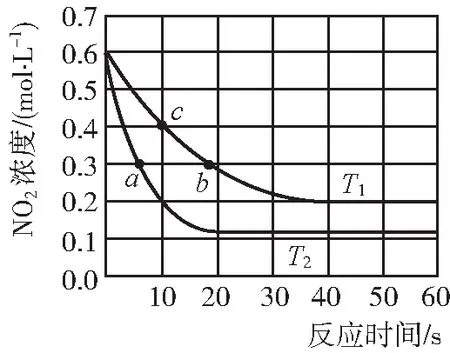

②T2温度下,0~10 s内,O2的反应速率v(O2)=。T2温度下,要减少NO2的分解率,并缩短达到平衡的时间,可采取的单一措施有______________。
③平衡常数KT1(填“大于”“小于”或“等于”,下同)KT2,理由是______________。
④T1温度下,平衡常数KT1=,若平衡后再向体系中充入2 mol NO2(g)和2 mol NO(g),反应向(填“正反应”或“逆反应”)方向进行。


【答案】(1)①32 ②0.02 mol·L-1·s-1增大NO2的浓度(其他合理答案均可) ③小于 (1分)T2时反应速率较大,故T1 (2)X点之前,增大压强,平衡逆向移动,N2的体积分数减小;X点以后,由于压强太大,水变为液态,此时正反应气体系数减小,增大压强,平衡正向移动,N2的体积分数增大 【例3】回收利用CO2是环境科学研究的热点课题,请回答以下问题: (1)天然气还原CO2制备合成气的有关反应如下: (2)H2在一定条件下还原CO2制备HCOOH(沸点:100.7℃),能量变化如图1所示。 在1 L恒容密闭容器中充入一定量CO2、H2,发生如下反应: 实验测得:v正=k正·c(H2)·c(CO2),v逆=k逆·c(HCOOH)(k正、k逆为速率常数,只与温度有关)。TK 下达到平衡,H2的平衡转化率为80%,c(CO2)=0.5 mol/L。 ①达到平衡后,仅升高温度,k正增大的倍数(填“大于”“小于”或“等于”)k逆增大的倍数。 ②使用高效催化剂,下列活化能变化合理的是(填字母)。 选项ABCDE1/(kJ·mol-1)384404344374E2/(kJ·mol-1)359389329399 ③改变下列条件时,ΔH可能发生变化的是________(填字母)。 a.升高温度 b.降低温度 c.增大氢气浓度 d.加入催化剂 (3)用NaHCO3替代CO2作碳源加氢制备HCOOH。在反应容器中加入NaHCO3水溶液、铝粉和铜粉,在300℃下反应。当碳量一定时,铝、铜的量对碳转化量影响结果如图所示。 实验组xyzgn(Al)/n(C)8∶18∶18∶12∶1n(Cu)/n(Al)2∶11∶11∶24∶1 由图2可知,比较四条曲线,曲线g对碳转化量影响很小的主要原因是。 当碳的转化量为25%时所采用的最佳实验条件是。 (4)工业上常用高浓度的K2CO3溶液吸收CO2得溶液X,再利用电解法使K2CO3溶液再生,其装置如图3所示: ①阳极区产生CO2的原因是(用离子方程式表示); 【答案】(1)+247.0 (2)①大于 ②C ③b ④8 L·mol-1 (3)其他条件相同时,铝的量对碳转化量影响较大,g组实验铝的量较小x(120 min) 【例4】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。 回答下列问题: (1)CO的燃烧热为。若1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ 的能量,则NO2(g) 分子中一个氮氧键(设NO2分子中含2个氮氧键)断裂时需吸收的能量为kJ。 (2)CO将NO2还原为单质的热化学方程式为。 时间/s012345c(NO)/(mol)2.000.900.500.300.200.20c(CO)/(mol)7.206.105.705.505.405.40 ①前2 s内的平均反应速率v(N2)=,该温度下,该反应的平衡常数K=。 ②关于该反应说法正确的是(填字母)。 A.c(CO2)=c(NO) 时反应达到平衡 B.该反应的能量变化如图甲 C.汽车尾气冬天比夏天对环境的危害大 D.反应达平衡后向其中通入一定量的NO,NO的转化率增大 ①t1时反应速率变化的原因为______________, ②t2时改变的反应条件为。 【答案】(1)-283 kJ/mol 469.5 (3)①0.037 5 mol·L-1·s-125 L/mol ②BC (4)①由题设条件可知该反应为放热反应,升高反应温度,逆反应速率大于正反应速率,平衡逆向移动,化学反应速率增大 ②使用催化剂或增大反应体系压强 【例5】锗(Ge)是第四周期ⅣA族元素,是重要的半导体材料,在多个领域都有广泛而重要的应用。 (1)画出锗的原子结构示意图:______________。 (2)利用高品位二氧化锗还原制得金属锗,而二氧化锗可以通过在四氯化锗中加入6.5倍体积的蒸馏水,搅拌后放置一昼夜,生成二氧化锗沉淀,用冷水洗涤至洗液不含Cl-为止。200℃下干燥得到二氧化锗产品。请写出该过程的化学反应方程式:。 ①该反应为(填“放热”或“吸热”)反应,A、B、C三点的平衡常数K(A)、K(B)、K(C)的大小关系为,压强的大小关系为p1(填“大于”“小于”或“等于”)p2。 ②若A点时,保持容器容积和温度不变,向容器中再充入2 mol CO(g)、4 mol H2(g)和2 mol CH3OH(g),则v正(填“>”或“<”)v逆。 (4)以甲醇为原料设计成燃料电池:若以熔融Na2CO3作为电解质,一极充入甲醇,另一极充入空气和CO2气体。 则充入空气和CO2气体的电极为极,充入甲醇电极的反应式为。 (3)①放热K(A)=K(B)>K(C) 小于 ②> 起始(mol/L) 4 8 0 转化(mol/L) 2 4 2 平衡(mol/L) 2 4 2 【例6】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。 已知反应器中存在如下反应过程: 化学键H—HO—HC—HC←O键能E/(kJ·mol-1)436465a1 076 根据上述信息计算:a=,ΔH2=。 (2)CO2、CO分别与H2反应生成CH4的lgK与T的关系如图所示: p1(填“大于”“小于”或“等于”)p2;为提高CO2平衡转化率除改变温度和压强外,还可采取的措施是______________。(写一条即可) (5)氢气可以还原乙醛(CH3CHO)得到乙醇,电解乙醛的酸性水溶液也可以制备出乙醇和乙酸,则生成乙酸的电极为(填“阴”或“阳”)极,对应的电极反应式为______________________。 【答案】(1)415.1 -41.4 kJ/mol (2)小于 0 (3)大于 及时移出CH3OH或H2O(g) 起始物质的量(mol) 1 3 0 变化物质的量(mol)x2xx 平衡物质的量(mol) 1-x3-2xx