牛源A型多杀性巴氏杆菌的免疫检测
2020-11-11郑冰洁胡长敏胡涌刚郭爱珍
郑冰洁,胡长敏,胡涌刚*,郭爱珍*,
(1.华中农业大学生命科学技术学院,农业微生物学国家重点实验室,湖北武汉 430070;2.华中农业大学动物医学院,湖北武汉 430070)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)是一种高度流行的病原体,能在多种家畜和野生动物中传播。Carter和Heddleston等对多杀性巴氏杆菌进行了分型鉴定[1-3]。Pm一共有5个荚膜血清型和16个脂多糖血清型,且不同血清型往往与特定疾病相关联[4,5]。自2008年以来,病牛中分离到荚膜血清A型Pm的报道逐渐增多[6-8]。该Pm是引起牛呼吸系统疾病、犊牛地方性肺炎以及牛运输热病的主要病原体之一[9,10],给养牛业造成了巨大的经济损失。因此,发展相应的检测方法实现快速、准确鉴定并定量检测牛源A型Pm对于探索其致病机理、助力流行病学调查、预防和控制牛源A型Pm引起的相关疾病、促进健康养殖以及发展国民经济有十分重要的意义。
目前,牛源A型Pm的研究处在初级阶段。分离培养是细菌分型鉴定的经典方法,也是当前鉴定A型Pm最常用的方法。该方法需要经过病原菌分离培养、细菌形态和培养特性观察、生化反应鉴定、荚膜血清型特异性基因的PCR扩增凝胶电泳等程序才能准确确定其血清学分型[11,12]。分离培养法主要缺陷在于步骤繁琐、通常需要耗时4~5 d,无法满足现场、快速定量检测的需要。最近,郭爱珍课题组[13]建立了基于DNA提取的鉴别诊断牛源A型Pm的多重PCR方法,该方法将检测时间缩短到3~4 h以内,对牛源A型Pm的最低检测浓度达到8.0×105CFU/mL。但是,该PCR方法仍然需要通过在实验室操作凝胶电泳实现定性定量检测,无法满足现场、快速定量检测的需要。
免疫检测方法与分子诊断方法相比具有价格低、能实现病原菌的直接检测、能满足现场快速检测的需要等优点。但是,现有文献表明,国内外尚未见有免疫方法用于牛源A型Pm检测的相关报道。本课题组利用全菌蛋白免疫小鼠,首次筛选到了针对牛源A型Pm的单克隆抗体,并将抗体与磁珠偶联制备了免疫磁珠,建立了一种基于磁珠的“双抗夹心”免疫显色方法,成功实现了牛源A型Pm的快速检测。与传统PCR方法相比,不需要制备PCR模板、不需要进行琼脂糖凝胶电泳,检测时间缩短到1 h。该方法操作简单,结果通过显色可以直接观察,特异性好,能满足现场、快速检测的需要。免疫磁珠检测有效期可达半年之久,具有良好的批间稳定性和批内稳定性,显示出良好的商品化开发前景和潜在的应用价值。
1 实验部分
1.1 仪器及试剂
Multiskan 1510全波长酶标仪(美国,Thermo Fisher Scientific);ZWY-240恒温培养振荡器(上海智城分析仪器制造有限公司);纯水仪(美国,PALL)。
小鼠抗牛源A型Pm抗体由实验室制备,牛源A型Pm、牛源B型Pm、大肠杆菌、链球菌、金黄色葡萄球菌、牛支原体、沙门氏菌、溶血曼氏杆菌、变形杆菌均为本实验室保存的临床分离株。2-吗啉乙磺酸(MES)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、辣根过氧化物酶(HRP)(Sigma公司)。脱脂奶粉、大豆酪蛋白琼脂培养基(TSA)、大豆酪蛋白肉汤培养基(TSB)、类胸膜肺炎微生物(PPLO)培养基(美国BD公司)。牛血清白蛋白(BSA)(Biosharp公司)。羧基修饰磁珠(直径1 μm,浓度50 mg/mL)(德国Chemicell公司)。其它所有试剂均为分析纯(国药集团)。水为超纯水。
1.2 实验方法
1.2.1 细菌培养将纯化保存的各菌株于TSA或PPLO培养基平皿上划线接种,放置在37 ℃恒温培养箱中培养10 h左右,挑取单菌落接种于TSB或PPLO液体培养基中扩大培养,37 ℃、180 r/min,恒温摇床培养过夜。取适量各菌液进行平板计数,剩余菌液用0.5%甲醛灭活18 h。菌液离心去除培养基,用pH=7.4的磷酸盐缓冲溶液(PBS)洗涤3次并重悬至合适浓度备用。
1.2.2 免疫磁珠(IMB)的制备磁珠(Magnitic Beads)混匀取适量到离心管中,置于磁力架上磁性分离去除上清液,加入1 mL MEST缓冲液(100 mmol/L MES,pH=5.0,0.05%Tween 20)洗涤2次,去除上清液。迅速加入新鲜配制的200 μL EDC/NHS(10 mg/mL),混匀后25 ℃摇床120 r/min活化30 min。磁性分离去除上清,PBS充分悬浮磁珠,洗涤3次。加入抗Pm单克隆抗体(McAb1),25 ℃摇床振荡孵育过夜。磁性分离去除上清,PBS洗涤3次除去未结合抗体。加入BSA与脱脂奶粉的混合封闭剂(Blocking Agent),封闭磁珠表面未偶联抗体的活化羧基基团,25 ℃摇床振荡封闭4 h。洗去封闭剂,PBS重悬免疫磁珠,存于4 ℃冰箱备用,长期保存需在悬液中添加蛋白保护剂和抑菌剂。
1.2.3 酶标抗体的制备0.5 mL超纯水溶解5 mg HRP,加入1 mL 0.06 mol/L NaIO4,室温下避光轻搅20 min。加入1 mL 0.16 mol/L的乙二醇,振荡1 h终止氧化反应。在活化HRP中加入5 mg的抗体(McAb2),混匀后装入透析袋,于0.05 mol/L,pH=9.6的碳酸盐缓冲溶液中低温透析过夜。透析后反应液转移至离心管中,加入0.2 mL 4 mg/mL的NaHB4,4 ℃反应2 h。加入等体积的饱和(NH4)2SO4溶液沉淀结合物,离心弃上清。将沉淀物溶于PBS(0.02 mol/L,pH=7.4)中透析除去(NH4)2SO4,即得酶标结合物。加甘油等保护剂后小量分装,于-20 ℃保存备用。
1.2.4 菌体的免疫检测免疫磁珠用PBST洗涤3次,取适量加入到2 mL的离心管中,在阳性管中加入500 μL一定浓度的牛源A型Pm菌液和500 μL HRP标记的抗牛源A型Pm抗体(均用PBST缓冲液稀释),阴性管中加入500 μL PBST和500 μL酶标抗体,充分混匀磁珠,25 ℃摇床振荡孵育30 min。免疫磁珠与菌体和酶标抗体结合反应后,用PBST充分洗涤3次,磁性分离去除上清,每管各加100 μL TMB底物反应A液与B液,与磁珠充分混合,显色反应8~10 min,加入100 μL 1 mol/L H2SO4终止反应。在磁性分离架上磁性分离,每管各取200 μL上清于96孔酶标板中,酶标仪检测450 nm波长处的吸光度值。
2 结果与讨论
2.1 实验原理
本研究检测牛源A型Pm流程如图1所示:以表面修饰了羧基的Fe2O3@SiO2磁性微球为载体,利用EDC/NHS将磁珠活化直接与一抗进行偶联,然后封闭未结合的位点,制备免疫磁珠。将目标分析物与免疫磁珠共同孵育,磁珠将菌体从反应液中精准捕获。HRP标记的抗体作为检测抗体与菌体表面的另一抗原蛋白结合,形成免疫磁珠-目标菌体-酶标二抗的复合物。在加入TMB底物液后发生显色反应,通过颜色变化直接可判定结果。

图1 基于磁珠的免疫分析法用于检测牛源A型Pm流程图Fig.1 Immunoassay based on magnetic beads for rapid detection of bovine capsular serotype A Pm
2.2 实验条件的优化
如图2(a)所示,磁珠用量在5~25 μg的范围内,检测信噪比(S/N)随磁珠用量的增加而增加。原因是相同时间内磁珠量越多,捕获的菌体越多,磁珠过量时,单个微球捕获的菌数减少,与酶标二抗的结合效率降低,非特异性吸附增加,噪声升高导致信噪比降低。数据表明,25 μg的磁珠用量可以使检测的信噪比达到最大值。

图2 免疫检测条件的优化(牛源A型Pm的检测浓度为1.0×106 CFU/mL,以信噪比(S/N)的值来判定结果,S/N表示阳性对照组的吸光值与相同条件下阴性对照组的吸光值的比值)。主要优化了(a)磁珠用量,(b)封闭剂的选择,(c)包被浓度的优化,(d)酶标抗体浓度的优化Fig.2 Optimization of detecting conditions with the concentration of serotype A Pm at 1.0×106 CFU/mL(S/N represents the ratio of the absorbance of the positive control group to that of the negative control group under the same conditions).Effect of magnetic bead dosage on the detection of serotype A Pm(a).Effect of the blocking agent(b).And effect of coating concentration(c) and HRP-IgG concentration(d) on the detection of serotype A Pm(Error bars=± SD and n=5)
常用来作为封闭剂的惰性蛋白有BSA和脱脂奶粉(S.M.),配制2%BSA、5%BSA、2%S.M.、5%S.M.、2%BSA+S.M.及5%BSA+S.M.作为封闭剂来进行实验。图2(b)表明2%脱脂奶粉的封闭效果最好,因此选用2%的脱脂奶粉为后续实验的封闭剂。
如图2(c)所示,优化了捕获抗体在1~90 μg/mL范围内的信噪比,抗体浓度从1 μg/mL增至30 μg/mL时,信噪比随浓度的增加而增加,表明低于该浓度时磁珠与抗体结合还未饱和;当高于30 μg/mL时信噪比出现稍微平稳的趋势,因此本实验选择30 μg/mL作为捕获抗体包被磁珠的包被浓度。
同样,为了获得酶标二抗最佳用量,对HRP标记的检测抗体的浓度从0.05~0.75 μg/mL进行了优化。图2(d)表明,信噪比随着酶标抗体浓度的增加而上升,在0.25 μg/mL时检测的信噪比达到最大值,继续提高浓度其比值开始下降。这可能是由于当浓度高于0.25 μg/mL后,酶标抗体的非特异性吸附加剧,阴性信号的值升高的趋势比阳性信号升高趋势要快,最终使信噪比降低。0.25 μg/mL作为酶标抗体的最优浓度进行后续实验。
2.3 工作曲线、检测限、重现性
在最优检测条件下,按上述方法进行免疫分析,以吸光度作为纵坐标,以牛源A型Pm稀释浓度的自然对数值(lnc)作为横坐标。如图3所示,菌浓度在1.0×105~1.0×107CFU/mL的范围内,其吸光度线性良好得到线性方程:y=0.61991×lnx+0.2488(R2=0.99),检测限(S/N=3)为1.0×105CFU/mL。结果表明:本研究提出的免疫检测方法灵敏度明显高于PCR检测方法(检测限为8.0×105CFU/mL)[13],具有良好的应用前景。
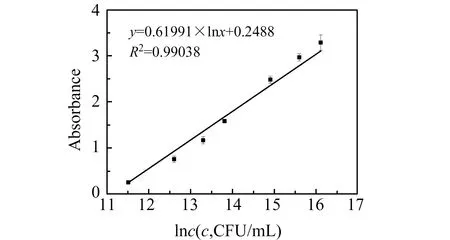
图3 吸光度与菌浓度的线性关系Fig.3 Linear relationship between the absorbance and the concentration of serotype A Pm ranging from 1.0×105 CFU/mL to 1.0×107 CFU/mL(Error bars=±SD and n=5)
为了检验本方法的重现性,本实验对1.0×106CFU/mL的牛源A型Pm做了10组重复性检测,通过数学统计得出这10组值的相对标准偏差(RSD)为4.38%,表明该检测方法有良好的重复性。
2.4 检测方法的特异性
本研究提出的免疫检测方法分别用于检测常见牛源病原体,包括金黄色葡萄球菌(S.aureus)、溶血曼氏杆菌(M.haemolytica)、大肠杆菌(E.coli)、变形杆菌(Proteobacteria)、链球菌(Streptococcus)、牛支原体(Mycoplasmabovis)、沙门氏菌(Salmonella)、牛源B型Pm、牛源A型Pm及混合菌液,检测浓度均为1.0×106CFU/mL。检测结果如图4所示:本研究提出的免疫检测方法对这几种牛病常见病原菌没有明显的交叉反应,只对牛源A型Pm呈现显著阳性结果,其他各病原菌检测的吸光度与PBS阴性对照组的吸光度相近。这一结果表明本方法的检测特异性良好。

图4 免疫分析法检测牛源A型Pm的特异性试验Fig.4 The specificity of the immunoassay.Each strain and the mixture at the same concentration of 1.0×106 CFU/mL,and the negative control(PBS) was tested using this immunoassay(Error bars=± SD and n=5)
2.5 模拟实际样品的检测
养牛场中采集到的牛鼻拭子(nose swab)、咽拭子(throat swab)、气管拭子(tracheal swab)和肺组织(lung tissue)样品作为实际检测样本,拭子样品用PBS稀释10倍,肺组织块加入适量PBS捣碎研磨之后,4 000 r/min离心10 min,取上清液用。在样品中添加牛源A型Pm作为阳性对照,以处理后未加菌体的样品作为阴性对照。将准备好的待检菌液和酶标抗体与免疫磁珠充分混匀,反应体系中菌浓度1.0×106CFU/mL,酶标抗体浓度0.25 μg/mL。25 ℃摇床振荡孵育30 min。反应后,用PBST充分洗涤3次,磁性分离去除上清,每管各加100 μL TMB底物反应A液与B液,与磁珠充分混合,显色反应8~10 min,加入100 μL 1 mol/L H2SO4终止反应。在磁性分离架上磁性分离,每管各取200 μL上清于96孔酶标板中,酶标仪检测450 nm处的吸光值。整个检测过程1 h左右即可完成。从图5中结果可见,阳性和阴性样品差异明显,表明该方法在实际样品中也能进行牛源A型Pm的检测。
3 结论
根据牛源A型Pm的流行现状及国民经济发展的迫切需要,本研究利用实验筛选得到的抗牛源A型Pm特异性抗体,结合磁珠易于分离的特点,建立了一种特异性检测牛源A型Pm的免疫诊断方法。该免疫检测方法具有成本低、灵敏度高、操作简单快速、可用于现场定量检测等优点。此外,本方法制备的免疫磁珠可保存半年以上,具有开发成商品化试剂盒的潜在价值和良好的应用前景。
