细菌富硒代谢及生物活性的研究进展
2020-11-09刘昊张宇靖李婧祎拓晓宏
刘昊 张宇靖 李婧祎 拓晓宏
[摘 要] 硒是人和动物代谢所必需的微量元素,具有抑癌抗癌、抗自由基、解除重金属中毒、提高机体免疫力、延缓衰老、维持正常细胞功能等作用。富硒微生物能通过生物转化将无机硒转变为纳米硒,这种纳米硒生产过程具有成本较低、硒浓度高、生物利用率高、环境污染小等优势。细菌硒纳米颗粒具有独特的硒原子排列,不同于化学合成纳米硒的结构、理化和光电特性,已经在新一代光电、生物化学传感器上进行了开发利用;同时纳米硒颗粒作为药物载体和富硒菌及纳米硒颗粒具有的抗菌、抗氧化、抗金属毒性、抗肿瘤和调节免疫作用的生物活性受到广泛的关注。
[关键词] 富硒菌;富硒代谢途径;纳米硒;生物活性
[中图分类号] O 613.52 [文献标志码] A [文章编号] 1005-0310(2020)04-0071-08
Abstract: Selenium (Se),an essential trace element across the tree of life, plays a significant role in the metabolism of human and animal life. Selenium is known to be capable of a range of functions, including anti-cancer, anti-free radical, improving immunity, anti-aging, relieving heavy metal poisoning, maintaining normal cell function and so on. Selenium-enriched microorganisms convert inorganic selenium into SeNp through biotransformation with the advantages of lower cost, higher bioavailability, higher selenium content, and less environmental pollution. The selenium nanoparticles synthesized by selenium-rich bacteria have complex and unique selenium atom arrangement, which gives it unique structural, physical, chemical and photoelectric properties different from chemical synthesis, and have been developed and utilized in a new generation of photoelectric and biochemical sensors. Selenium nanoparticles have been increasingly attracting the attention of researchers over the recent years, one of the reasons is Selenium nanoparticles as a drug carrier and meanwhile selenium-enriched bacteria and Selenium nanoparticles have been widely concerned with the biological activities of antibacterial, anti-oxidation, anti-metal toxicity, anti-tumor and immune regulation.
Keywords: Selenium-enriched bacteria; Selenium-enriched metabolism; Nano-selenium particles; Bioactivity
0 引言
富硒微生物通过生物转化把无机硒转变成纳米硒,具有成本较低、生物利用率较高、硒含量较高、对环境污染小等优势,富硒菌生物转化得到的纳米硒相比于无机硒的毒性更小,安全性更高,也易被机体吸收,同时纳米硒颗粒作为药物载体和富硒菌及纳米硒颗粒具有的抗菌、抗氧化、抗金属毒性、抗肿瘤和调节免疫作用的生物活性受到广泛的关注。然而细菌富硒转化率受许多因素影响,本文主要介绍影响细菌合成纳米硒粒子的代谢途径、影响细菌富硒代谢的主要因素,进一步了解细菌的富硒代谢机制,进而提高细菌富硒的硒转化率,并为生物纳米硒的开发应用提供研究基础。
1 细菌合成生物纳米硒粒子的代谢途径
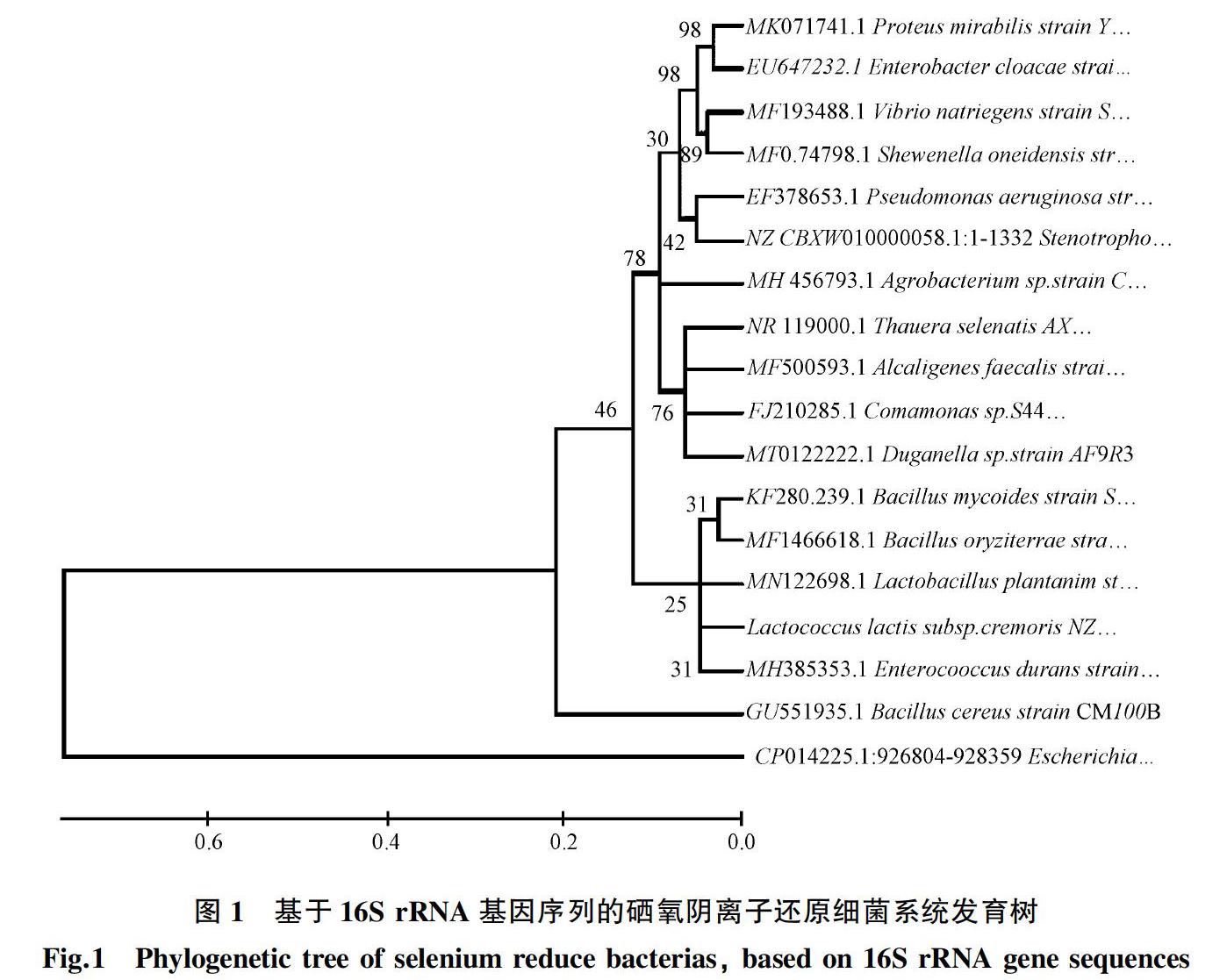
自然界中存在的耐硒菌能将有高度可溶性的SeO32-、SeO42-还原为高度不溶性的低毒Se0,一般还原的终产物为不同结构形式的纳米硒粒子。多种细菌和古菌都具有还原SeO32-和SeO42-的性质,图1展示了pubmed数据库中近10年报道的主要硒氧阴离子还原细菌的系统发育树(基于16S rRNA基因序列)[1-5],使用MEGA6软件通过邻接法构建树,在节点处,引导值以百分比的形式给出。细菌的纳米硒颗粒合成过程可分为4个阶段[6]:① 硒氧阴离子向胞内的运输;② 胞内的还原反应;③ 硒单质向胞外的运输;④ 硒单质组装为纳米硒颗粒。该过程中,②和④的合成过程是必然发生的,①和③的发生与否取决于②和④在胞内发生的位置,只有SeO32-、SeO42-在细菌胞内还原为Se0且Se0在胞外組装时,③才会发生。
1.1 硒氧阴离子向胞内的运输
耐硒菌中目前暂未发现专门的硒酸盐转运系统,细菌对硒酸盐的吸收转运可通过在结构上与其相似的氧阴离子(如硫酸盐或钼酸盐)吸收系统来实现。研究发现在大肠杆菌中,硒酸盐和亚硒酸盐通过硫酸盐 ABC转运通透酶系统(CysAWTP)进入细胞[7];但抑制硫酸盐通透酶的表达并不会完全抑制大肠杆菌对亚硒酸盐吸收,因此硫酸盐通透酶不是亚硒酸盐进入大肠杆菌的唯一通道。在Ralstonia metallidurans富硒过程中,亚硒酸盐经历开始的缓慢吸收后会出现一个快速吸收过程,这可能与细胞中亚硒酸盐吸收系统的缓慢激活有关。光合细菌Rhodobacter sphaeroides中存在一个多羟基化合物转运系统介导的亚硒酸盐进入胞内,酵母细胞中也发现与亚硒酸盐转运有关的一种质子偶联的单羧酸盐转运体Jen1p;除此之外,光合细菌中还存在一种机制尚未明确的低效率阴离子转运体,其在高钼酸盐浓度下被证明可以转运硒酸盐和亚硒酸盐[8]。还有大肠杆菌中的GutS、Rhodobacter sphaeroides中的SmoK 和 Ralstonia metallidurans中的DedA等蛋白也参与亚硒酸盐的转运[9-10]。
1.2 硒氧阴离子的还原
硒氧阴离子到单质硒的还原过程分为两个阶段,首先是硒酸盐转化为亚硒酸盐,然后是亚硒酸盐还原为单质硒。
目前,约有16种细菌能够通过硒氧阴离子的异化还原而厌氧生长,厌氧菌通过厌氧呼吸还原硒酸盐得到红色的纳米硒颗粒,这种单质硒Se0具有均匀的单斜晶体结构[8]。通过硒化氢(H2Se)化学氧化形成的非晶态Se0以及亚硒酸盐和抗坏血酸化学还原形成的黑色玻璃状Se0的光谱特性与微生物合成Se0纳米球有很大差异。微生物合成Se0纳米球具有独特的、复杂的、紧凑的硒原子结构排列。这可能与异化还原中参与反应的多种酶有关,而在不同的细菌中参与异化还原的酶各不相同[11],因而不同富硒菌得到的纳米硒在光学性质(紫外-可见吸收和拉曼光谱)上表现出很大差异,如巴氏链霉菌(Sulfurospirillum barnesii)、硒化芽孢杆菌(Bacillus selenitireducens)和亚硒酸杆菌(Selenihalanaerobacter shriftii)[1]。亞硒酸盐的还原并不总是作为细菌呼吸链上的电子受体,Thauera selenati可以利用硒酸盐作为厌氧呼吸的电子受体,该菌对亚硒酸盐的还原伴随着O2的释放,并产生氧化应激,这可能是亚硒酸盐的细胞毒性机理之一[7, 9]。
同时,细菌通过还原反应对胞内金属硒盐进行解毒,耐受硒盐的Ralstonia metallidurans CH34在亚硒酸盐存在下过表达超氧化物歧化酶,表明其胞内硫醇可能参与对可溶的亚硒酸盐的解毒过程。Thauera selenati中存在一种位于细胞周质空间的硝酸还原酶,能将SeO32- 还原为Se0,而周质缺乏硝酸还原酶的突变株则不能还原SeO32-,表明硝酸还原酶是Thauera selenati还原SeO32- 的必要酶[6, 8]。细菌还原亚硒酸盐的主要酶系统:硝酸盐和亚硝酸盐周质还原酶、硫化物介导的亚硒酸盐还原以及胞内硫醇参与的还原系统。细菌还原硒氧阴离子的基本反应式:
Se(VI)O42-+2e-+2H+Se(IV)O32-+H2O,
Se(IV)O32-+4e-+6H+Se0+3H2O。
除了上述两种还原途径外,细菌还可以通过硫酸盐还原途径还原,细菌首先将硫酸盐还原为硫化物(S2-),并释放到胞外,当环境中存在SeO2-时,S2-便与SeO2-反应,生成硒-硫颗粒黏附于细胞表面[12],近年来Li等又发现Shewanella oneidensis R-1周质中的富马酸酯还原酶介导还原亚硒酸盐[13]。Eswayah等发现荚膜甲基球菌(Methylococcus)和三甲基甲烷菌(Methylosinus trichosporium)厌氧呼吸系统的硝酸还原酶途径参与亚硒酸盐还原[14],然而,已知的还原亚硒酸盐的微生物数量远高于还原硒酸盐的微生物[7],这提示细菌中对硒氧阴离子的还原可能存在协同作用。
1.3 硒的甲基化
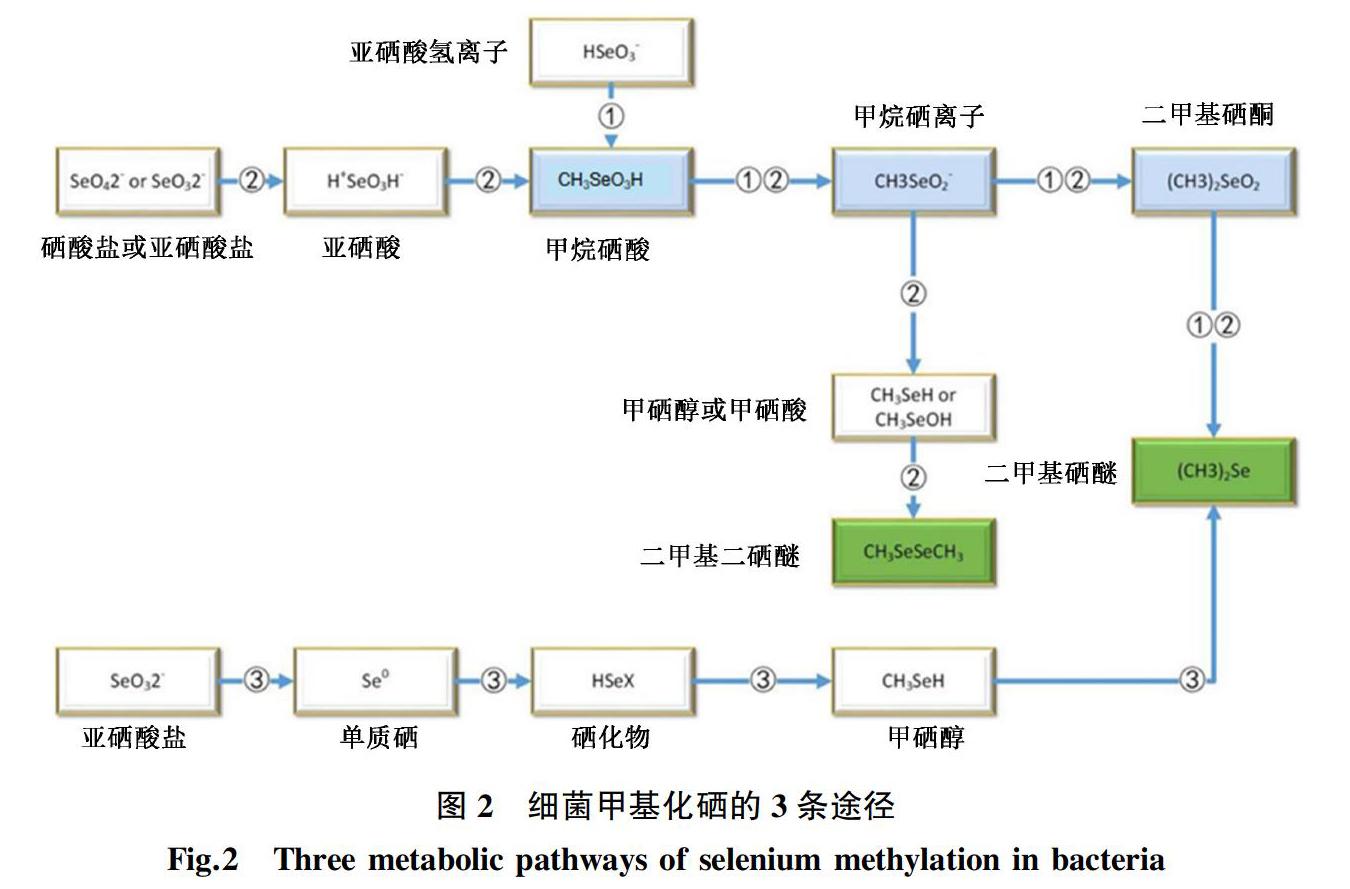
许多环境中的微生物可将硒(包括SeO42-,硒半胱氨酸和硒蛋氨酸)甲基化为挥发性化合物硒化二硒化物(DMSe,二甲基硒)和二甲基异戊烯(DMDSe,二甲基二硒)。因为产物具有挥发性,因而硒的甲基化在硒向大气的自然循环中很重要,可利用微生物合成挥发性硒化合物法从含硒水中回收硒,也可作为一种重金属的解毒机制[15]。在原核生物中,硒的甲基化需要甲基转移酶的参与。Rehan等发现了3种不同的甲基转移酶:巯基嘌呤甲基转移酶(bTPMT)、烯二炔类抗生素(卡奇霉素)甲基转移酶的同源物和甲基转移酶家族MmtA[7]。
目前发现微生物主要有3条途径来进行硒的甲基化(图2)。途径①是真菌硒甲基化的原始途径,该途径涉及硒原子的甲基化和还原,通过4个步骤形成DMSe作为最终产物。途径②中微生物在低质量浓度的SeO32-(1~10 mg/L)下主要产生DMSe,而在高质量浓度的SeO32-(10~1 000 mg/L)下主要产生DMDSe;当Se0为唯一硒来源时,DMSe是唯一产物[16]。 在棒状杆菌中发现了途径③的硒甲基化过程,该过程需要先将SeO32-还原为Se0,然后再还原为硒化物,硒化物最终被甲基化生成DMSe。但是棒状杆菌中SeO32-还原为Se0后是通过什么样的机制来决定Se是被组装为纳米硒颗粒还是被甲基化,目前还不清楚。
1.4 纳米硒颗粒的组装和分泌
硒纳米颗粒含有与其相关的微生物蛋白,它们在纳米硒粒子的形成、生长及控制颗粒大小方面起着重要作用。纳米球在有氧和厌氧条件下均可产生,Thauera selenatis 在细胞周质空间对亚硒酸盐进行还原,一旦亚硒酸盐被还原为Se0,一种约95 kDa的硒蛋白SeFA会结合到Se0上形成硒纳米球,然后被分泌到胞外,但是SeFA-Se0被运出胞外的过程尚不清楚[17]。同样纳米硒是如何被组装的也不清楚。对于纳米硒颗粒向胞外的运输,除了与SeFA结合后被分泌到胞外,在嗜麦芽窄食单胞菌中,Eleonaro等提出一种可能机制,即还原得到的胞内纳米硒颗粒通过有效的SeNp分泌系统,或者细胞破裂后运出胞外[18]。
纳米硒颗粒的表征发现不同细菌合成的纳米硒颗粒具有不同的直径,直径较大的纳米硒颗粒是由小直径的颗粒聚合而成。纳米硒粒子的生物学特性取决于颗粒大小,一般认为较小的粒子具有较高的生物活性。颗粒的大小影响它们被细胞的摄取,在体外细胞摄取纳米硒颗粒的研究中发现,细胞摄取0.1 μm颗粒的量,分别是1 μm、10 μm颗粒的2.5倍、6倍[19]。所以颗粒直径<100 nm的纳米硒颗粒作为药物靶向治疗载体或膳食硒有明显优势,因而弄清纳米硒颗粒组装的机制对微生物生产纳米硒颗粒具有重要意义。
2 细菌富硒代谢的主要影响因素
尽管富硒菌能够将无机硒转化为有机硒,但菌种的类别以及具体的富硒条件对富硒效率有着较大的影响。一般来讲无机硒质量浓度、细菌生物量、加硒时间、培养基pH、碳源、氮源和无机盐离子对硒的生物转化率都有影响。
细菌富硒的硒源常选择硒酸盐和亚硒酸盐,不同的硒源对细菌的生长有不同的作用[7]。细菌富硒中一般选可溶亚硒酸盐为硒源,一定范围内提高培养基中亚硒酸钠质量浓度,有利于增加干菌体中硒含量,但随着硒质量浓度增大到一定值后,硒转化量逐渐减少[20]。这可能是因为在低质量浓度下, Se 主要用于维持细胞的完整性,作用于微生物体内的必需酶,如在某些梭菌中的烟酸脱氢酶和黄嘌呤脱氢酶,硒是这些酶的含钼辅助因子活性位点的一部分,并促进辅酶 Q 及细胞的 DNA和RNA的生物合成,一定的硒质量浓度对于细胞的正常生长及其生物活性至关重要。当硒质量浓度大于10 mg/L时,则主要表现为毒性作用,可能是因为硒与生物大分子的巯基作用,使巯基过氧化形成S-Se-S键,致使蛋白质破坏而失去活性,从而抑制了细胞的正常分裂和增殖[21]。
在细菌生长过程中,加入无机硒的时间和接种菌的生物量对细菌富硒也有显著影响。王劲松等研究无机硒的加入时间对类球红细菌体生长和转硒效率的影响,结果显示细菌对于亚硒酸钠的生物转化具有时间峰值,在12 h后达到转化峰值43.1%,随着生长时间的延长,其转化率迅速下降,至42 h时达1.2%。在延滞期之后对数生长期之前,即接种后12 h左右加入无机硒是最好的选择;过早加入会使低浓度的菌体受到较高浓度的亚硒酸钠胁迫而生长受到抑制,从而影响转化硒效率[22]。相比最佳的亚硒酸盐质量浓度、加硒时间以及初始的接种量,确定在一定生长阶段的细菌群体最佳的亚硒酸盐浓度更有意义。当确定了某特定细菌相应生长阶段的最佳亚硒酸盐浓度,理论上可使硒的生物转化率达到最大。江曙等研究初始接种量对红栓菌多糖无机硒生物转化的影响,结果显示,随着初始接种量的增加,硒转化率先升高后降低。不同的初始细菌接种量影响红栓菌所受的亚硒酸盐胁迫,这和硒加入时间影响硒转化率的本质是一致的。此外,红栓菌在接种量过大时会导致菌丝体繁殖过快,营养物质消耗过快,溶解氧不足,最终也会导致菌体的生长和多糖的合成受到抑制,影响多糖对硒的结合。因此在进行微生物富硒的研究时,不仅要考虑细菌合成富硒代谢产物的能力,还要考察细菌次生代谢产物对硒的生物结合能力[23]。在细菌的工业连续发酵时,随着菌体浓度的增加,硒的生物轉入率都有较大的提高,故工业上通过分批补料来提高菌体培养浓度的同时,也提高了菌体内有机硒的绝对量[22]。
培养基的pH、添加的无机盐离子和金属离子、培养基氮源和碳源也会影响细菌对硒的转化。在酵母细胞中,硒酸盐或亚硒酸盐的转运受温度、pH、碳源种类的影响,而且与磷、 硫两种元素有关[23]。乳酸菌 Dfa-301-30 利用葡萄糖进行富硒代谢的能力要高于其他碳源,但当葡萄糖含量达到一定值时,增加葡萄糖含量,菌体的富硒含量基本保持不变,而该菌对无机氮源的利用率低于有机氮源,牛肉粉中含有丰富的营养成分及植物乳杆菌生长所需的生长因子,从而促进菌体的富硒生长代谢[24]。
3 富硒菌及其纳米硒颗粒的生物活性 3.1 抗病毒和抑菌作用
SeNPs具有诸如毒性低、活性优、可改善体内免疫反应等特点,其抗病毒能力也在临床应用中得以彰显。例如硒缺乏小鼠感染H1N1型流感病毒的死亡率比接受一定剂量Na2SeO 3的小鼠感染病毒的死亡率高3倍;血清硒浓度低的小鼠体内TNF-α和IFN-γ的水平较低,同时伴有体重明显减少。被奥司他韦(OTV)表面修饰的SeNPs具有预防H1N1型病毒对某些动物细胞的感染、抑制流感病毒糖蛋白-血凝素和神经氨酸酶的活性来干扰H1N1进入宿主细胞、阻止Madin-Darby犬肾细胞感染后的染色质浓缩和DNA片段化、抑制细胞肿瘤抗原p53和Akt磷酸化的激活、显著降低因H1N1进入宿主细胞产生的高水平活性氧ROS含量等多种抗病毒功效,可以对传染性呼吸道疾病进行预防[11]。
富硒菌种类广泛,其中富硒乳酸菌具有抑制致病性鼠伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌和单核细胞增生李斯特菌等的作用[19],通过酵母细胞内生物合成并提取出的SeNPs具有抗念珠菌活性[25]。一定浓度的SeNPs对铜绿假单胞菌、金黄色葡萄球菌、大肠杆菌和化脓性链球菌的生长抑制率可高达99%。除此之外,富硒益生菌具备益生菌和有机硒的双重功能且可发挥大于二者的功效,通过营养竞争、产生有机酸及细菌素有利地抑制机体内致病性大肠杆菌的感染、促进肠道优势菌群数量,具有改善小鼠肠道内菌群结构的作用[26-27]。
3.2 抗氧化作用
谷胱甘肽过氧化物酶 (GSH-Px) 作为一种重要的过氧化物分解酶在机体内广泛存在,而硒是其组成物质和酶活性的重要组分。有机硒可显著提高血液中的GSH-Px活力、SOD活性和丙二醛的含量,从而有效提高机体的总抗氧化能力,且其对机体抗氧化能力的改善效果比无机硒的效果要好[27-28]。富硒酵母的抗氧化能力强于抗坏血酸,并且富硒酵母的自由基清除率与其浓度呈现线性关系,具有实用价值[25]。此外,酵母硒可抑制雄性SD高脂血症大鼠体内脂质过氧化,并使SOD、谷胱甘肽还原酶的活性升高,谷胱甘肽的含量增加,血脂水平得到降低,从而体现其抗氧化能力。SeNPs能对于铅给动物实质性器官、肌肉、外周血淋巴细胞以及卵巢和睾丸等组织的总抗氧化能力(T-AOC)、SOD、GST、GSH-Px、GSH和CAT等活性带来的抑制作用起到拮抗效果,提高机体酶抗氧化系统的耐受力,起到抗氧化的作用[29]。Atteia等发现硒纳米颗粒可通过调节硒酶和抑制miR-224防止乙酸铅诱导的甲状腺功能减退症和雄性大鼠甲状腺组织的氧化损伤[30]。
Shakibaie等在里海发现生产SeNPs的芽孢杆菌。将其全细胞裂解物中的硒纳米颗粒进行纯化,并用DPPH法测定抗氧化活性,将SeNPs和SeO2溶液的抗氧化结果进行对比。结果显示在200 μg/mL 的相同质量浓度下,相比SeO2溶液13.2±3.1%的清除效果,SeNPs的清除效果为23.1±3.4%,显示出生物合成的硒纳米颗粒具有更强的抗氧化活性[31]。
3.3 抗金屬毒性作用
大量研究报道了硒在动物和细胞水平上对金属毒性的保护作用,并解释了许多相关的机制。金属汞能结合GSH-Px中的巯基形成稳定的硫醇盐而使GSH-Px失活。而硒是谷胱甘肽过氧化物酶的活性中心,硒酵母可提高GSH-Px的活性,对汞中毒引起的GSH-Px活性下降具有明显的拮抗效应,硒对镉毒性具有细胞保护的作用,其机制包括降低脂质过氧化、保护线粒体损伤、调节细胞凋亡信号转导通路等。硒(硒代蛋氨酸)对神经细胞SH-SY5Y和PC12以及体内重金属铅的神经毒性具有拮抗作用[27,32]。此外,补充一定量的富硒酵母可以通过减轻铜离子介导的脂质过氧化等可能的机制来降低由铜负荷而引起的肝功能损伤[33]。
3.4 抗肿瘤作用
人体一般很难直接吸收利用无机硒,但可通过肠壁的主动运输而吸收有机硒。硒在微生物发酵的过程中从无机形态转化为有机形态,具有生物利用度高、食用安全、毒性低等优点。它可以辅助肝癌、肠癌、 胃癌、肺癌、恶性淋巴瘤、乳腺癌、生殖细胞瘤等疾病的治疗,且有一定的预防作用。李保珍[34]用沼泽红假单胞菌菌株还原亚硒酸盐得到了高纯度的生物源纳米硒,并且证明了SeNPs可以诱导肝癌HepG2细胞凋亡,抑制肝癌细胞的生长,具有浓度效应关系。富硒酵母还发现通过降低ACF的数量和大小,改变P53、BCL2、CD31等蛋白的功能等多种机制来降低结直肠癌的进展[35]。
纳米硒比其他硒化合物具有更高的抗癌功效,通过流式细胞仪监测SeNPs对Hela细胞周期阻滞的影响,可见G1期细胞百分比下降而S期细胞百分比上升,SeNPs在S期破坏细胞DNA合成并使G2期检查点失活,从而阻断细胞周期。同时,纳米硒可通过破坏HeLa细胞中线粒体膜电位、引起细胞空泡化等作用诱导细胞凋亡;形成的空泡可能是细胞在活性内吞作用过程中形成的囊泡膜融合,进一步揭示了Hela细胞在纳米硒诱导下凋亡的潜在机制,也为富硒细菌生成的纳米硒作为抗癌剂提供了理论基础。SeNPs治疗改变了肿瘤细胞的生物力学特性,特别是显著降低了粘附力和杨氏弹性模量。SeNPs还可通过介导真核细胞起始因子3(eIF3)蛋白复合物的失调使细胞周期停滞在S期、触发细胞凋亡信号转导诱导细胞凋亡等途径抑制其生长能力。除了直接抗癌作用外,SeNPs还作为潜在的抗癌药物递送载体间接发挥抗癌作用。通过偶联叶酸、螺旋藻多糖(SPS)等作为癌症靶向剂,功能化的SeNPs还可用作125I辐射增敏剂促进抗癌进程[11,36]。
4 结束语
利用微生物合成的生物源性纳米硒颗粒在医学领域具有广泛的应用前景,但纳米硒颗粒的生物活性取决于其颗粒大小,微生物最终分泌的纳米硒颗粒是由较小粒径的纳米硒颗粒聚合成的,研究纳米硒颗粒聚合的过程及机制,研究硒盐的浓度、无机硒加入的时间以及富硒培养基的氮源、碳源、pH、加入的离子等对合成粒径小于100 nm的SeNPs的影响,能够更好发挥纳米硒在医学应用上的优势。而多金属纳米粒子比单个金属纳米粒子具有更好的性能,因而要开发生产双相纳米粒子的新方法。此外,还需要研究SeNPs表面功能,将SeNPs与药物结合,特别是探索生物源性纳米硒颗粒作为抗结核和抗病毒药物、催化剂和靶向药物的潜力,为生物医学开辟新的途径。弄清微生物对全球硒的分布和硒在环境中迁移的影响,从而找到一种切实可行的方法,利用微生物消除硒污染环境中的硒。对于微生物最佳富硒条件的探索,是否更应该确定在一定生长阶段的细菌群体最佳的亚硒酸盐胁迫浓度,从而使某特定细菌相应生长阶段总是有最佳亚硒酸盐胁迫浓度,理论上使其硒的生物转化率达到最大。微生物合成纳米硒颗粒的途径和硒甲基化的途径在前半部分是共同的,但还原得到单质硒后既可以通过纳米硒颗粒组装途径合成分泌纳米硒颗粒,也可以通过甲基化途径甲基化硒,因此是否可以抑制这类微生物甲基化硒而明显加强纳米硒颗粒的合成和分泌,或抑制纳米硒颗粒的合成分泌从而增强硒的甲基化,或将成为微生物富硒代谢开发的研究方向。
[参考文献]
[1] WANG Y T, SHU X, HOU J Y, et al. Selenium nanoparticle synthesized by proteus mirabilis yc801: an efficacious pathway for selenite biotransformation and detoxification[J]. Int J Mol Sci, 2018, 19(12): 3809.
[2] SONG D G, LI X X, CHENG Y Z, et al. Aerobic biogenesis of selenium nanoparticles by Enterobacter cloacae Z0206 as a consequence of fumarate reductase mediated selenite reduction[J]. Sci Rep-UK, 2017, 7(1): 3239.
[3] XU C L, QIAO L, MA L, et al. Biosynthesis of polysaccharides-capped selenium nanoparticles using lactococcus lactis nz9000 and their antioxidant and anti-inflammatory activities[J]. Front Microbiol, 2019(10): 1632.
[4] WANGY T, SHU X, ZHOU Q, et al. Selenite reduction and the biogenesis of selenium nanoparticles by alcaligenesfaecalis se03 isolated from the gut of monochamus alternatus (coleoptera: cerambycidae)[J]. Int J Mol Sci, 2018, 19(9): 2799.
[5] ZHENG S X, SU J, WANG L, et al. Selenite reduction by the obligate aerobic bacterium Comamonas testosteroni S44 isolated from a metal-contaminated soil[J]. BMC Microbiol, 2014, 14(1): 204.
[6] ESWAYAH A S, SMITH T J, GARDINER P H. Microbial transformations of selenium species of relevance to bioremediation [J]. Appl Environ Microbiol, 2016, 82(16): 4848-4859.
[7] REHAN M, ALSOHIM A S, EI-ADLY G, et al. Detoxification and reduction of selenite to elemental red selenium by Frankia[J]. Antonie Van Leeuwenhoek, 2019, 112(1): 127-139.
[8] TUGAROVA A V, KAMNEV A A. Proteins in microbial synthesis of selenium nanoparticles [J]. Talanta, 2017(174): 539-547.
[9] MCDERMOTT J R, ROSEN B P, LIU Z J. Jen1p: a high affinity selenite transporter in yeast [J]. Mol Biol Cell, 2010, 21(22): 3934-3941.
[10] 徐巧林, 吴文良, 赵桂慎,等. 微生物硒代谢机制研究进展[J]. 微生物学通报, 2017, 44(1): 207-216.
[11] HOSNEDLOVA B, KEPINSKA M, SKALICKOVA S, et al. Nano-selenium and its nanomedicine applications: a critical review [J]. Int J Nanomed, 2018(13): 2107-2128.
[12] NELSON D C, CASEY W H, SISON J D, et al. Selenium uptake by sulfur-accumulating bacteria[J]. Geochim Cosmochim Ac, 1996(60): 3531-3539.
[13] LI D B, CHENG Y Y, WU C, et al. Selenite reduction by Shewanella oneidensis MR-1 is mediated by fumarate reductase in periplasm[J]. Sci Rep-UK, 2014(4): 3735.
[14] ESWAYAH A S, SMITH T J, SCHEINOST A C, et al. Microbial transformations of selenite by methane-oxidizing bacteria [J]. Appl Environ Microbiol, 2017, 101(17): 6713-6724.
[15] ULLAH H, LIU G, YOUSAF B, et al. A comprehensive review on environmental transformation of selenium: recent advances and research perspectives [J]. Environ Geochem Hlth, 2019, 41(2): 1003-1035.
[16] 黃文峰, 杨惠超. 硒对重金属毒性的颉颃作用[J]. 畜牧与饲料科学, 2011, 32(12): 56-57.
[17] WADHWANI S A, UTKARSHA U S, RICHA S, et al. Biogenic selenium nanoparticles: current status and future prospects [J]. Appl Microiol Biot, 2016, 100(6): 2555-2566.
[18] ELEONARO C, MARZIA B, ILSE V, et al. Biogenic selenium nanoparticles synthesized by Stenotrophomonas maltophilia SeITE02 loose antibacterial and antibiofilm efficacy as a result of the progressive alteration of their organic coating layer[J]. Microb Biotechnol, 2018 11(6):1037-1047.
[19] YANG J P, WANG J, YANG K, et al. Antibacterial activity of selenium-enriched lactic acid bacteria against common food-borne pathogens in vitro [J]. J Dairy Sci, 2018, 101(3): 1930-1942.
