白酒基酒中酮类物质的近红外光谱检测方法
2020-11-09董新罗刘建学韩四海谢安国李佩艳徐宝成罗登林
董新罗,刘建学,2*,韩四海,2,谢安国,2,李 璇,2,李佩艳,2,徐宝成,2,罗登林,2
(1.河南科技大学 食品与生物工程学院,河南 洛阳 471023;2.河南省食品原料工程技术研究中心,河南 洛阳 471023)
中国白酒作为世界六大蒸馏酒之一,历史悠久,源远流长。白酒以粮谷为主要原料,以酒曲为发酵剂,经蒸煮、糖化、发酵、蒸馏制成。其气味浓郁纯正,入口绵甜爽净,深受人们喜爱[1-2]。在白酒的组成中,乙醇和水为主要成分,而微量成分(约占1%~2%)是白酒的呈香物质,决定了不同白酒的独特品质[3]。随着分析化学的发展以及色谱、质谱等技术在白酒微量成分检测中的应用,已确定白酒的微量呈香物质主要由有机酸、酯类、高级醇、醛酮类及其他芳香族化合物等组成[4-5]。在白酒酿造过程中会产生一定量酮类物质,主要有2,3-丁二酮、3-羟基-2-丁酮等。其在白酒中起着缓冲、平衡香气的作用,可使酒产生纯正的香气和绵甜的口感。在一定范围内,2种酮类物质在白酒中的含量越高,白酒的品质越好[6-7]。因此,白酒中酮类物质的快速检测对于白酒质量控制具有重要意义。
目前对白酒中微量呈香物质的检测分析主要参照GB/T 10345—2007《白酒分析方法》,采用气相色谱法测定[8]。但气相色谱法步骤较为繁琐耗时,不满足实际生产中简单快速的在线分析技术需要。近红外光谱(NIR)是一种快速方便、无损、无污染以及多组分同时检测的分析技术,已在食品工业领域得到了广泛应用[9-13]。近年来,近红外光谱在白酒行业中也取得了很大的发展。在酿酒原料方面,杨泉女等[14]利用近红外光谱技术分别建立了104份甜玉米种子中总多糖和淀粉的近红外光谱定标模型;韦紫玉等[15]用近红外漫反射光谱分析技术对73份小麦样品的蛋白质含量进行测定,模型效果良好,可用于小麦无损检测。在白酒发酵过程方面,熊雅婷等[16]利用近红外光谱法结合偏最小二乘回归法建立了酒醅中水分、淀粉、酒精度、酸度的定量分析模型。在白酒质量检测方面,陈妍等[17]应用近红外光谱法测定白酒样品中乙醇、总酸、总酯和己酸乙酯等关键指标的含量,模型效果良好;张卫卫等[18]建立了白酒基酒中乙醛、乙缩醛的近红外快速检测方法。然而,针对白酒中酮类物质的快速检测尚未见报道。
本文选取杜康基酒作为研究对象,经扫描得到182个样品的近红外光谱图并分析,选取特征谱区及最佳预处理方法,建立了白酒基酒中2,3-丁二酮、3-羟基-2-丁酮的近红外检测模型,可为白酒中酮类物质的近红外光谱快速检测提供依据。
1 实验部分
1.1 试剂与仪器
白酒基酒样品182个(洛阳杜康控股有限公司);标准品:2,3-丁二酮和3-羟基-2-丁酮(色谱纯,上海阿拉丁生化科技股份有限公司);无水乙醇(色谱纯,天津市科密欧化学试剂有限公司)。
VEVTOR33型傅里叶变换近红外光谱仪(德国Bruker公司);7890A气相色谱仪,配氢火焰离子化检测器(美国Agilent公司)。
1.2 实验方法
1.2.1 化学值测定气相色谱条件:色谱柱:LZP-930白酒分析专用柱(25 m×0.53 mm×1 μm);进样口温度:220 ℃;检测器温度:250 ℃;柱流速:2.0 mL/min;载气:氮气(纯度99.999%),流速30 mL/min;H2流速:30 mL/min;空气流速:300 mL/min;尾吹气流速:25 mL/min;采用分流进样方式,分流比为10∶1;进样量:1 μL;程序升温条件:初始温度75 ℃,保持3 min,以10 ℃/min升至210 ℃。
根据样品组分含量配制不同质量浓度的2,3-丁二酮和3-羟基-2-丁酮混合标准溶液,注入气相色谱仪测得峰面积,以质量浓度对峰面积作标准工作曲线,外标法定量。每个样品测定2次,取平均值(两次测定结果的绝对差值不应超过平均值的5%)。
1.2.2 近红外光谱采集利用VEVTOR33傅里叶变换近红外光谱仪采集光谱。测量前,将仪器预热30 min。以空气作参比,选用光程为1 mm的石英比色皿,采集光谱时环境温度保持在(25±2) ℃范围内,光谱扫描范围为12 000~4 000 cm-1,仪器分辨率为8 cm-1,每个样品扫描32次,做3个平行样的光谱采集并计算平均值。对样品光谱的分析使用OPUS 8.1软件。
1.2.3 光谱数据预处理及模型建立在对样品进行近红外检测的过程中,可能存在与待测样品无关因素(样品的状态、光的散射以及仪器响应等)的干扰,从而导致近红外光谱的基线漂移和光谱的不重复,因此需对原始光谱进行预处理[19]。常用的预处理方法有:平滑主要包括卷积平滑处理(Savitzky-Golay filter,S-G)和导数滤波(Norris derivative filter,N-D),可提高信号的信噪比;导数处理包括一阶导数(First derivative,D1)和二阶导数(Second derivative,D2),可以放大信号优势,强化谱带特征,但同时也会放大光谱噪音;还有标准正态变量变换(Standard normal variate,SNV)、多元散射校正(Multiplicative signal correction,MSC)等,用来滤除各种因素产生的高频噪声及基线漂移。通常选取一种预处理方法或多种不同预处理方法的组合,以建立最佳的近红外光谱定量模型。
将气相色谱法测定的白酒基酒中2,3-丁二酮和3-羟基-2-丁酮结果按其含量排序后,按照选3留1的原则分成校正集和验证集,校正集和验证集的个数分别为137个和45个。使用校正集样品结合偏最小二乘法(PLS)建立定量校正模型,再做交叉验证。交叉验证方法选用留一法(Leave-one-out):每次留下1个样本,用其它样本建立模型,然后用留下的样本检验所建模型,重复上述过程,直至所有样本均被检验。最后用独立的验证集样品对定量校正模型进行外部验证。采用校正集样品决定系数(R2)和交叉验证均方根误差(RMSECV)评价所建立定量校正模型的优劣,验证集样品的R2和预测均方根误差(RMSEP)以及模型精密度结果评价其预测能力。一个优良的模型应具有较高的R2,较低的RMSECV、RMSEP,并且RMSECV和RMSEP较为接近。
2 结果与讨论
2.1 化学值测定结果分析
采用气相色谱法测定白酒基酒样品中2,3-丁二酮和3-羟基-2-丁酮的含量,其结果如表1所示。由于样品来自不同的白酒生产车间和发酵池,可以看出所选样品均具有较为广泛的含量分布范围和较高的标准偏差,具有代表性,且验证集含量范围均在校正集含量范围内,符合建模标准。
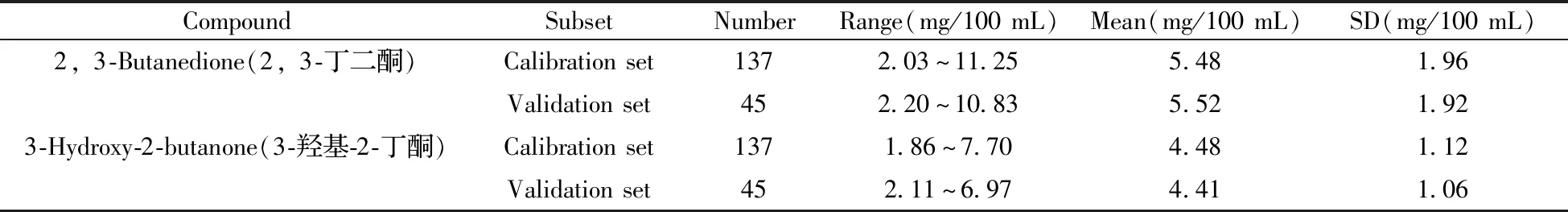
表1 2,3-丁二酮和3-羟基-2-丁酮的化学值分析Table 1 Chemically measured values of 2,3-butanedione and 3-hydroxy-2-butanone
2.2 近红外光谱图分析
白酒基酒样品的近红外光谱如图1所示。其中图1A为未经处理的原始近红外光谱,其光谱沿着纵坐标轴有明显的基线漂移现象。光谱在6 896 cm-1和5 128 cm-1处有2个吸收峰,分别与水分子中O—H键的一级倍频和组合频有关,选择建模谱区时应避开这些区域以消除强吸收的干扰。5 875 cm-1的吸收峰与甲基C—H键的一级倍频有关,5 745 cm-1和5 645 cm-1处的吸收峰与亚甲基C—H键的一级倍频有关[20]。图1B为对2,3-丁二酮使用一阶导数和多元散射校正(D1+MSC)预处理后的光谱,选择的光谱间隔为9 403.2~7 497.9 cm-1。图1C为对3-羟基-2-丁酮使用二阶导数(D2)预处理后的光谱,选择的光谱间隔为9 403.2~7 497.9 cm-1和6 101.7~5 449.8 cm-1。由图可知,预处理后的光谱基本消除了基带漂移现象,特征谱带得到强化,其谱带差异更加明显,从而达到更好的建模效果。
2.3 校正模型的建立



图1 白酒基酒样品的近红外光谱Fig.1 Near infrared spectra of base liquor samplesA:raw spectra;B:preprocessed with D1+MSC for 2,3-butanedione;C:preprocessed with D2 for 3-hydroxy-2-butanone

表2 2,3-丁二酮和3-羟基-2-丁酮的最佳预处理方法及其模型参数Table 2 The model parameters of 2,3-butanedione and 3-hydroxy-2-butanone with optimized preprocessing methods
根据表2建模条件结合内部交叉验证法建立2,3-丁二酮和3-羟基-2-丁酮的校正模型,选用的建模样品有137个,通过计算光谱的马氏距离分别排除了4个和5个异常样品,最终实际参与建模的样品分别为133个和132个,得到2,3-丁二酮和3-羟基-2-丁酮校正模型的预测值和真实值之间的相关性如图2所示。由图2可知,白酒基酒中2,3-丁二酮和3-羟基-2-丁酮的定量模型校正集样品均匀分布在回归线两侧,说明这两种酮类物质采用气相色谱法测得的化学参考值与其近红外模型预测值存在明显的相关性。近红外模型校正集的R2分别为0.960 2和0.963 2,RMSECV分别为0.39、0.22 mg/100 mL。由此可以看出,所建模型的决定系数较高,RMSECV较小,效果良好。
2.4 模型验证
建立的校正模型需通过验证集进行外部验证以确保模型的可用性。选取45个独立于建模的白酒基酒样品组成验证集,对已建立的校正模型进行外部检验,每个样品预测值和真实值的相关性如图3所示。结果表明,2,3-丁二酮的R2为0.957 6,RMSEP为0.40 mg/100 mL;3-羟基-2-丁酮的R2为0.957 8,RMSEP为0.24 mg/100 mL。2,3-丁二酮和3-羟基-2-丁酮的R2均在0.95以上,表明预测值和真实值间无显著差异,RMSEP值较小且与RMSECV值相差不大,表明所建近红外定量模型的效果良好。


图3 2,3-丁二酮(A)和3-羟基-2-丁酮(B)验证集的预测值与真实值相关关系Fig.3 Correlation between predicted values and real values of 2,3-butanedione(A) and 3-hydroxy-2-butanone(B) in validation set
2.5 模型的精密度检验
通过重复测定样品的方式评价近红外模型的精密度。另选取5个白酒基酒样品,采用建立的近红外定量模型重复测定10次,计算每个样品中2,3-丁二酮和3-羟基-2-丁酮含量的平均值以及相对标准偏差(RSD)。由表3可知,5个样品的RSD均不大于0.92%,表明所建模型的精密度良好。

表3 模型的精密度检验结果Table 3 Precision test results of the model
3 结 论
本文通过傅里叶变换近红外光谱仪对白酒基酒样品进行光谱扫描,结合气相色谱法测得的2,3-丁二酮和3-羟基-2-丁酮的化学值,利用化学计量学方法建立近红外光谱定量模型,用于快速检测白酒基酒中的酮类物质。实验结果表明,校正集样品中2,3-丁二酮和3-羟基-2-丁酮化学值和预测值的R2分别为0.960 2和0.963 2,RMSECV分别为0.39、0.22 mg/100 mL;验证集中2,3-丁二酮和3-羟基-2-丁酮化学值和预测值的R2分别为0.957 6和0.957 8,RMSEP分别为0.40、0.24 mg/100 mL。另取5个样品重复测定的RSD均小于0.92%。上述结果表明,所建模型的自身校正效果和预测效果很好。本文建立的白酒基酒中酮类物质的近红外光谱快速检测方法,与传统的气相色谱法相比,检测结果相近,但操作更加简便,检测更加快捷,是一种较为理想的快速检测技术,可为工业生产中白酒质量控制提供依据。
