玉米雄性不育系晋玉1A的选育及其特性
2020-11-09张欢欢崔贵梅王长彪王晓清郝曜山杜建中王亦学孙毅
张欢欢,崔贵梅,王长彪,王晓清,郝曜山,杜建中,王亦学,孙毅
玉米雄性不育系晋玉1A的选育及其特性
张欢欢1,崔贵梅2,王长彪1,王晓清1,郝曜山1,杜建中1,王亦学1,孙毅1
(1山西农业大学生命科学学院/农业部黄土高原作物基因资源与种质创制重点实验室,太原 030031;2山西大丰种业有限公司,太原 030031)
【】利用分子生物学和细胞学方法确定晋玉1A的雄性不育类型,鉴定玉米种质资源对该不育系的恢保关系,并测定其一般配合力和特殊配合力,为应用晋玉1A雄性不育系开展杂交育种工作提供依据。在海南乐东、山西晋中、忻州和运城,调查晋玉1A连续3年田间的育性;对晋玉1A与郑58的雄花、花药、花粉进行观察比较;对晋玉1A与昌7-2杂交F1代的花粉进行I2-KI染色观察;用专性PCR方法对晋玉1A的不育类型进行鉴定;以晋玉1A作母本,与158个自交系进行测配,对F1代进行田间育性调查,以筛查与之适配的恢复系与保持系;对以晋玉1A配制的可育杂交种F2代群体和BC1群体,进行育性调查;对晋玉1A及郑58与10个玉米自交系杂交F1代的籽粒产量性状进行一般配合力和特殊配合力分析。晋玉1A在以上4个地点,连续3年的田间不育性状保持稳定。晋玉1A与郑58的雄花外形相似,但其颖壳不开裂,花药不外露,无花粉散出。I2-KI染色表明,晋玉1A的花粉完全败育。对晋玉1A与昌7-2杂交F1代植株花粉的显微观察表明,64.4%的花粉粒能够被I2-KI正常染色,35.6%花粉粒败育,说明该不育系属于配子体不育类型。经专性PCR鉴定,晋玉1A和昌7-2的细胞质都属于S型雄性不育细胞质类型。昌7-2核基因组携带恢复基因,掩盖了其细胞质雄性不育的表型。郑用琏等设计的专性鉴定引物特异性更强。在以晋玉1A作母本进行测配的158个自交系中,鉴定出96个保持类型,47个恢复类型和15个半恢复类型。在以晋玉1A配制的可育杂交种F2代群体中,存在3.1%—8.7%的不育株,表明恢复系中存在微效恢复基因。晋玉1A和郑58分别与10个自交系配制的同父异母杂交种之间籽粒产量差异不显著;对这些杂交种F1代配合力分析表明,晋玉1A的一般配合力略高于郑58。晋玉1A属于S型胞质雄性不育系,其不育性状稳定,花粉完全败育,在现有玉米种质资源中有一定量的恢复与保持类型材料。它与昌7-2杂交的F1代植株能够产生正常雄穗并散出可育花粉。微效恢复基因的存在使得花粉可染率向可育方向偏移,并导致F2群体中出现不育株。用晋玉1A和郑58分别与相同父本配制的杂交种间的产量均无显著差异,晋玉1A的一般配合力比郑58略高,可以在玉米杂交种选配中使用,也可用于转育新的不育系。
玉米;雄性不育;恢复基因;配合力
0 引言
【研究意义】作物的雄性不育性状在杂种优势利用中具有重要的作用。迄今为止,已经有许多玉米不育系材料被发现,但受小斑病专化侵染、雄花育性不稳定、恢复基因种质狭窄等问题影响,能在生产上应用的却很少。玉米杂种优势的生产利用虽然可以通过母本自交系去雄来实现,但该方式需要耗费大量的人力、物力,增加了制种的成本。创造和挖掘新的败育稳定、无专性致病菌侵染的不育系是许多玉米育种工作者的重要目标之一[1]。【前人研究进展】早在20世纪60年代,基于细胞质雄性不育系(cytoplasmic male sterility,CMS)的育种技术就在玉米杂交种生产过程中得到了广泛应用。依据雄花育性恢复的专效性,玉米的细胞质雄性不育类型划分为3种类型:CMS-T型(Texas)、CMS-S型(USDA)和CMS–C型(Charrua)。S型不育系是3个类型中最大的类型,中国育成的雄性不育系大多属于S型。S型属于配子体不育,雄花败育不如T型、C型彻底。目前,T型和C型不育系均有被小斑病菌侵染的报道,但尚未发现专门针对S型不育系的致病菌[2]。对线粒体基因组的测序表明,植物的细胞质雄性不育性状多由线粒体基因组重组产生的特殊嵌合基因导致[3]。玉米CMS-S型不育系在花粉形成的小孢子体成熟阶段大量表达一个1.6 kb的线粒体转录本,导致花粉败育。这段转录本含有2个嵌合基因和[3-5]。线粒体重组导致的雄性不育能够被特殊的核基因——恢复基因(fertility restorer,)恢复,其在不育系应用中具有重要意义。CMS-S型不育系具有1个主恢复基因,定位在第2染色体长臂上,前人用不同的群体进行了多次定位,目前仍未确定的信息[6-8],与其连锁最紧密的2个分子标记间的物理距离仍有1.4 Mb,对该基因克隆的难度还很大[9]。此外,在多个材料中还发现多个具有恢复能力的基因分布在玉米的多条染色体上[10-13]。【本研究切入点】目前,已有多种细胞质雄性不育系被发现和应用,但有限的不育细胞质资源一定程度上限制了不育系在玉米杂种优势育种中的应用。【拟解决的关键问题】本研究通过对细胞质雄性不育系——晋玉1A的农艺性状、不育系类型、配套的保持系与恢复系鉴定、F2代群体的育性分离特征、杂交种配合力测定等方面进行研究,为应用晋玉1A雄性不育系开展杂交育种工作提供依据。
1 材料与方法
1.1 晋玉1A的选育过程和来源
以昌7-2为母本,郑58为父本进行杂交,然后以郑58为父本,对杂交后代进行连续回交,在回交6代后获得整齐不分离的不育株系,即((昌7-2×郑58)×郑58×郑58……)BC6得到不育系,将此不育系命名为晋玉1A。
试验于2016—2018年在山西省晋中市山西省农业科学院东阳基地、海南乐东县山西省农业科学院南繁基地、山西省运城市棉花研究所试验基地和山西省忻州市玉米研究所试验基地进行。
1.2 雄花形态和花粉I2-KI染色观察
盛花期时,取郑58、晋玉1A、晋玉1A×昌7-2、郑58×昌7-2的雄花穗,用镊子剥开小花颖壳,露出花药并挤出花粉,用0.5% I2-KI溶液染色,在OLYMPUS SZ×16体视显微镜下观察拍照。
1.3 CMS专性PCR鉴定不育系类型
在3叶期时,取晋玉1A、郑58、昌7-2、JnA、B73的叶片,采用CTAB法提取玉米基因组DNA。其中,郑58为晋玉1A的保持系,昌7-2为晋玉1A的细胞质来源,B73为阴性对照,JnA为CMS-S型雄性不育系的阳性对照(由山西省农业科学院高粱研究所在1996年发现的玉米不育系材料)。经过专效恢复系分组鉴定、细胞学形态观察、F1代花粉染色观察,确定JnA为S型细胞质雄性不育[14-15]。参照Liu等[16]方法设计CMS专性鉴定引物CMST-F/R、CMSC-F/R和CMSS-F/R;参照郑用琏等[17]专利设计玉米CMS专性鉴定引物CMST-1/2、CMSC-1/2和CMSS-1/2(表1)。PCR反应体系为10×Buffer 2 μl、2.5 mmol·L-1dNTPs 2 μl、10 mmol·L-1引物各0.6 μl、Taq酶0.3 μl、DNA模板2 μl,加ddH2O至20 μl。反应程序为94℃ 2 min;94℃ 30 s,60℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min,4℃保存。用1.5%琼脂糖凝胶电泳检测PCR产物。
1.4 不育系的恢复系鉴定
以晋玉1A为母本,与其他158份玉米自交系杂交,将杂交种按穗行播种,在花期鉴定F1代植株雄花的育性。参照Duvick[18]的育性鉴定方法,在散粉结束时根据花药的外露程度将育性分为0—5级。F1代为0—1级的植株,其父本判定为保持类型;F1代为4—5级的植株,其父本判定为恢复类型;其余的父本判定为半恢复类型。

表1 玉米CMS专性鉴定引物
1.5 遗传群体的育性调查
将晋玉1A×昌7-2、晋玉1A×G155和晋玉1A×昌7-2无叶舌F1代植株分别进行自交,在F2代群体散粉期调查单株雄穗的开花、散粉情况。将颖壳张开、有花粉散出的定义为可育株,将颖壳不张开、无花粉散出的定义为不育株。同时对(昌7-2×郑58)×郑58的BC1代群体进行雄花的育性调查。
1.6 晋玉1A和郑58配制杂交种的配合力测定
以晋玉1A和郑58为母本,分别与10个玉米自交系(PH4CV、PHB1M、PH6WC、B73、L269、Mo17、昌7-2、G154、G30和G31)进行不完全双列杂交,配制20个杂交组合。2016年在晋中试验地春播,按小区(2.25 m×5 m)播种,行距45 cm,株距41.7 cm,每行12株,每小区6行,种植密度约64 000株/hm2,设3次重复。成熟后,收获中间2行进行测产。用谷物水分仪测量水分,按14%的含水分折算每公顷产量。采用R软件V3.6.0版本进行数据分析[19],采用ggplot2包绘图[20]。根据田间产量进行配合力方差分析,进一步评估籽粒产量性状的一般配合力(general combining ability,GCA)和特殊配合力(specific combining ability,SCA)。
2 结果
2.1 晋玉1A农艺性状及特征
晋玉1A在晋中地区春播生育期130 d左右,平均株高154.2 cm,平均穗位高63 cm,15—16片叶,叶色淡绿,叶片较窄,穗位以上叶片上冲,而叶尖轻度下垂。雄穗分枝4—6个且与主轴夹角极小。果穗柄较短,与茎夹角小,黄绿色花丝,平均穗长17.1 cm,穗行数14—16行,白轴,籽粒桔黄色偏硬粒型,千粒重320 g左右,品质好,无专性感病。
2.2 花粉I2-KI染色
晋玉1A雄花外形与郑58雄花相似,花药不开裂,无花粉散出。偶尔可见有一两朵小花颖壳张开,但未见花药伸出(图1-1)。剥开颖壳观察,晋玉1A花药个数与郑58无差异,但晋玉1A花药干瘪,花粉粒少,I2-KI染色无明显反应(图1-2)。晋玉1A的花粉粒经I2-KI溶液染色后,呈棕黄色(图1-3),正常玉米花粉呈深黑色(图1-4)。
晋玉1A×昌7-2的花粉经I2-KI溶液染色后,部分花粉不能被染色(图2-A)。郑58×昌7-2的花粉经I2-KI溶液染色后,几乎所有花粉均能被染色(图2-B)。统计5个视野下共379粒晋玉1A×昌7-2的花粉,其中244粒能被正常染色,135粒花粉只能观察到不规则形状的花粉壁而不能被正常染色。其中,正常花粉占63.4%,花粉可染率进行χ2检验,结果表明,其不符合1﹕1的分离比例。虽然晋玉1A与恢复系的F1代花粉可染率偏离了50%,但能够观察到花粉壁,符合配子体不育的特征,仍可以判定晋玉1A属于CMS-S型不育系。
2.3 专性PCR鉴定晋玉1A不育类型
根据专性PCR鉴定结果(图3),CMSS-F/R与CMSS-1/2 2对引物均支持晋玉1A为CMS-S类型,同时,CMSC-F/R引物在JnA、晋玉1A与郑58中存在非特异性扩增条带;CMST-F/R与CMST-1/2均不支持晋玉1A为CMS-T类型。综上所述,晋玉1A属于S型不育系,昌7-2也具有S型雄性不育细胞质特征。晋玉1A的S型细胞质来源于昌7-2而非自然突变。
2.4 不育系的恢复系鉴定
通过对158份自交系与晋玉1A杂交后代的育性恢复调查,结果表明,47个为恢复类型,96个为保持类型,还有15个为半恢复类型。
2.5 遗传群体的不育率调查
通过对(昌7-2×郑58)×郑58 BC1回交群体的调查发现,48株的群体中有25株不育株,经χ2检验,不育株与可育株的分离比例,符合1﹕1的期望值,表明昌7-2具有1个恢复基因。但是对4个F2代群体的雄花育性调查表明,在F2代群体中存在育性恢复不彻底的现象,不育株出现的比例为3.4%—8.7%(表2)。
2.6 晋玉1A和郑58分别与10个玉米自交系配制的杂交种的配合力测定
以晋玉1A与郑58为母本,分别与10个玉米自交系(PH4CV、PHB1M、PH6WC、B73、L269、Mo17、昌7-2、G154、G30和G31)进行不完全双列杂交,每个组合设3个区组重复测产(图4)。郑58×G31的产量最高,为14 062.64 kg·hm-2,较生产上常用的杂交种郑58×昌7-2(13 553.69 kg·hm-2)提高了3.76%。晋玉1A×L269产量为13 768.04 kg·hm-2,较生产上常用的杂交种郑58×昌7-2提高了1.58%,较郑58×L269(13 084.98 kg·hm-2)产量提高了5.22%。T测验表明,晋玉1A、郑58与相同父本配制的杂交种间的产量均无显著差异。需要说明的是,利用晋玉1A配制的杂交组合中,只有昌7-2为父本的组合育性恢复完全。以PH4CV为父本的组合有部分植株的花药伸出,但花粉很少,其余的组合均为雄性不育。

1:雄花;2:花药;3:晋玉1A的花粉粒;4:郑58的花粉粒。A:晋玉1A;B:郑58

M:Marker 2000;1—3:B73(阴性对照);4—6:JnA(阳性对照);7—9:晋玉1A;10—12:昌7-2(晋玉1A的细胞质来源);13—15:郑58(晋玉1A的保持系)

图4 以晋玉1A与郑58分别为母本配制杂交种的产量比较
通过对以晋玉1A与郑58分别为母本配制杂交种的产量进行方差分析(表3),结果表明,不同杂交组合的产量在父本间的差异达到极显著水平,而在母本和父母本互作间的差异不显著。
通过对父母本的一般配合力及效应值进行估算(表4),结果表明,母本中晋玉1A的一般配合力(114.51)比郑58高(-114.51)。父本材料中L269、G31、PHB1M、PH6WC和昌7-2的一般配合力均为正值,分别为1 307.86、1 133.71、932.83、872.56和705.11,其中L269的一般配合力最高。
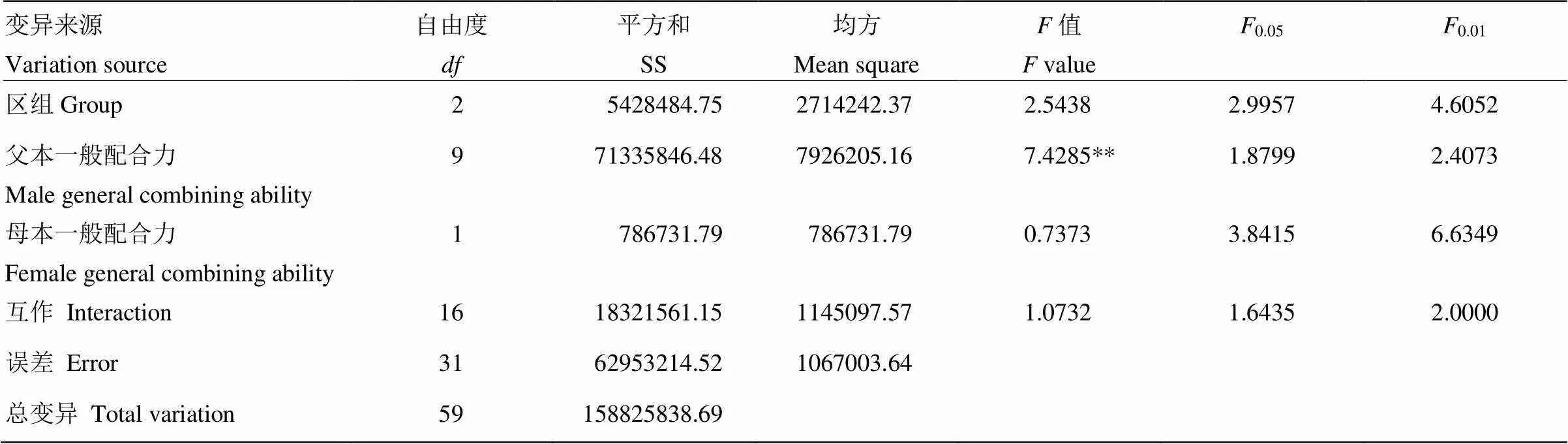
表3 杂交种产量的方差分析
**在<0.01水平时差异极显著 ** significant difference at<0.01

表4 自交系的一般配合力及效应值
通过对杂交种的特殊配合力及特殊配合力效应值进行估算(表5),郑58×G31与郑58×昌7-2的特殊配合力最高,分别为924.79和844.44,一般配合力对于产量的贡献相对较大。

表5 晋玉1A与郑58配制的杂交组合的特殊配合力
3 讨论
3.1 玉米细胞质雄性不育的鉴定方法
在玉米细胞质雄性不育系研究中,确定雄性不育细胞质的类型非常重要。对于玉米雄性不育细胞质类型的鉴定方法主要有大田育性恢复专效性鉴定[21]、线粒体DNA鉴定法[22]、细胞学差异比较以及专性PCR检测法[16-17]。其中,专性PCR检测从导致细胞质雄性不育的基因入手,来揭示材料归属,是最可靠方便的方法。专性PCR检测法具有快速、简便、准确的特点,许多研究已经利用该技术成功进行了不育系类型鉴定,结果与传统的恢复专效性鉴定结果相符[23-26]。此外,田红丽等[27]还针对玉米S型不育系开发叶绿体InDel标记。
为了鉴定晋玉1A所属的细胞质雄性不育类型,本研究用了2套不同的引物进行鉴定,其中Liu等[16]的专性鉴定引物(CMSC-F/R、CMST-F/R和CMSS- F/R)CMSC-F/R产生了非特异性扩增,造成了晋玉1A属于CMS-C型的误判。通过比较回交母本与父本材料,以及郑用琏等[17]的专性鉴定引物(CMSC-1/2、CMST-1/2和CMSS-1/2)的PCR结果,推测晋玉1A属于CMS-S型细胞质雄性不育类型。
陈伟等[24]研究发现CMS-T Mo17(CMS-T型)、CMS Tangxu Mo17(CMS-S型)、CMS-P POP(CMS-S型)、POP(N型)、Mo17(N型)在使用CMSC-F/R引物扩增时均出现了非特异性条带,该条带与CMS-C Mo17(CMS-C型)的特异性条带大小非常接近。孙丽芳等[25]发现T103(CMS-T型)、HD103、85218B在使用CMSC-F/R引物扩增时也出现了非特异性条带。由此可以看出,如果缺乏CMS-C型的阳性对照,CMSC-F/R引物的扩增结果非常容易造成误判。而郑用琏等[17]设计的特异性PCR引物特异性更好,结果更准确,建议作为以后玉米细胞质雄性不育类型鉴定的标准引物使用。通过将晋玉1A与昌7-2的PCR结果比较,可以看到晋玉1A的细胞质不育类型与昌7-2一致,说明晋玉1A的不育性不是在连续回交过程中产生突变造成的,而是利用郑58连续回交造成了昌7-2恢复基因的丢失,导致晋玉1A雄性不育。昌7-2虽然携带S型细胞质不育基因,但由于其本身具有恢复基因,掩盖了其细胞质雄性的性状,结果表明,通过对自交材料的特异性PCR检测可以筛选具有细胞质不育基因的材料。
细胞学研究表明,CMS-C和CMS-T为孢子体不育,属于无花粉类型,而CMS-S型为配子体不育,花粉败育发生在二核后期,在花粉完全充实之前,花粉粒内含物消失,只留下花粉壁[28]。CMS-C和CMS-T型不育系与其恢复系杂交的F1代花粉表现为全可育;CMS-S型不育系与其恢复系杂交的F1代植株的花粉粒理论上应出现50%的不育。晋玉1A×昌7-2杂交F1代的花粉经I2-KI染色后观察到不能被染色的败育花粉粒占35.6%,基本符合CMS-S型F1代花粉半不育的特征。但其花粉可染率不符合50%的理论值。这种偏分离现象也出现在Mo17cms-Tangxu、PoPcms-P等CMS-S型不育系的F1代中,受基因型和环境因素影响,使得S型不育系F1代的花粉可染率向可育方向发生了一定程度的偏移[24]。
3.2 玉米中S型细胞质不育的恢复基因
玉米细胞质雄性不育恢复基因的克隆工作难度较大,3种细胞质不育类型中只有CMS-T型的恢复基因被克隆[29]。CMS-S型雄性不育系的恢复基因主效是,其被定位在第2染色体长臂上,距离whp1与BNL17.14标记6.4 cM的位点上[30]。许多学者投入大量工作进行的定位工作[6-8, 11],目前,最接近的标记为A165与CG2,2个标记间的物理距离约为1.4 Mb,但对于的克隆难度依然很大[9]。
CMS-S型雄性不育系的育性恢复机制是复杂的,除了主效基因外,还有多个基因参与。铁双贵[31]曾检测到6个对育性有显著效应的QTL,其中有4个位于第2染色体长臂,在位点附近还有2个效应显著的QTL位点。此外,在第9染色体与第6染色体上也分别检测到2个QTL位点。Susan等[10]对51个含有等位基因的材料进行评估,将其中42个材料的等位基因定位于第2染色体长臂上,但仍有9个等位基因定位在其他染色体上。Feng等[12]GWAS分析表明,来自不同染色体上的多个SNP位点与S型不育系的育性恢复相关。Su等[32]通过BSR-RNA-seq的方法将部分育性恢复的微效基因定位至第2染色体的短臂上的5个区段。GABAY-LAUGHNAN等[33]通过筛选转座子库,发现了10独立的含有恢复基因的突变体,这些突变体中许多存在种子致死表型,这些突变体具有一致的特征:核基因编码的细胞色素氧化酶丰度增加,而线粒体编码的ATP合酶1亚基的含量降低。
晋玉1A的F2代群体中出现了少量的不育株,侯爱斌等[15]在JnA×恢313的F2代中也观察到了不育株的出现。这是由于微效恢复基因的存在使得F1植株中具有基因型的配子成为可育配子,产生F1代花粉可染率向可育方向偏移[31]。基因型可育配子参与受精影响了F2群体的基因型,微效恢复基因不能够或者不能单独使基因型不育系恢复育性,从而造成晋玉1A与恢复系杂交后的F2群体会出现一定比例的不育株。
3.3 晋玉1A不育系的应用潜力分析
在雄性不育性状利用方面,不育系的配合力低及育性不稳定等问题是育种中的主要问题[34]。本研究表明,晋玉1A均不存在以上问题,能够应用于玉米制种。首先,晋玉1A不育性状能稳定保持,不受环境影响,能够作为杂交育种的母本使用。其次,晋玉1A与恢复系的F1杂交种育性完全恢复,花粉半可育。配合力测定表明,晋玉1A的一般配合力比郑58略高,其与保持系郑58作母本与不同父本配制的杂交种产量无明显差异,与B73、G154、G30配制的杂交种较郑58配制的同型杂交种产量均值提高幅度在10%以上。
此外,在生产田中有意引入不育株也有增产的作用。刘春增等[35]利用雄性不育系或者人工去雄均能够达到增加小区产量的目的,玉米在雄穗的散粉期,也是雌穗发育需要养分的重要时期,利用不育基因来减少其花粉发育对植株体内的养分消耗,无疑是很好的增产措施。马冲[36]试验也取得了相似的结论,并提出1﹕3的最佳比例,将不育杂种与可育杂交种混合,既满足不育株和可育株对花粉的需要,又最大限度地发挥雄性不育的增产作用。具有S型恢复基因的玉米自交系的种质资源相对较少,配制完全可育的杂交种需要对父本材料进行连续多代回交转育,掺合型的栽培方式有利于加快晋玉1A不育系的推广应用。随着主推品种雄穗大小越来越小,杂交种自身的花粉量已经很小,需要注意防范大田玉米授粉期受气候异常、病虫害等外界因素导致的花期不育、授粉不充分等风险。
4 结论
晋玉1A的育性稳定,花药不外露,花粉完全败育,无育性恢复风险,属于S型胞质互作不育类型。晋玉1A有合适的保持系与恢复系,郑58能够作为它的保持系,而它与昌7-2及其衍生系杂交F1的植株能够正常开花散粉,育性恢复。因此,昌7-2系列的玉米自交系可以作它的恢复系。昌7-2不仅具有主效恢复基因,还有微效恢复基因,导致花粉可染率向可育方向偏移。晋玉1A、郑58与相同父本配制的杂交种间的产量均无显著差异,晋玉1A的一般配合力比郑58略高,可以用于选配新的杂交种和转育新的不育系。
[1] 李小琴, 刘纪麟, 万邦惠, 郑用琏, 李建生, 徐尚忠, 季世国. 玉米新不育胞质WBMs的利用潜力研究. 中国农业科学, 2004, 37(8): 1099-1103.
Li X Q, Liu J L, Wan B H, Zheng Y L, Li J S, Xu S Z, Ji S G. Classification of male sterile cytoplasms of WBMs in maize (L.)., 2004, 37(8): 1099-1103. (in Chinese)
[2] 段柳静. 玉米C型胞质雄性不育育性恢复主基因的精细定位[D]. 郑州: 河南农业大学, 2009.
Duan L J. Linkage mapping of
[3] Allen J O, Fauron C M, Minx P, Roark L, Oddiraju S, Lin G N, Meyer L, Sun H, Kim K, Wang C. Comparisons among two fertile and three male-sterile mitochondrial genomes of maize., 2007, 177(2): 1173-1192.
[4] Susan G L, Kuzmin E V, Jessica M, Leah R, Newton K J. Characterization of a novel thermosensitive restorer of fertility for cytoplasmic male sterility in maize., 2009, 182(182): 91-103.
[5] Zabala G, Gabay-Laughnan S, Laughnan J R. The nuclear geneaffects the expression of the mitochondrial chimeric sequence R implicated in S-type male sterility in maize., 1997, 147(2): 847-860.
[6] 石永刚, 郑用琏, 李建生, 刘纪麟. 玉米S组CMS育性恢复基因的分子标记定位. 作物学报, 1997, 23(1): 1-6.
Shi Y G, Zheng Y L, Li J S, Liu J L. Mapping CMS-S restores genewith RFLPs and RAPDs., 1997, 23(1): 1-6. (in Chinese)
[7] Zhang Z F, Wang Y, Zheng Y L. AFLP and PCR-based markers linked to, a fertility restorer gene for S cytoplasmic male sterility in maize., 2006, 276(2): 162-169.
[8] 薛亚东. 玉米S-CMS育性恢复基因精细定位和玉米耐旱全基因组关联分析[D]. 武汉: 华中农业大学, 2013.
Xue Y D. Fine-mapping of a restorer of fertility gene for S-CMS in maize and genome-wide association study(GWAS) of drought tolerance in maize (L.)[D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese)
[9] 李鹏, 肖森林, 王淑霞, 刘娟, 赵贤容, 陈化榜. 玉米S型细胞质雄性不育恢复基因Rf3的精细定位及其候选基因预测. 山东农业科学, 2014, 46(8): 1-5.
Li P, Xiao S L, Wang S X, Liu J, Zhao X R, Chen H B. Fine mapping of fertility restorer gene3 of S-Type cytoplasmic male sterility and candidate gene prediction in maize., 2014, 46(8): 1-5. (in Chinese)
[10] Susan G L, Chase C D, Ortega V M, Liming Z. Molecular-genetic characterization of CMS-S restorer-of-fertility alleles identified in Mexican maize and teosinte., 2004, 166(2): 959.
[11] Tie S, Xia J, Qiu F, Zheng Y. Genome-wide analysis of maize cytoplasmic male sterility-S based on QTL mapping., 2006, 24(1): 71-80.
[12] Feng Y, Zheng Q, Song H, Wang Y, Wang H, Jiang L, Yan J, Zheng Y, Yue B. Multiple loci not onlyinvolved in the restoration ability of pollen fertility, anther exsertion and pollen shedding to S type cytoplasmic male sterile in maize., 2015, 128(11): 2341-2350.
[13] 冯阳. 玉米S型细胞质雄性不育育性恢复基因位点全基因组关联分析研究[D]. 武汉: 华中农业大学, 2015.
Feng Y. Genome-wide association analysis of fertility restoration ability to S type cytoplasmic male sterile in maize[D]. Wuhan: Huazhong Agricultural University, 2015. (in Chinese)
[14] 侯爱斌, 柳青山, 李团银, 崔贵梅, 侯旭东, 袁爱平. 玉米细胞质不育系JnA的分组鉴定和花粉败育观察. 作物学报, 2004, 30(12): 1278-1280.
Hou A B, Liu Q S, Li T Y, Cui G M, Hou X D, Yuan A P. Observation on pollen abortion and classification of cytoplasmic male sterile inbred JnA in maize., 2004, 30(12): 1278-1280. (in Chinese)
[15] 侯爱斌, 柳青山, 董良利, 李团银, 侯旭东, 梁笃, 段冰. 玉米细胞质雄性不育系JnA的分组鉴定及利用. 华北农学报, 2006, 21(1): 31-34.
Hou A B, Liu Q S, Dong L L, Li T Y, Hou X D, Liang D, Duan B. Application and classification of cytoplasmic male sterile inbred JnA in maize., 2006, 21(1): 31-34. (in Chinese)
[16] Liu Z, Peter S O, Long M, Weingartner U, Kaeser O. A PCR assay for rapid discrimination of cytoplasm types in maize., 2002, 42(2): 566-569.
[17] 郑用琏, 方明镜, 张方东, 刘纪麟. 鉴别玉米细胞质雄性不育材料胞质类型的方法:中国, CN1514017. 2004,
Zheng Y L, Fang M J, Zhang F D, Liu J L. Methods to identify cytoplasm types of maize: China, CN1514017. 2004. (in Chinese)
[18] Duvick D N. Allelism and comparative genetics of fertility restoration of cytoplasmically pollen sterile maize., 1956, 41(4): 544.
[19] Team R C. R: A language and environment for statistical computing. 2018, R Foundation for Statistical Computing, Vienna, Austria.
[20] Wickham H.. New York: Springer International Publishing, 2016.
[21] 李小琴, 刘纪麟, 万邦惠, 徐尚忠, 季世国. 玉米CMS育性恢复专效性分类系统的研究. 华中农业大学学报, 1999, 18(3): 1-4.
Li X Q, Liu J L, Wan B H, Xu S Z, Ji S G. Research on the classification system of fertility restorer specific effect of CMS in maize., 1999, 18(3): 1-4. (in Chinese)
[22] 谢友菊, 戴景瑞. 用线粒体DNA鉴定玉米雄性不育细胞质的研究. 遗传学报, 1988, 15(5): 335-339.
Xie Y J, Dai J R. Study on identification of male sterile cytoplasma using analysis of mitochondrial DNAs in maize., 1988, 15(5): 335-339. (in Chinese)
[23] 张祖新, 方明镜, 杜何为, 邓莉蓉, 郑用琏. 基于PCR技术的玉米CMS材料胞质类型的快速鉴定. 作物学报, 2005, 31(10): 1386-1388.
Zhang Z X, Fang M J, Du H W, Deng L R, Zheng Y L. The rapid discrimination based on PCR on cytoplasmic types of male sterile line of maize (L.)., 2005, 31(10): 1386-1388. (in Chinese)
[24] 陈伟, 刘占先, 鄂立柱, 杨会, 戴景瑞. 玉米细胞质雄性不育材料CMS-P的胞质分类研究. 作物学报, 2007, 33(2): 196-200.
Chen W, Liu Z X, E L Z, Yang H, Dai J R. Classification of male sterile cytoplasm of CMS-P in maize ()., 2007, 33(2): 196-200. (in Chinese)
[25] 孙丽芳, 邓杰, 王霞, 赵伟, 杨克军, 苗兴芬, 高树仁. 玉米细胞质雄性不育系胞质类型鉴定及花粉败育研究. 作物杂志, 2016, 172(3):27-32.
SUN L F, DENG J, WANG X, ZHAO W, YANG K J, MIAO X F, GAO S R. Type Identification of cytoplasmic male sterile line and study of pollen abortion in maize., 2016, 172(3):27-32. (in Chinese)
[26] ZHOU G C, SHI H C, YU X J, YUAN J C, GUO Q, ZHAO C Y, SUN Q, KE Y P. Genetic characterisation and cytological identification of a male sterile mutant in maize (L.)., 2018, 46(2): 344-354.
[27] 田红丽, 晏朋涛, 王蕊, 杨扬, 许理文, 易红梅, 王元东, 宋伟, 席章营, 赵久然, 王凤格. 基于叶绿体InDel标记对玉米S型胞质不育制种鉴定的研究. 玉米科学, 2019, 27(2): 53-60, 68.
Tian H L, Yan P T, Wang R, Yang Y, Xu L W, Yi H M, Wang Y D, Song W, Xi Z Y, Zhao J R, Wang F G. Identification of maize S-type cytoplasmic male sterile (CMS) using two chloroplast inDel markers in seed production., 2019, 27(2): 53-60, 68. (in Chinese)
[28] 夏涛, 刘纪麟. 玉米细胞质雄性不育的细胞学研究. 作物学报, 1989, 15(2): 97-103.
Xia T, Liu J L. The cytological study of cytoplasmic male sterility in maize., 1989, 15(2): 97-103. (in Chinese)
[29] WAN X, WU S, LI Z, DONG Z, AN X, MA B, TIAN Y, LI J. Maize genic male-sterility genes and their applications in hybrid breeding: Progress and perspectives., 2019,12(3): 321-342.
[30] Kamps T L, Chase C D. RFLP mapping of the maize gametophytic restorer-of-fertility locus () and aberrant pollen transmission of the nonrestoringallele., 1997, 95(4): 525-531.
[31] 铁双贵. 玉米S组CMS育性不稳定现象遗传与基因定位[D]. 武汉: 华中农业大学, 2000.
Tie S G. Genetic genome-wide analysis of maize S-CMS unstable fertility restoration based on QTL mapping[D]. Wuhan: Huazhong Agricultural University, 2000. (in Chinese)
[32] Su A, Song W, Xing J, Zhao Y, Zhang R, Li C, Duan M, Luo M, Shi Z, Zhao J. Identification of genes potentially associated with the fertility instability of S-Type cytoplasmic male sterility in maize via bulked segregant RNA-Seq., 2016, 11(9): e0163489.
[33] GABAY-LAUGHNAN S, SETTLES A M, HANNAH L C, PORCH T G, BECRAFT P W, MCCARTY D R, KOCH K E, ZHAO L, KAMPS T L, CHAMUSCO K C, CHASE C D. Restorer-of-fertility mutations recovered in transposon-active lines of S male-sterile maize., 2018, 8(1): 291-302.
[34] 吕庆雪, 于彩虹, 李毅丹, 高嵩, 牟勇, 林志, 宋广树, 刘伟. 浅析玉米杂交制种技术. 分子植物育种, 2018, 16(12): 4037-4042.
Lü Q X, YU C H, LI Y D, GAO S, MU Y, LIN Z, SONG G S, LIU W. Analysis of hybrid seed production in maize., 2018, 16(12): 4037-4042. (in Chinese)
[35] 刘春增, 郭永才, 关国志, 司智成, 鲁保良, 刘日尊, 赵文媛. 利用雄性不育生产玉米杂交种增产因素分析. 杂粮作物, 2000, 20(5): 11-13.
Liu C Z, Guo Y C, Guan G Z, Si Z C, Lu B L, Liu R Z, Zhao W Y. Analysis of factors for increasing yield of hybrid maize by using male sterility., 2000, 20(5): 11-13. (in Chinese)
[36] 马冲. 玉米S型胞质不育系应用潜力与增产效应研究[D]. 郑州: 河南农业大学, 2005.
Ma C. Study on yield response and application potential of cytoplasmic male sterile lines in maize[D]. Zhengzhou: Henan Agricultural University, 2005. (in Chinese)
Breeding and characteristics of a new male sterile line of maize, Jinyu1A
ZHANG HuanHuan1, CUI GuiMei2, WANG ChangBiao1, WANG XiaoQing1, HAO YaoShan1,
(1College of Life Sciences, Shanxi Agricultural University/Key Laboratory of Crop Gene Resources and Germplasm Enhancement on Loess Plateau, Ministry of Agriculture, Taiyuan 030031;2The Seed Industry Limited Company of Shanxi Dafeng, Taiyuan 030031)
【】The study was aimed to determine the type of the male sterile line of maize, Jinyu1A, by molecular biology and cytology approaches, identify restoring and maintaining relationships of maize germplasm resources to the sterile line, and to test its general combining ability (GCA) and specific combining ability (SCA).【】The stability of sterility of Jinyu1A was investigated at 4 locations (Ledong, Jinzhong, Xinzhou and Yuncheng) for successive 3 years. Tassel, anther and pollen grains of Jinyu1A was observed and compared with Zheng58. F1pollen grains of Jinyu1A×Chang7-2 were observed by I2-KI staining. The sterility type of Jinyu1A was identified by specific PCR. Jinyu1A was used as the female parent and test-crossed with 158 maize inbred lines. The fertility of F1plants was investigated to screen for the suitable restorer and maintainer lines. The fertility of F2and BC1population plants was investigated. The grain yield general combining ability and specific combining ability of Jinyu1A were estimated by analyzing the data of its F1hybrids.【】The sterility characters of Jinyu1A were stable in the 4 locations for the 3 years. The appearance of tassel of Jinyu1A was similar to that of Zheng58, but its glumes were closed, anthers were withered and could not exert out of the glumes, and I2-KI staining showed that the pollen of Jinyu1A was completely sterile. The microscopical observation on the pollen grains of F1hybrid plants of Jinyu1A and Chang7-2 showed that 64.4% of the pollen grains could be stained dark by I2-KI and 35.6% pollen grains were aborted, which indicated that the sterile line belonged to S-type cytoplasmic sterile lines. The cytoplasm of Jinyu1A and Chang7-2 were identified as S-type male sterile type by specific PCR. The nuclear genome of Chang7-2 carries restorer genes, which concealed the phenotype of cytoplasmic male sterility. The specific primers suggested by ZHENG. were more applicable for categorizing maize cytoplasm sterile types. Among 158 inbred lines test-crossed with Jinyu1A as female parent, 96 maintainers, 47 restorers, and 15 semi-restorers were identified. There were 3.1%-8.7% sterile plants in F2populations derived from fertile F1plants of crosses between Jinyu1A and the restorer lines, which indicated that there were minor effect restorer genes in the restorer lines. There was no significant difference in the grain yields of the hybrids between each of Jinyu1A and Zheng58 as females and other 10 inbred lines as males, respectively. However, the F1combining ability analysis of these hybrids showed that the general combining ability of Jinyu1A was slightly higher than that of Zheng58.【】Jinyu1A was a S-type cytoplasmic male sterile line with stable male sterile characters and completely aborted pollen grains. There are a certain amount of restorer and maintainer type breeding stocks for Jinyu1A in the present maize germplasm resources. F1plants of its hybrid with Chang7-2 could produce normal panicles and disperse fertile pollen. The existence of minor effect restorer gene(s) made the pollen dyeability shift to the direction of fertility, which led to the emergence of a few fertile plants in F2populations. There was no significant difference in the grain yield between the hybrids with Jinyu1A and Zheng58 each as female parents test-crossed with the same male parents. The general combining ability of Jinyu1A was slightly higher than that of Zheng58, indicating that it could be used in the breeding programs for selecting new maize hybrids and male sterile lines.
maize; male sterility; restorer gene; combining ability

10.3864/j.issn.0578-1752.2020.21.002
2019-12-14;
2020-03-07
国家转基因生物新品种培育科技重大专项(2016ZX08003-001)、山西省重点研发计划(201803D221017-2)、山西省农业科学院农业科技创新研究课题(YCX2018D2YS07)
张欢欢,E-mail:frank.red@163.com。崔贵梅,E-mail:guimeicui@126.com。张欢欢和崔贵梅为同等贡献作者。通信作者孙毅,E-mail:sunyi692003@163.com
(责任编辑 李莉)
