长江中下游小麦抗赤霉病品种的筛选与部分农艺性状分析
2020-11-09胡文静张春梅吴迪陆成彬董亚超程晓明张勇高德荣
胡文静,张春梅,吴迪,陆成彬,董亚超,程晓明,张勇,高德荣,2
长江中下游小麦抗赤霉病品种的筛选与部分农艺性状分析
胡文静1,2,3,张春梅1,吴迪1,陆成彬1,董亚超3,程晓明1,张勇1,高德荣1,2
(1江苏里下河地区农业科学研究所/农业农村部长江中下游小麦生物学与遗传育种重点实验室,江苏扬州 225007;2扬州大学江苏省粮食作物 现代产业技术协同创新中心,江苏扬州 225009;3中国农业科学院作物科学研究所,北京 100081)
【】赤霉病严重危害中国乃至世界小麦的产量和品质,培育和种植抗病品种是控制赤霉病最经济、有效和安全的方法。是国内外公认的抗赤霉病主效基因,通过筛选综合农艺性状优良的抗赤霉病品种,探明在不同遗传背景下对小麦赤霉病抗性的影响,为小麦抗赤霉病育种提供理论依据和材料来源。选取历年来长江中下游广泛种植的75份小麦改良品种和18份地方品种,2016—2018年连续3年采用单花滴注结合弥雾保湿进行供试品种的赤霉病抗扩展鉴定,根据3年平均病小穗率和严重度分级,将供试品种分成抗病(R级)、中抗(MR级)、中感(MS级)和感病(S级),并利用的KASP标记检测;2019年调查筛选出的平均赤霉病抗性水平达到中感及以上小麦品种的株高、穗粒数、小穗数、穗长和千粒重。3年赤霉病鉴定结果表明,供试品种中有2个品种平均赤霉病抗性达到R级,平均病小穗率范围为7.8%—9.7%,65个品种达到中抗至中感,平均病小穗率范围为13.2%—49.5%,26个品种达到S级,平均病小穗率范围为53.6%—78.5%。22个小麦品种在位点呈抗病基因型(简称+),71个品种在该位点呈感病基因型(简称-),+品种平均病小穗率显著低于-品种(<0.05)。赤霉病鉴定筛选得到67个抗性达到中感及以上水平的品种,考察这些品种的农艺性状发现宁麦19、扬麦29、扬麦16、扬麦23、扬糯麦1号、扬麦20、宁麦12和扬辐麦4号的株高、穗粒数和千粒重等综合农艺性状优良,可作为小麦抗赤霉病育种的亲本选用。除苏麦3号和望水白外,供试材料中未发现其他高抗赤霉病的种质资源。筛选得到的赤霉病抗性与综合农艺性状结合较好的小麦品种以扬麦品种为主,其中只有扬辐麦4号携带抗病基因。利用抗病基因并不是解决小麦赤霉病危害的唯一途径。
小麦;赤霉病;抗扩展;抗病基因;种质资源;农艺性状
0 引言
【研究意义】小麦是世界上最重要的粮食作物之一,是全世界1/3以上人口的主食[1]。中国是小麦第一大生产国、消费国和贸易国,小麦生产状况对全国社会经济发展、人民生活水平提高、国家粮食安全和社会稳定具有极其重要的影响。目前,中国乃至世界小麦生产面临的主要挑战是各种病害、虫害和非生物胁迫等威胁,其中,小麦赤霉病危害尤为严峻。小麦赤霉病(head blight,FHB)主要由禾谷镰刀菌()等引起,于小麦开花期侵染穗部小花,在小麦籽粒灌浆成熟过程中不断繁殖,产生和积累各种毒素,例如脱氧雪腐镰孢菌烯醇(deoxynivalenol,DON)、雪腐镰孢菌烯醇(nivalenol,NIV)和玉米赤霉烯酮(zearalenol,ZEN),严重影响小麦产量和品质,并对人、畜健康造成巨大伤害,成为粮食安全的主要威胁[1]。黄淮冬麦区和长江中下游冬麦区是中国两大小麦主产区,年种植面积约占全国小麦总面积70%,后者是小麦赤霉病高发区和常发区。据报道,2012—2015年江苏省年均赤霉病发生面积约120万hm2[2]。近年来,随着气候变暖和玉米秸秆还田量的增加,小麦赤霉病正迅速扩展到黄淮麦区南部。据统计,近10年河南省小麦赤霉病年均发生面积约110万hm2,其中2012年达333万hm2[3]。目前,培育和推广种植抗赤霉病品种是小麦生产上有效防控赤霉病的重要途径之一[3],而从遗传背景丰富的地方品种和农艺性状优良的栽培品种中筛选出稳定抗赤霉病种质资源,是提高小麦抗赤霉病育种效率的基础。广泛搜集并鉴定筛选综合农艺性状优良、丰产性好的抗赤霉病新种质资源,拓展抗源的遗传基础,对于小麦抗赤霉病育种和生产具有重要意义。【前人研究进展】国内外科学家一直致力于开展小麦抗赤霉病种质资源的鉴定发掘[4-6]。中国的小麦赤霉病抗源主要有两类:一是现在应用较广泛的早期改良品种和地方品种,如中国的苏麦3号、荆州1号、武汉1号、望水白、白三月黄、海盐种[6]和它们的衍生系、巴西的Frontana、Maringa等以及欧洲的Funo等[7];二是从小麦近缘种属中发掘的抗赤霉病新种质,如大赖草属、偃麦草属、鹅观草属、山羊草属中发现的抗赤霉病种质[8-14]。上述两类抗源的农艺性状欠佳,如苏麦3号、望水白[15-17],虽利用它们选育出一批抗性好的品种(宁7840、鄂恩1号[18]等),但因丰产性差未被大面积推广应用。【本研究切入点】长江中下游麦区有很多农艺性状较好的品种对赤霉病抗性表现中抗(moderately resistance,MR)和中感(moderately susceptible,MS),如阿夫、台湾小麦和南大2419等,实践证明,育种中可以选择抗性来源不同的抗源进行聚合杂交,实现抗性基因累加[4]。本研究供试小麦品种来自长江中下游麦区,其中改良品种是通过江苏省、安徽省、湖北省等地审定或者通过国家审定的主栽品种。近年来,绝大多数通过江苏省淮南麦区审定的小麦品种的亲本中包含扬麦158或宁麦9号,说明农艺性状优良的抗赤霉病品种更易被广泛应用于育种实践。之前很多小麦抗赤霉病种质资源筛选研究往往仅注重抗性鉴定,忽视与之关联的农艺性状的分析,不能给育种家提供全面的选择信息,无法解决当前生产上抗赤霉病与产量协调提高的问题。【拟解决的关键问题】本研究选取历年来长江中下游大面积种植的小麦品种,利用国内外公认的抗赤霉病主效基因进行分子检测,通过单花滴注接种禾谷镰刀菌鉴定筛选稳定的抗赤霉病品种,调查其株高、小穗数、穗长、穗粒数等性状,筛选农艺性状优良的抗赤霉病品种作为小麦抗赤霉病育种的亲本使用,为小麦抗赤霉病育种提供参考。
1 材料与方法
1.1 试验材料
供试材料来源于江苏省、湖北省、安徽省等地的93个小麦品种,其中,改良品种75个、地方品种18个,抗赤霉病对照品种为苏麦3号,感赤霉病对照品种为扬麦13。所有材料的来源及系谱见电子附表1和电子附表2。
抗病性鉴定所用禾谷镰刀菌菌株(F0301、F0609、F0980和F1312)由江苏省农业科学院植物保护研究所陈怀谷研究员惠赠。
1.2 试验地点及抗病鉴定圃设置
试验于2015—2016、2016—2017、2017—2018年3个小麦生长期(以下简称2016、2017和2018)在江苏里下河地区农业科学研究所湾头试验基地赤霉病鉴定圃内进行。3年播种日期均为10月28日,每品种种植2行,行长150 cm,行距25 cm,每行均匀播种30粒,土质为沙壤土,前茬为水稻,肥力中等,田间管理如施肥、除草、灌溉及虫害防治同常规育种田。
1.3 赤霉病抗性鉴定与评价
2016、2017和2018年在田间分别进行接种鉴定。参照Yu等[18]方法制备赤霉菌孢子悬浮液(1×105—5×105个/mL),采用单花滴注法接种,于小麦开花初期,用注射器吸取10 µL孢子液注入麦穗(自顶部小穗开始自上而下第6个小穗的任意一个小花中),每个品种接种30个穗子。接种后采用人工弥雾保湿(每半小时喷弥雾5 min)。
接种21 d后调查接种穗的病小穗数,计算病小穗率。病小穗率(the percentage of symptomatic spikelets,PSS)=发病小穗数(symptomatic spikelets)/总小穗数(total spikelets)×100%[19]。按照《中华人民共和国农业行业标准NY/T 2954-2016:小麦区域试验品种抗赤霉病鉴定技术规程》[20]标准调查和记载抗病情况,参考张晓军等[21]方法进行抗赤霉病评价。根据3年平均病小穗率和严重度分级,将供试品种分成抗病(resistant,简称R级,0<平均严重度<2.0,仅接种小穗发病,或相邻的个别小穗发病,但病斑不扩展到穗轴)、中抗(MR级,2.0≤平均严重度<3.0,穗轴发病,发病小穗占总小穗数的1/4以下)、中感(MS级,3.0≤平均严重度<3.5,穗轴发病,发病小穗占总小穗数的1/4—1/2)和感病(susceptible,简称S级,平均严重度≥3.5,穗轴发病,发病小穗占总小穗数的1/2以上)4个等级。
1.4 Fhb1的分子检测
选取每品种10粒种子,室温下发芽,取嫩叶放入液氮中速冻,采用SDS法提取基因组DNA,参考Su等[22]设计的功能基因KASP标记引物序列,参考Rasheed等[23]检测方法,将位点呈抗病基因型的品种简称、该位点呈感病基因型的品种简称。
1.5 农艺性状调查
2018年秋,将筛选出的3年平均病小穗率≤50%的品种种植于江苏里下河地区农业科学研究所湾头试验基地产量鉴定圃,每品种种植6行,行长150 cm,行距25 cm,每行均匀播种50粒,土质为沙壤土,前茬为水稻,肥力中等,待出苗后定苗至每行40株,田间管理如施肥、除草、灌溉及虫害防治同常规育种田。2019年待各品种成熟期收获后,随机选取每品种10个单株,调查主茎株高、每穗小穗数、穗长和穗粒数(平均值),脱粒后考察千粒重(每个品种500粒称重,3次重复,取平均值,然后转化成千粒重),计算小穗着生密度(每穗小穗数/穗长)。
1.6 表型统计分析
利用Microsoft Excel 2016对试验获得的病小穗数、病小穗率、农艺性状等数据进行方差分析、T检验和描述性统计分析。
2 结果
2.1 小麦种质资源的赤霉病抗性鉴定与评价
3年抗赤霉病接种鉴定结果表明,地方品种只有望水白赤霉病抗性达到R级,平均病小穗率为9.7%;MR—MS级的品种有5个,平均病小穗率为15.0%—39.0%;S级的品种有12个,平均病小穗率为50.2%—78.5%,其中,红卷芒感病最重,平均病小穗率为78.5%(图1和电子附表3)。
国内改良品种只有苏麦3号的赤霉病抗性达到R级,平均病小穗率为7.8%;MR—MS级的品种有60个,平均病小穗率变幅为13.2%—49.5%;S级的品种有14个,平均病小穗率变幅为53.6%—64.3%,其中,扬麦13感病最重,平均病小穗率为64.3%(图1和电子附表3)。
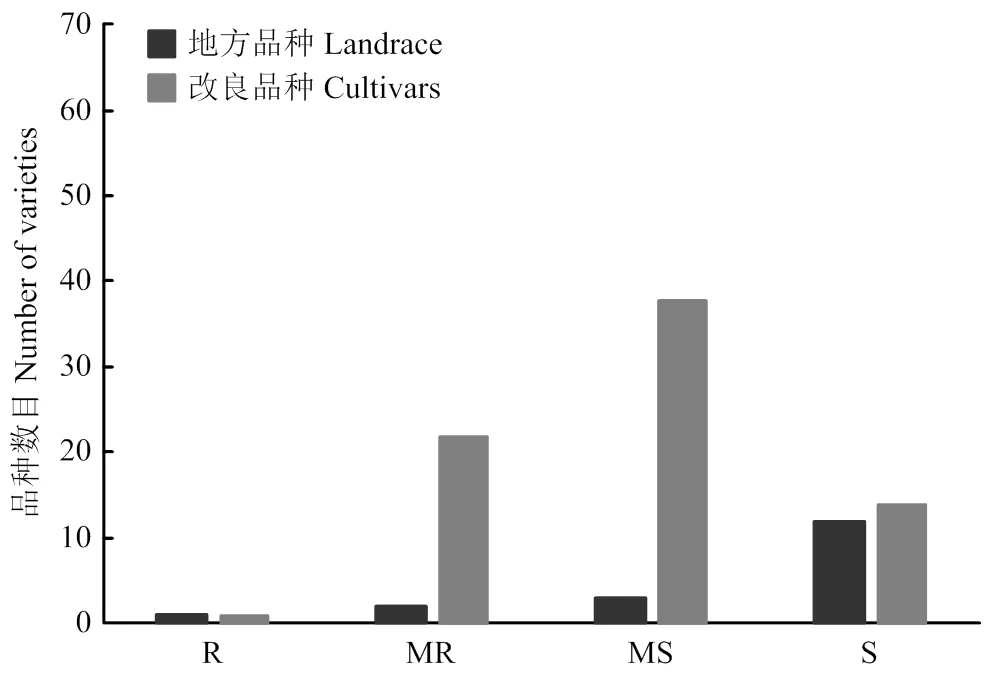
R:抗性;MR:中抗;MS:中感;S:感性
2.2 Fhb1位点分子标记检测
应用的KASP分型标记检测93个供试品种,结果表明,地方品种望水白、白慈麦、和蒲头、白蒲、胡须麦和糯麦是+,其他12个是-。改良品种苏麦3号(R)、宁麦18、扬麦18、宁麦9号、宁麦13、宁麦19、镇麦5号、宁麦26、扬麦21、扬麦28、宁麦14、苏麦5号、宁麦16、扬辐麦4号、宁麦15和浙麦1号是+,其他59个是-。统计结果表明,+与-品种平均病小穗率差异显著(<0.05)(电子附表3和图2)。总之,基因型为+品种的赤霉病抗性显著好于-,少数+品种表型为感病。
2.3 抗赤霉病品种的农艺性状分析
3年的抗赤霉病鉴定结果表明,共有67个品种的平均病小穗率≤50%,抗性达到中感及以上水平(电子附表3),其中地方品种6个,改良品种61个。2019年调查这些品种的农艺性状,利用小穗数和穗长计算小穗着生密度,结果表明,地方品种株高最大值为145.8 cm,最小值为122.6 cm,平均值为131.0 cm;穗粒数最大值为50.0粒,最小值为32.4粒,平均值为41.0粒;每穗小穗数最大为21.7个,最小为17.8个,平均值为19.1个;穗长最大值为12.7 cm,最小值为7.2 cm,平均值为10.8 cm;小穗着生密度最大值为3.0个/cm,最小值为1.4个/cm,平均值为1.9个/cm;千粒重最大值为35.5 g,最小值为26.8 g,平均值为31.5 g。改良品种株高最大值为119.6 cm,最小值为72.0 cm,平均值为86.8 cm;穗粒数最大值为50.6粒,最小值为30.9粒,平均值为43.0粒;每穗小穗数最大值为23.8个,最小值为15.7个,平均值为19.4个;穗长最大值为14.4 cm,最小值为7.9 cm,平均值为10.4 cm;小穗着生密度最大值为2.4个/cm,最小值为1.4个/cm,平均值为1.9个/cm;千粒重最大值为49.7 g,最小值为33.9 g,平均值为44.5 g(电子附表4)。

Fhb1+:Fhb1抗病等位基因;Fhb1-:Fhb1感病等位基因;*表示2种基因型间差异显著(P<0.05)
地方品种株高普遍偏高,千粒重普遍偏低,综合农艺性状差。改良品种的株高变辐范围较大,43个品种的株高小于90.0 cm,穗粒数达到或者超过45.0粒的有20个品种,其中宁麦19、扬麦29、扬麦16、扬麦23、扬糯麦1号、镇麦1号、扬麦20、宁麦12和扬辐麦4号的千粒重达到或者高于45.0 g(电子附表4),综合分析67个赤霉病中感及以上水平品种的主要农艺性状表现,认为宁麦19、扬麦29、扬麦16、扬麦23、扬糯麦1号、扬麦20、宁麦12和扬辐麦4号的综合农艺性状优良,穗粒数和千粒重表现突出(表1)。
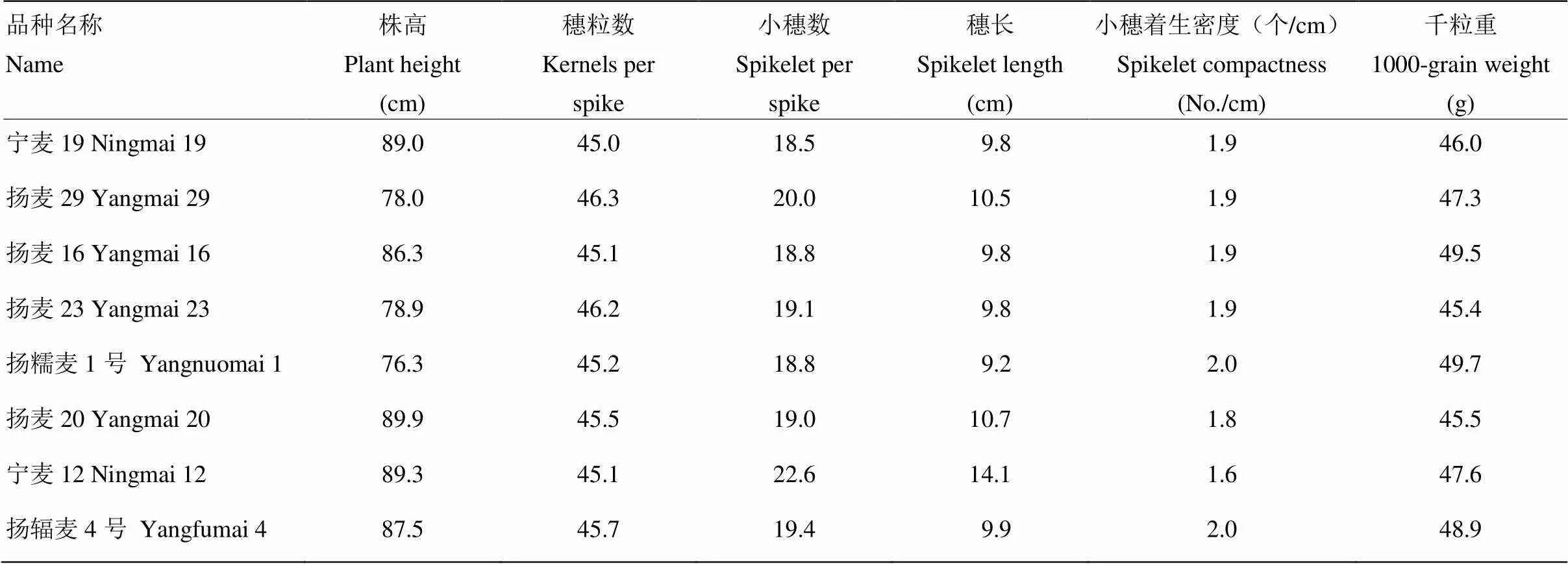
表1 综合农艺性状优良且赤霉病抗性达到中感赤霉病及以上水平的品种
3 讨论
3.1 抗赤霉病优异种质资源筛选
小麦赤霉病抗性由多基因控制,抗赤霉病QTL除具有加性效应外,也存在上位性效应[6]。本研究经过连续3年单花滴注抗赤霉病鉴定,筛选出67个赤霉病抗性达到中感及以上水平的品种,平均病小穗率为7.8%—49.5%,其中,望水白和苏麦3号分别是地方品种和改良品种中唯一的赤霉病抗性达到R级的品种,说明小麦R级抗赤霉病的种质资源十分稀少,在抗赤霉病遗传改良中搜集此类抗源较困难。已有研究[24-25]表明品种赤霉病抗性达到中抗至中感级的抗性一般受多基因控制,抗性稳定,可被广泛利用。程顺和等[26]提出抗赤霉病育种的第2条技术路线,即选用丰产、抗赤性中感至中抗品种(系)杂交,后代注重丰产,兼顾抗赤霉病等性状选择,可育成大面积推广种植的中抗赤霉病品种。地方品种株高普遍偏高、千粒重普遍较低(电子附表4),即使赤霉病抗性很好,也不利于小麦抗赤霉病育种直接利用,而改良品种的株高、千粒重等农艺性状较地方品种优良很多,利于生产上小麦抗赤霉病育种直接利用。以往研究表明,长江中下游小麦产量育种的策略是增加粒数、提高粒重为主[27],因此,每穗粒数和千粒重的选择是决定该麦区小麦产量的关键因素。本研究表明宁麦19、扬麦29、扬麦16、扬麦23、扬糯麦1号、扬麦20、宁麦12和扬辐麦4号的综合农艺性状优良,穗粒数和千粒重表现突出,可作为抗赤霉病育种的亲本选用。
3.2 不同Fhb1基因型在供试品种中的分布
已知苏麦3号是国际上研究和利用最广泛的赤霉病抗源[6],其携带的抗赤霉病主效基因已经被克隆[28-29],有研究表明[30-31],不同来源的抗病基因(供体),导入受体后赤霉病抗性表现差异显著,即使携带同一供体抗病基因的材料在不同遗传背景下抗性也表现不同。朱展望等[32]通过基因检测和系谱分析发现,中国小麦改良品种所含至少有2个来源,分别为苏麦3号和宁麦9号,并以后者为主。对本研究供试材料中改良品种系谱分析表明宁麦18、扬麦18、宁麦9号、宁麦13、宁麦19、镇麦5号、宁麦26、扬麦21、扬麦28、宁麦14、苏麦5号、宁麦16、扬辐麦4号和宁麦15等14个品种中的抗病基因来源于宁麦9号(电子附表2)。
本研究筛选出67个赤霉病抗性在中感及以上水平品种,分子标记检测表明+品种有18个,占26.9%:其中6个地方品种中共有3个携带抗病基因,占50%,分别是望水白、和蒲头和白慈麦;61个改良品种中共有15个携带抗病基因,占24.2%,说明有一定数量的中感及以上水平的品种并不携有抗病基因,在这些不携带抗病基因的品种中有17个赤霉病抗性达到中抗,这是一些非常宝贵的抗赤霉病种质资源,可通过配制双亲群体,挖掘新的抗赤霉病基因。
抗性评价为S级的品种中白蒲、胡须麦、糯麦和浙麦1号也携有来源尚不清楚的抗病基因,推测这些感病品种中可能与其他基因存在互作效应,导致品种赤霉病抗性改变或者降低。
3.3 扬麦系列品种的应用价值
已有报道表明,利用抗赤霉病基因/QTL进行抗病育种时,由于基因间的连锁而导入一些不利基因,从而导致某些农艺性状变差[33-34],而Li等[35]分别以宁麦9号、宁麦13和建阳84为抗病基因供体,以黄淮冬麦区小麦品种为背景,构建6个回交群体,分别考察这6个群体中携带纯合抗病基因型()、纯合感病基因型()和杂合基因型()的株高、穗长、每穗小穗数和千粒重等农艺性状考察,发现没有显著的差异,这可能是育种过程中不断选择的结果,也可能跟特定的遗传背景表达有关。
本研究供试品种中扬麦系列品种的平均病小穗率为13.2%—64.3%,86%的扬麦系列品种赤霉病抗性达到中抗—中感水平,其中10个赤霉病抗性达到中抗,平均病小穗率为13.2%—25.0%;15个赤霉病抗性达到中感,平均病小穗率为26.0%—40.8%;4个感赤霉病,平均病小穗率为53.6%—64.3%。考察67份赤霉病达到中感及以上水平品种的主要农艺性状,结果表明,8个品种的综合农艺性状优良,穗粒数和千粒重表现突出,可作为抗赤霉病育种的亲本选用,其中扬麦系列品种有6份,且只有扬辐麦4号含有抗病基因。蒋正宁等[36]利用已知3个抗扩展QTL(、和)的7个分子标记对202份扬麦品种(系)进行分子检测,结果表明,扬麦品种(系)所含赤霉病抗扩展基因至少有2个来源,其一为含有抗病基因的品种,以扬麦18、扬麦21和扬麦28等为代表,其抗源主要来自宁麦9号或其衍生品种;其二为不含有抗病基因的品种,以扬麦14、扬麦16、扬麦17和扬麦23等为代表,推测这类品种所含抗性基因来自扬麦158。胡文静等[3]研究表明,扬麦16中携带抗赤霉病位点、、和,表型贡献率为8.8%—15.0%,其中与已报道的Wuhan-1中检测到的2DL上抗赤霉病位点位置相近,Zhu等[37]利用小麦90K SNP芯片对240份国内外品种进行抗赤霉病全基因组关联分析,在19个扬麦品种(系)里检测到位点抗性等位变异,且证实与Wuhan-1的位点是一致的。Jiang等[38]利用扬麦158/宁麦9号的RIL群体定位到来源于扬麦158的抗赤霉病位点和来源于宁麦9号的,且后代中同时具有2个位点的家系赤霉病抗性显著高于亲本。Hu等[39]通过全基因组关联分析在染色体4A和5D上检测到来源于扬麦衍生系苏麦6号、镇麦168和镇麦9号的抗赤霉病优异单倍型。经过系谱分析推测扬麦抗赤霉病基因来源于最原始的亲本之一阿夫(电子附表2)。下一步将精细定位扬麦中携带的抗赤霉病主效QTL,开发利于抗赤霉病育种的分子标记,评鉴它们的抗赤霉病效应和对产量等性状的影响,解析在不同遗传背景下的效应,明确其最优组合及育种应用价值;同时,继续将已知抗病基因导入长江中下游大面积主栽品种中,在保持优良农艺性状的基础上,聚合多个抗赤霉病基因,进一步提升小麦品种的赤霉病抗性水平。
4 结论
除苏麦3号和望水白外,供试材料中未发现其他高抗赤霉病的种质资源,赤霉病抗性达到中感及以上水平的品种有67个,这些品种中仅26.9%携带抗病基因。最终筛选得到的赤霉病抗性与综合农艺性状结合较好的小麦品种以扬麦品种为主,其中只有扬辐麦4号携带抗病基因,说明利用抗病基因并不是解决小麦赤霉病危害的唯一途径。
[1] 王荣栋, 尹经章. 作物栽培学. 北京: 高等教育出版社, 2005: 4.
WANG R D, YIN J Z.. Beijing: Higher Education Press, 2005: 4. (in Chinese)
[2] 吴佳文, 杨荣明, 朱凤, 田子华. 2015年江苏省小麦赤霉病发生特点与防控对策探讨. 中国植保导刊, 2016, 36(10): 31-34.
WU J W, YANG R M, ZHU F, TIAN Z H. The epidemic characteristics of wheathead blight in Jiangsu Province in 2015 and discussion of its control measures., 2016, 36(10): 31-34. (in Chinese)
[3] 胡文静, 张勇, 陆成彬, 王凤菊, 刘金栋, 蒋正宁, 王金平, 朱展望, 徐小婷, 郝元峰, 何中虎, 高德荣. 小麦品种扬麦16赤霉病抗扩展QTL定位及分析. 作物学报, 2020, 46(2): 157-165.
HU W J, ZHANG Y, LU C B, WANG F J, LIU J D, JIANG Z N, WANG J P, ZHU Z W, XU X T, HAO Y F, HE Z H, GAO D R. Mapping and genetic analysis of QTLs forhead blight resistance to disease spread in Yangmai 16., 2020, 46(2): 157-165. (in Chinese)
[4] 陆维忠, 程顺和, 王裕中. 小麦赤霉病研究. 北京: 科学出版社,2001: 45-76.
LU W Z, CHENG S H, WANG Y Z.. Beijing:Science Press, 2001: 45-76. (in Chinese)
[5] 丛雯雯, 郭长虹. 小麦近缘野生植物的赤霉病抗源筛选及其利用. 分子植物育种, 2010, 8(5): 1043-1049.
CONG W W, GUO C H. Selection and utilization of resistance sources tohead bight in wheat wild relatives., 2010, 8(5): 1043-1049. (in Chinese)
[6] 张爱民, 阳文龙, 李欣, 孙家柱. 小麦抗赤霉病研究现状与展望. 遗传, 2018, 40(10): 858-873.
ZHANG A M, YANG W L, LI X, SUN J Z. Current status and perspective on research againsthead blight in wheat., 2018, 40(10): 858-873. (in Chinese)
[7] MCCARTNEY C A, SOMERS D J, FEDAK G, CAO W. Haplotype diversity athead blight resistance QTLs in wheat., 2004, 109: 261-271.
[8] 陈佩度, 王兆悌, 王苏玲, 黄俐, 王裕中, 刘大钧. 将大赖草种质转移给普通小麦的研究: III. 抗赤霉病异附加系选育. 遗传学报, 1995, 22: 206-210.
CHEN P D, WANG Z T, WANG S L, HUANG L, WANG Y Z, LIU D J. Transfer of useful germplasm fromLam. to common wheat: III. Development of addition lines with wheat scab resistance., 1995, 22: 206-210. (in Chinese)
[9] CAI X, CHEN P D, XU S S, OLIVER R E, CHEN X. Utilization of alien genes to enhancehead blight resistance in wheat-A review., 2005, 142(3): 309-318.
[10] LIU S, HALL M D, GRIFFEY C A, MCKENDRY A L. Meta-analysis of QTL associated withhead blight resistance in wheat., 2009, 49: 1955-1968.
[11] 陈士强, 黄泽峰, 张勇. 中国春背景下长穗偃麦草抗赤霉病相关基因的染色体定位. 麦类作物学报, 2012, 32(5): 839-845.
CHEN S Q, HUANG Z F, ZHANG Y. Chromosomal location of the genes associated with FHB resistance ofin Chinese Spring Background., 2012, 32(5): 839-845. (in Chinese)
[12] DAI Y, DUAN Y M, LIU H P, CHI D, CAO W G, XUE A, GAO Y, FEDAK G, CHEN J M. Molecular cytogenetic characterization of twotrigeneric hybrids exhibiting superior resistance tohead blight, leaf rust, and stem rust race Ug99., 2017, 8: 797.
[13] GUO J, ZHANG X, HOU Y, CAI J, SHEN X, ZHOU T, XU H, OHM H W, WANG H, LI A, WANG H, KONG L. High-density mapping of the major FHB resistance gene Fhb7 derived fromand its pyramiding withby marker-assisted selection., 2015, 128: 1-16.
[14] CAINONG J C, BOCKUS W W, FENG Y, ET A L. Chromosome engineering, mapping, and transferring of resistance tohead blight disease frominto wheat., 2015, 128(6): 1019-1027.
[15] RAWAT N, PUMPHREY M O, LIU S, ZHANG X, TIWARI V K, ANDO K, TRICK H N, BOCKUS W W, AKHUNOV E, ANDERSON J A, GILL B S. Wheatencodes a chimeric lectin with agglutinin domains and a pore-forming toxin-like domain conferring resistance tohead blight., 2016, 48(12): 1576-1580.
[16] SU Z, BERNARDO A, TIAN B, CHEN H, WANG S, MA H, CAI S, LIU D, ZHANG D, LI T, TRICK H, ST AMAND P, YU J, ZHANG Z, BAI G. A deletion mutation in TaHRC confersresistance tohead blight in wheat., 2019, 51(7): 1099-1105.
[17] LI G, ZHOU J, JIA H, GAO Z, FAN M, LUO Y, ZHAO P, XUE S, LI N, YUAN Y, MA S, KONG Z, JIA L, AN X, JIANG G, LIU W, CAO W, ZHANG R, FAN J, XU X, LIU Y, KONG Q, ZHENG S, WANG Y, QIN B, CAO S, DING Y, SHI J, YAN H, WANG X, RAN C, MA Z. Mutation of a histidine-rich calcium-binding-protein gene in wheat confers resistance tohead blight., 2019, 51(7):1106-1112.
[18] YU J B, BAI G H, CAI S B, BAN T. Marker-assisted characterization of Asian wheat lines for resistance tohead blight., 2006, 113: 308-320.
[19] LI T, LUO M, ZHANG D, WU D, LI L, BAI G H. Effective marker alleles associated with type II resistance of wheat tohead blight infection in field., 2016, 66(3): 350-357.
[20] 中华人民共和国农业行业标准 NY/T 2954-2016: 小麦区域试验品种抗赤霉病鉴定技术规程.
Agricultural Standard of the People’s Republic of China, NY/T 2954-2016: Technical regulations for resistance evaluation of wheat for trials tohead blight caused bygraminearum Schw. (in Chinese)
[21] 张晓军, 肖进, 王海燕, 乔麟轶, 李欣, 郭慧娟, 常利芳, 张树伟, 阎晓涛, 畅志坚, 武宗信. 小偃麦衍生品系的赤霉病抗性评价. 作物学报, 2020, 46(1): 62-73.
ZHANG X J, XIAO J, WANG H Y, QIAO L Y, LI X, GUO H J, CHANG L F, ZHANG S W, YAN X T, CHANG Z J, WU Z X. Evaluation of resistance tohead blight in- derived wheat lines., 2020, 46(1): 62-73. (in Chinese)
[22] SU Z Q, JIN S J, ZHANG D D, Bai G H. Development and validation of diagnostic markers forregion, a major QTL forhead blight resistance in wheat., 2018, 131(11): 2371-2380.
[23] RASHEED A, WEN W, GAO F M, ZHAI S, JIN H, LIU J D, GUO Q, ZHANG Y J, DREISIGACKER S, XIA X C, HE Z H Development and validation of KASP assays for functional genes underpinning keyeconomic traits in wheat., 2016, 129: 1843-1860.
[24] 吕超, 姚琴, 宋彦霞, 周荣华, 许如根, 贾继增. 偃展1号×内乡188群体抗小麦赤霉病QTL分析. 麦类作物学报, 2014, 34(12): 1633-1638.
Lü C, YAO Q, SONG Y X, ZHOU R H, XU R G, JIA J Z. QTL analysis forhead blight (FHB) resistance in RIL population from Yanzhan1×Neixiang188., 2014, 34(12): 1633-1638. (in Chinese)
[25] Yi X, Cheng J Y, Jiang Z N, Hu W J, Bie T D, Gao D R, Li D S, Wu R L, Li Y L, Chen S L, CHENG X M, LIU J, ZHANG Y, CHENG S H. Genetic analysis ofhead blight resistance in CIMMYT bread wheat line C615 using traditional and conditional QTL mapping., 2018, 9: 573.
[26] 程顺和, 张勇, 张伯桥, 高德荣, 吴宏亚, 陆成彬, 吕国锋, 王朝顺. 小麦抗赤霉病育种2条技术路线的探讨. 扬州大学学报(农业与生命科学版), 2003, 24(1): 59-62.
CHENG S H, ZHANG Y, ZHANG B Q, GAO D R, WU H Y, LU C B, Lü G F, WANG C S. Discussion of two ways of breeding scab resistance in wheat., 2003, 24(1): 59-62. (in Chinese)
[27] 姚国才, 马鸿翔, 姚金保, 张鹏, 杨学明. 长江中下游地区小麦产量育种方向及策略探讨. 中国农学通报, 2010, 26 (17): 168-171.
YAO G C, MA H X, YAO J B, ZHANG P, YANG X M. The breeding strategies and direction on wheat yield in region of middle and lower reaches of the Yangtze river., 2010, 26 (17): 168-171. (in Chinese)
[28] SU Z Q, BERNARDO A, TIAN B, CHEN H, WANG S, MA H X, CAI S B, LIU D T, ZHANG D D, LI T, TRICK H, ST A P, YU J M, ZHANG Z Y, Bai G H. A deletion mutation inconfersresistance tohead blight in wheat., 2019, 51(7): 1099-1105.
[29] LI G Q, ZHOU J Y, JIA H Y, GAO Z X, FAN M, LUO Y J, ZHAO P T, XUE S L, LI N, YUAN Y, MA S W, KONG Z X, JIA L, AN X, JIANG G, LIU W X, CAO W J, ZHANG R R, FAN J C, XU X W, LIU Y F, KONG Q Q, ZHENG S H, WANG Y, QIN B, CAO S Y, DING Y X, SHI J X, YAN H S, WANG X, RAN C F, MA Z Q. Mutation of a histidine-rich calcium-binding-protein gene in wheat confers resistance tohead blight., 2019, 51(7): 1106-1112.
[30] 张宏军, 宿振起, 柏贵华, 张旭, 马鸿翔, 李腾, 邓云, 买春艳, 于立强, 刘宏伟, 杨丽, 李洪杰, 周阳. 利用基因功能标记选择提高黄淮冬麦区小麦品种对赤霉病的抗性. 作物学报, 2018, 44(4): 505-511.
ZHANG H J, SU Z Q, BAI G H, ZHANG X, MA H X, LI T, DENG Y, MAI C Y, YU L Q, LIU H W, YANG L, LI H J, ZHOU Y. Improvement of resistance of wheat cultivars tohead hlight in the Yellow-Huai rivers Valley winter wheat zone with functional marker selection ofgene., 2018, 44(4): 505-511. (in Chinese)
[31] 李腾.基因对黄淮冬麦区小麦品种赤霉病抗性和主要农艺性状的影响[D]. 北京: 中国农业科学研究院, 2019.
LI T. Effects of thegene onhead blight resistance and agronomic traits performances in the wheat cultivars adapted to the Yellow-Huai river valley winter wheat zone[D]. Beijing: Chinese Academy of Agriculture Sciences, 2019. (in Chinese)
[32] 朱展望, 徐登安, 程顺和, 高春保, 夏先春, 郝元峰, 何中虎. 中国小麦品种抗赤霉病基因的鉴定与溯源. 作物学报, 2018, 44(4): 473-482.
ZHU Z W, XU D A, CHENG S H, GAO C B, XIA X C, HAO Y F, HE Z H. Characterization ofhead blight resistance geneand its putative ancestor in Chinese wheat germplasm., 2018, 44(4): 473-482. (in Chinese)
[33] ZHANG J B, LI H P, DANG F J, QU B, XU Y B, ZHAO C S, LIAO Y C. Determination of the trichothecene mycotoxin chemotypes and associated geographical distribution and phylogenetic species of thegraminearum clade from China., 2007, 111(8): 967-975.
[34] KHAN M R, DOOHAN F M. Comparison of the efficacy of chitosan with that of a fluorescent pseudomonad for the control ofhead blight disease of cereals and associated mycotoxin contamination of grain., 2009, 48(1): 48-54.
[35] LI T, ZHANG H J HUANG Y W, SU Z Q, DENG Y, LIU H W, MAI C Y, YU G J, LI H L, YU L Q, ZHU T Q, YANG L, LI H J, ZHOU Y. Effects of thegene onhead blight resistance and agronomic traits of winter wheat., 2019, 7(6): 799-808.
[36] 蒋正宁, 吕国锋, 王玲, 陈甜甜, 江伟, 李东升, 高德荣, 张勇. 扬麦品种(系)赤霉病抗扩展基因分子检测及其抗性评价. 麦类作物学报, 2019, 39(12): 1406-1415.
JIANG Z N, Lü G F, WANG L, CHEN T T, JIANG W, LI D S, GAO D R, ZHANG Y. Evaluation ofhead blight resistance and molecular detection of typeⅡresistance genes for Yangmai wheat cultivars (lines)., 2019, 39(12): 1406-1415. (in Chinese)
[37] ZHU Z W, CHEN L, ZHANG W, YANG L J, ZHU W W, LI J H, LIU Y K, TONG H W, FU L P, LIU J D, RASHEED A, XIA X C, HE Z H, HAO Y F, GAO C B. Genome-wide association analysis ofhead blight resistance in Chinese elite wheat lines., 2020, 11: 206.
[38] JIANG P, ZHANG X, WU L, HE Y, ZHUANG W W, CHENG X X, GE W Y, MA H X, KONG L R. A novel QTL on chromosome 5AL of Yangmai 158 increases resistance tohead blight in wheat.,2019, 69(2): 249-258.
[39] HU W J, GAO D R, WU H Y, Liu J, ZHANG C M, WANG J C, JIANG Z N, LIU Y Y, LI D S, ZHANG Y, LU C B. Genome-wide association mapping revealed syntenic lociandforhead blight resistance in common wheat (L.).,2020, 20: 29.
Screening for Resistance toHead Blight and Agronomic Traits of Wheat Germplasms from Yangtze River Region
HU WenJing1,2,3, ZHANG ChunMei1, WU Di1, LU ChengBin1, DONG YaChao3, CHENG XiaoMing1, ZHANG Yong1, GAO DeRong1,2
(1Lixiahe Institute of Agriculture Sciences/Key Laboratory of Wheat Biology and Genetic Improvement for Low & Middle Yangtze Valley, Ministry of Agriculture and Rural Affairs, Yangzhou 225007, Jiangsu;2Jiangsu Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, Jiangsu;3Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081)
【】head blight seriously damages the grain yield and quality in China as well as in the world. Breeding and cultivating resistant varieties is the most economical, effective and safe method to combat this disease. A prominent geneconferring stable FHB resistance with the major phenotypic has been the major source of resistance in wheat breeding. The aim of this study was to screen for resistant varieties with excellent agronomic traits and evaluate the effects ofon FHB resistance under different genetic backgrounds, so as to provide theoretical basis and material source for wheat FHB resistance breeding. 【】75 cultivars and 18 landraces which have been widely planted in Yangtze river region over the years were selected to evaluate their FHB response using point inoculation from 2016 to 2018. The tested varieties were classified into four classes based on the average percentage of scabbed spikelets (PSS) for FHB severity, i.e. resistant (R), moderately resistant (MR), moderately susceptible (MS) and susceptible (S). KASP diagnostic markers forwere used to genotype the tested varieties. In 2019 we investigated the agronomical characteristics such as plant height, kernels per spike and spikelet per spike of the varietieswith ≤50% of PSS. 【】The results showed that there were 2 varieties with PSS of 7.8%-9.7%( R), 65 varieties with PSS of 13.2%-49.5% (MR-MS), and 26 varieties with PSS of 53.6%-78.5% (S). 22 varieties carriedresistant allele (+), 71 carried thesusceptible allele (-) and the average PSS of the+ was significantly lower than that of the(<0.05). There were 67 varieties showed an average PSS≤50%, of which Ningmai 19, Yangmai 29, Yangmai 16, Yangmai 23, Yangnuomai 1, Yangmai 20, Ningmai 12 and Yangfumai 4 could be used as FHB resistance donors in breeding, due to the combination of good FHB resistance and agronomic traits.【】No variety with R were identified in this study except Sumai 3 and Wangshuibai. Some Yangmai varieties exhibited both good FHB resistance and comprehensive agronomic traits, of which only Yangfumai 4 carried theresistance gene. Utilizingis not the only way to combat FHB, and more FHB-resistant germplasms and new FHB-resistant genes should be studied and applied in breeding programs.
wheat;head blight; resistance to disease spread;resistance gene; germplasms; agronomic traits

10.3864/j.issn.0578-1752.2020.21.001
2020-01-06;
2020-04-20
国家重点研发计划(2017YFD0100801,2016YFD0101802)、国家自然科学基金(31901544)、国家现代农业产业技术体系建设专项(CARS-03-03B,CARS-3-2-11)、江苏省现代农业重点项目(BE2017340)、江苏省重点研发计划(BE2018350)、江苏省自然科学基金(BK20171279)
胡文静,E-mail:huren2008@126.com。通信作者张勇,E-mail:zy@wheat.org.cn
(责任编辑 李莉)
