不同LED光谱对马铃薯组培苗生长和内源激素变化的影响
2020-11-09陈丽丽王浩瑛宫晓晨薛绪掌胡跃高
陈丽丽,王浩瑛,宫晓晨,薛绪掌,胡跃高*
(1.宁波大学科学技术学院,浙江 宁波 315300;2.中国农业大学农学院,北京 100193;3.北京农业智能装备研究中心,北京 100097)
马铃薯是继水稻、玉米、小麦之后的第四大粮食作物[1],在保障粮食安全,改善膳食结构,帮助农民致富方面起着重要作用。生产上,推广使用合格种薯是保障马铃薯增产稳产的重要措施[2]。马铃薯组培苗是生产马铃薯种薯的基础[3]。光源是调控马铃薯组培苗生长发育的重要环境因素之一[4]。研究表明红光处理30 d 的马铃薯组培苗细长柔弱,叶片薄而小;蓝光处理下则表现出茎秆粗矮,叶色黑绿,叶片大而肥厚[5]。电镜观察表明红光处理后组织细胞大,而蓝光处理后的则短小[6]。单侧蓝光照射强烈引起马铃薯组培苗单节茎段90℃向光弯曲[7]。红光和远红光照射促进马铃薯组培苗腋芽的长出[8]。红蓝光3∶1组合光谱提高了马铃薯组培苗中碳水化合物和蛋白质等物质积累[9]。红蓝组合光谱中增加一定绿光,通过改善生理指标和叶片解剖学结构有利于培养健壮的马铃薯组培苗[10]。上述研究重点关注了不同光质处理结束后,马铃薯组培苗最终的形态、生理生化等特性,而不同光质对马铃薯组培苗不同时期生长和内源激素含量的影响尚未见报道。
光是影响植物生长发育的重要环境因素之一。植物通过调整其形态和生理生长以适应不同光环境[11]。植物激素是调控植物生命活动的重要信号分子;光依赖的植物形态改变是受植物激素调节的[12]。远红光通过影响生长素和赤霉素的比例,调控大豆的生长形态及生物量分配[13]。红光通过协同调控西瓜苗内源水杨酸和茉莉酸激素信号-增强了植株的抗病性[14]。不同光质通过改变内源细胞分裂素、生长素和赤霉素含量进而影响夏玉米籽粒的形态特征[15]。紫外光谱通过调节内源赤霉素代谢及其信号传导途径抑制豌豆茎节伸长和叶片扩展[16]。在水稻幼苗上荫蔽现象引起的茎秆伸长也受内源激素调控[17]。本试验通过设置不同波长LED光源及其组合,对马铃薯组培苗生产中的照明光源进行调控,在组培苗生长关键时期进行取样,分别测定各器官内源细胞分裂素、生长素、脱落酸和赤霉素的含量,分析不同LED光源对马铃薯组培苗内源激素含量的影响,从激素调控水平阐明LED光源对马铃薯组培苗形态生长的影响机制,以期为马铃薯组培苗扩繁中人工光源选择提供理论指导。
1 材料与方法
1.1 试验材料
供试马铃薯品种为早熟品种‘中薯4号’,脱毒马铃薯组培苗由中国农业科学院蔬菜花卉研究所马铃薯良种繁育中心提供。试验前继代培养足够的马铃薯组培苗用于光处理。
1.2 试验条件与光处理装置
试验在中国农业大学农学院南平房组培室内进行,温度控制在(23 ± 3)℃,光照时间为16 h 光照(6∶00~22∶00)8 h黑暗,湿度为(75 ± 5)%,总光合有效辐射强度为100 μmol/m2·s,由Li-CO 250 A光照计测定(美国LI-COR公司)。试验采用无任何激素添加的MS 培养基,pH 5.8,每组培瓶(350 mL)(北京易生组培公司)分装50 mL培养基在121℃下于高压锅内灭菌15 min。在超净工作台内,用组培剪剪下具有一叶的马铃薯组培苗单节茎段(长15 mm)作为外植体,垂直接种至灭菌凝固后的组培瓶内,每瓶均匀接种12~15 个外植体,每个处理接种15瓶,置于光处理下培养4周。
试验以白光作为对照(CK),设5个光质处理:100%红光(RR),100%蓝光(BB),100%绿光(GG),65%红光+35%蓝光(RB),45%红光+35%蓝光+20%绿光(RBG)。试验所用均为LED灯管(惠州可道有限公司)。试验LED光谱特征如表1所示。
1.3 测定项目与方法
马铃薯单节茎段在上述光处理装置内培养28 d,每7 d测定1次生长和激素含量指标,共测定4次,每次分别测定根、茎和叶3个器官的指标。
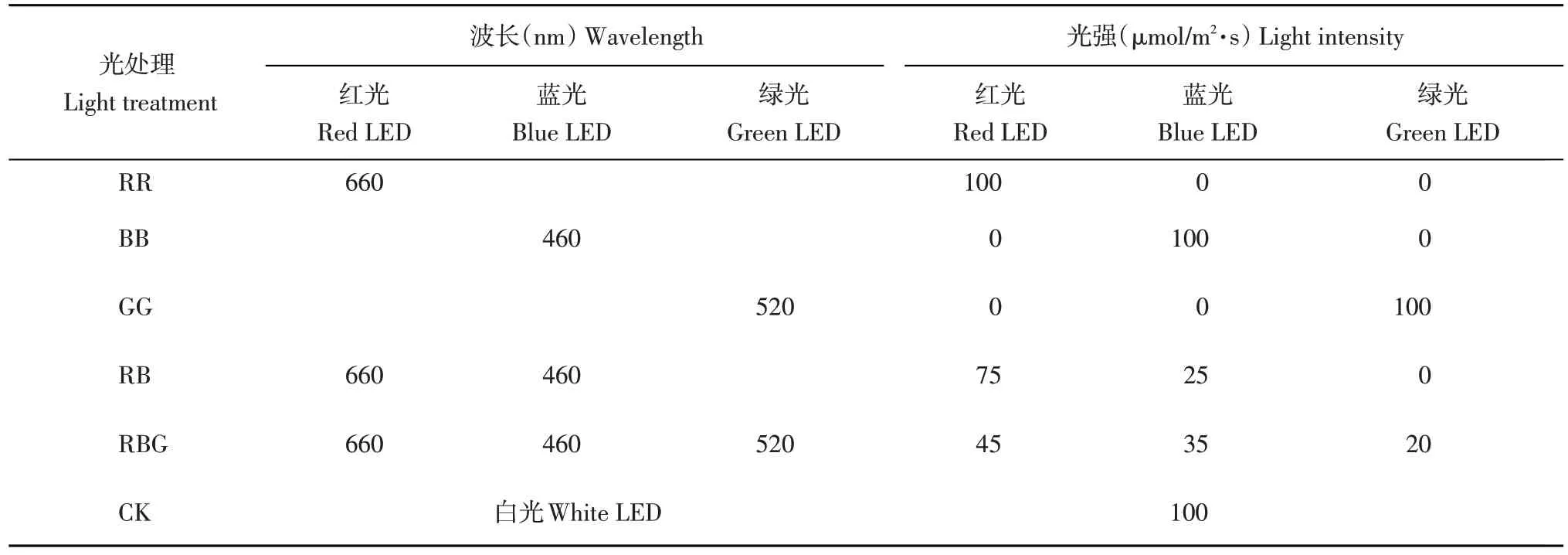
表1 LED光谱特征Table 1 Characteristics of LED light spectrum
生长指标测定:各处理随机选取15株苗(即各处理随机选取5瓶,每瓶中随机选取长势一致的3株苗)用来测定茎长(自茎基部至茎节生长点的长度)、茎粗(测幼苗中间部位的茎粗),株鲜重,将幼苗放在75℃下进行烘干至恒重称量其干重。用Epson Scanner(日本爱普生公司)扫描仪扫描洗干净的根系,用WinRHIZO(加拿大Regent公司)软件对扫描图片进行分析获得根系总长度、体积和直径指标。用相同的方法获得叶片的投影面积作为叶片面积。
激素含量测定:各处理每次分别选取15 株苗(即各处理随机选取5瓶,每瓶中随机选取长势一致的3株苗),将根部培养基清洗干净,从中取0.5 g左右根、茎和叶鲜样,用锡箔纸包好,立即放入液氮中速冻,随后置于-80℃冰箱中备用。待样品全部收集完,用酶联免疫法[18]测定赤霉素(Gibberellins,GAs)、吲哚乙酸(Indoleacetic acid,IAA)、脱落酸(Abscisic acid,ABA)、细胞分裂素异戊烯基腺苷(Isopentenyl adenosine,IPA)、玉米素核苷(Zeatin Riboside,ZR)和双氢玉米素核苷(Dihydrozeatin riboside,DHZR)的含量。
1.4 数据分析
试验数据用SPSS 23.0 统计软件进行方差分析(Student's t test,P<0.05),用SigmaPlot 12.5软件作图。图表中数据均为平均值±标准差。
2 结果与分析
2.1 LED光谱对马铃薯组培苗生长的影响
由表2可知,与CK相比,组合光谱RB和RBG处理并未显著(P>0.05)改变不同苗龄马铃薯组培苗的生长指标,但RB和RBG处理4周后的马铃薯组培苗在植株鲜重、茎粗、根直径、叶面积、茎长和根表面积上均高于对照CK。在第1周光处理结束后,单色红光(RR)和单色绿光(GG)处理较CK、RB 和RBG处理显著(P<0.05)提高马铃薯组培苗的单株鲜重、叶片数、茎长和节间数;光处理持续至第2周结束时,RR 和GG 处理在单株鲜重和叶片数上与CK、RB和RBG无显著(P>0.05)差异,在叶面积上开始表现出显著(P<0.05)低于CK和BB处理;在茎长上RR和GG处理始终显著(P<0.05)高于CK、RB和RBG处理;在茎长和节间数方面,RR和GG处理下的马铃薯组培苗高于同一生长时期的CK、RB和RBG处理的组培苗。在整个培养过程中,单色蓝光(BB)处理下,马铃薯组培苗的茎长、节间数始终显著(P<0.05)低于CK、RB和RBG处理,但BB处理下组培苗的茎粗始终保持最大值,且显著(P<0.05)高于RR和GG处理。在整个培养过程中BB处理下根直径始终最高(除第1周外),相反GG处理下的根直径和根表面积始终显著(P<0.05)低于CK;RB和RBG处理下根系的生长指标与CK无显著(P>0.05)差异;红光处理下的根系生长指标在根直径上与CK、RB和RBG处理在各生长阶段均未表现出显著差异(P>0.05),但第4周处理结束后其根系总面积要显著(P<0.05)高于CK。与白光相比,单色光显著改变马铃薯组培苗的形态生长:蓝光下马铃薯组培苗叶片大且叶色浓绿、茎干粗矮壮实,红绿光下则叶片小茎秆柔弱细长;红蓝和红蓝绿组合光谱均较对照提高马铃薯组培苗茎长和茎粗等生长指标,虽未达到显著水平,但一定程度上利于培养壮苗。
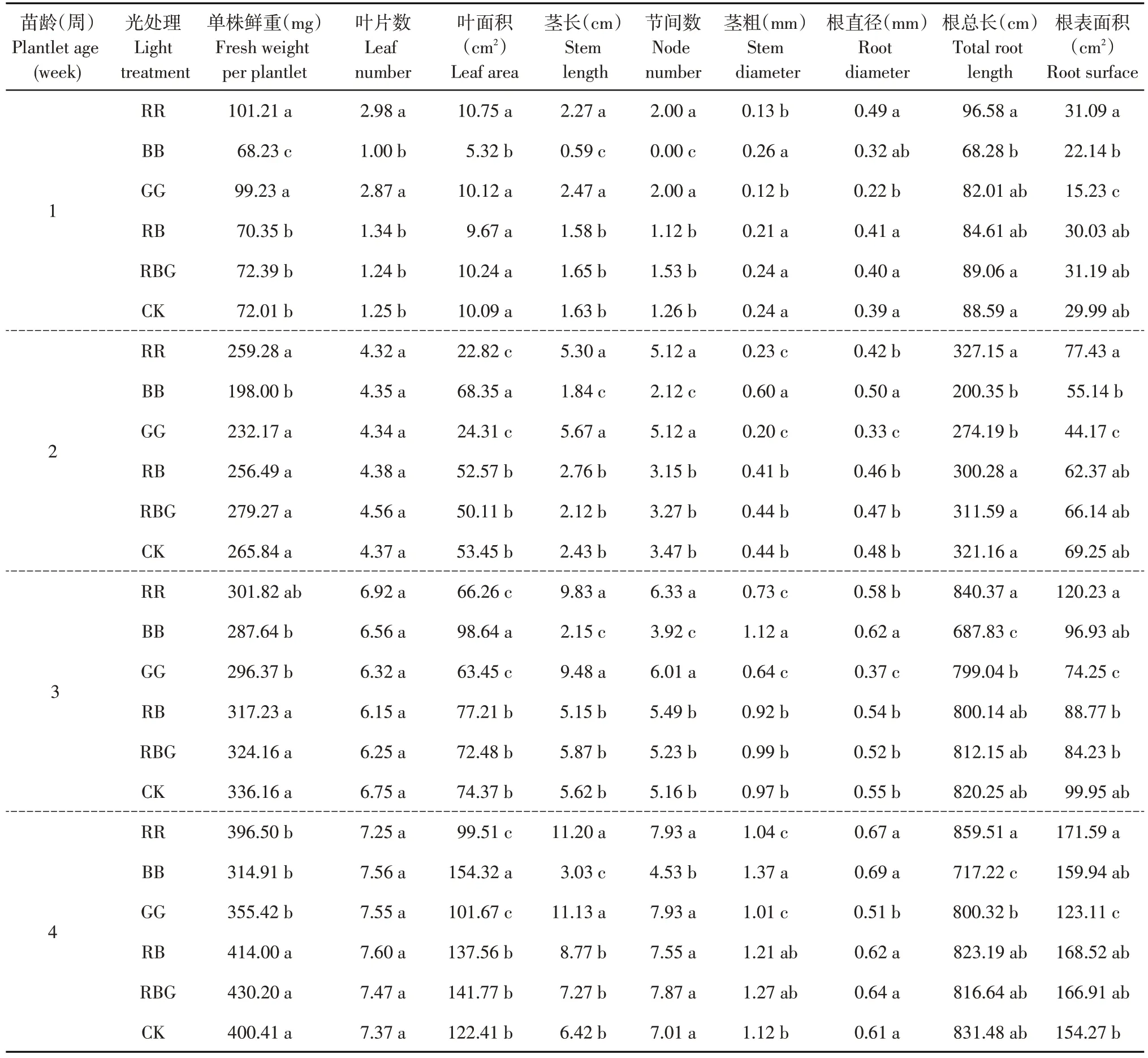
表2 LED光谱对马铃薯组培苗生长的影响Table 2 Effect of LED light spectrum on growth of potato plantlets cultured in vitro
2.2 LED 光谱对马铃薯组培苗各器官内源激素含量的影响
2.2.1 LED光谱对马铃薯组培苗根系内源激素含量的影响
如图1a所示,各处理下,马铃薯组培苗根系内源ABA含量呈现先升高再降低的趋势;RR处理下ABA 含量始终最高,GG 处理下始终最低,RB、RBG和CK处理居中。各处理下,马铃薯组培苗根系内源IAA 含量在整个生长周期内大体呈下降趋势;在各生长时期,GG处理的组培苗根系内源IAA含量下降不明显且始终最高(图1b)。在马铃薯组培苗生长过程中,第2周时组培苗根系内源GAs含量有增加,之后降低且基本保持不变,且各处理下组培苗根系内源GAs 与ABA 变化相似,即RR 处理GAs 和ABA 含量始终最高,GG 处理始终最低,RB、RBG和CK处理居中(图1c)。马铃薯组培苗根系中细胞分裂素ZR、DHZR 和IPA 的含量均在第2周处理结束时达到最高值;第3和4周处理结束后的含量与第1 周处理结束后基本持平(图1d、1e 和1f)。同一苗龄时期,CK与各处理的ZR和DHZR含量均无显著(P>0.05)差异(图1e 和1f)。RB、RBG和CK 处理下的IPA 含量在各生长时期无显著差异(P>0.05)但均显著(P<0.05)高于单色光处理;RR和BB处理下的IPA含量无显著差异(P>0.05),但均显著(P<0.05)高于GG处理(图1d)。总之,LED光谱改变马铃薯组培苗根系中内源激素的含量,同一激素在不同苗龄生长时期的含量不尽相同,整体来看以光处理结束第2周各激素含量变化最大。
2.2.2 LED光谱对马铃薯组培苗茎内源激素含量的影响
如图2a所示,各处理下,马铃薯组培苗茎内源ABA含量在第2周光处理后出现最低值,随后逐渐升高,至第4周光处理结束后基本达到第1周光处理结束时期水平。马铃薯组培苗整个生长周期内,BB处理的ABA 含量始终高于CK 和其他处理,RR 和GG处理的ABA含量始终最低,RB,RBG处理和对照CK的ABA含量基本一致。但是,各处理不同生长时期马铃薯组培苗茎内源GAs与内源ABA含量呈现相反的变化趋势(图2b)。各处理下,马铃薯组培苗茎内源IAA含量也在处理第2周结束时达到最高,随后基本不变,但均高于光处理第1周结束时;RR和GG 处理下组培苗茎内源IAA 含量始终最高,RB、RBG 处理和 CK 下 IAA 含量居中,BB 处理下IAA含量始终最低(图2c)。各处理下,马铃薯组培苗茎秆中的细胞分裂素(IPA、ZR 和DHZR)均在光处理第2周结束时出现最高值(图2d、2e和2f);除BB处理下茎内源细胞分裂素IPA含量显著(P<0.05)低于CK 和其他处理外,其他处理与CK 并无显著(P>0.05)差异(图2d);在光处理第1、3和4周后,各处理下,茎内源细胞分裂素IPA和ZR含量基本相同;除第2周外,在同一生长时期,各处理的茎内源细胞分裂素ZR 和DHZR 含量并无显著(P>0.05)差异。不同LED光谱显著影响各生长时期马铃薯组培苗茎秆中ABA、IAA和GAs的含量。
2.2.3 LED光谱对马铃薯组培苗叶片内源激素含量的影响
在整个光处理期间,RR和GG处理下马铃薯组培苗叶片内源ABA含量始终最高,平均高出CK和其他处理20 ng/g,且呈递减趋势;有趣的是BB处理下ABA 的变化趋势与RB、RBG 处理和CK 基本一致,均表现为在光处理第2周后略微升高,随后降低并基本保持不变(图3a)。各处理下,马铃薯组培苗叶片内源GAs含量的变化趋势基本相同,即光处理第2周升高,随后降低并基本保持不变,但RR和GG处理的组培苗叶片内源GAs含量始终最低,BB处理则最高(图3b)。所有光处理下马铃薯组培苗叶片内源IAA含量均在第2周后呈持续下降趋势,RR和BB处理下在前三周叶片的IAA激素含量几乎相同且始终最高;GG处理叶片IAA含量在整个生长期均最低,RB、RBG和CK处理居中(图3c)。BB处理下前三周组培苗叶片内源细胞分裂素(IPA、ZR 和DHZR)含量始终显著(P<0.05)高于CK 和其他处理;RB和RBG处理的细胞分裂素含量与CK无显著差异(P>0.05)但均显著(P<0.05)高于RR 和GG 处理(图3d、3e和3f)。LED光质显著改变马铃薯组培苗叶片中植物激素的含量,BB处理显著增加组培苗叶片内源细胞分裂素的含量。
3 讨 论
马铃薯组培苗通常用于温室移栽生产微型薯和单节茎段剪切用于扩繁培养,前者要求壮苗以利于成活,后者要求节间数多且节间较长利于剪切。本研究中红蓝组合RB与红蓝绿组合RBG光谱下的马铃薯组培苗在株鲜重、叶面积、茎长、茎粗、根直径和根表面积上均高于对照CK,表明上述组合光谱在培养健壮马铃薯组培苗方面优于白光光谱,类似的结果在葡萄、棉花、兰花等多种组培苗[19-21]和黄瓜[22]、番茄[23]幼苗上均有报道。单色红光和绿光下马铃薯组培苗表现出叶片面积小,茎秆细长,植株鲜重低的特点,表明该光处理引起了马铃薯组培苗的荫蔽反应(即茎秆细长,叶片部分投入减少,植株重量下降)。单色红和绿光下培养的葡萄组培苗也表现出类似的现象[24]。此外,节间长的马铃薯组培苗有利于茎段剪切进行继代培养。试验中,RR和GG 处理2 和3 周苗龄的组培苗分别与对照CK和RB、RBG 处理下3 和4周苗龄的组培苗茎长和节间长相当,表明这2种光处理的组培苗用于茎段剪切继代培养较有优势。相反,单色蓝光导致马铃薯组培苗叶色浓绿,叶面积大,茎秆较粗但极度矮化,说明蓝光引起马铃薯组培苗的形态生长与上述2种单色光截然不同,这可能与不同光源介导的激素调控有关。
GAs的主要作用是促进茎节伸长。调控株高的基因主要通过调节活性赤霉素GA1的含量来控制株高,且在一定范围内植株高度与其含量呈正相关[25,26]。各处理下,马铃薯组培苗茎内源GAs变化趋势与对照CK相同,RR和GG处理始终最高,组合光谱RB和RBG及CK次之,BB始终最低(图2b),表明单色红光和单色绿光处理下组培苗茎秆积累较高的GAs含量,可能活性赤霉素GA1含量也较高,进而促进了茎秆和节间的伸长;单色蓝光处理下组培苗茎内源GAs含量最低,推测GA1含量亦较低,抑制了组培苗节间伸长,从而造成蓝光处理的茎秆极度矮化。IAA具有促进细胞伸长的作用。值得注意的是,各处理下不同生长时期组培苗茎内源IAA含量变化与GAs基本一致(图2c)。研究表明红色荧光灯下培养的马铃薯组培苗茎秆表现出明显的伸长生长,同时伴随着较高的内源IAA和GAs含量;单色蓝光下茎秆伸长被强烈抑制,同时伴随着低浓度的内源IAA和GAs含量。这些研究均表明单色红光可能通过提高CAs和IAA的含量,促进组培苗茎细胞伸长生长;也可能组培苗茎内源GAs和IAA协调作用强烈刺激茎秆伸长导致马铃薯组培苗株高显著(P<0.05)增加。此外,由表2可知任一生长时期RR和GG处理的马铃薯组培苗茎长均显著(P<0.05)高于BB处理;与此同时,在同一生长时期下,RR和GG处理的茎内源GAs和IAA含量也均显著高于BB处理,这说明RR和GG处理下GAs和IAA含量并未达到这2 种激素促进茎秆伸长生长的最大临界值。因此,单色蓝光下的茎生长可能是因为上述2种激素含量低而被强烈抑制,导致蓝光下马铃薯组培苗株高显著(P<0.05)降低。此外,显微结构观察亦表明红光处理下的马铃薯组培苗茎细胞狭长而蓝光下则短小[6]。细胞分裂素可以刺激细胞体积增大。单色蓝光下茎秆内源细胞分裂素IPA含量始终显著(P<0.05)低于CK和其他处理(图2d),可能也是造成蓝光下马铃薯组培苗茎秆极度矮化的潜在原因。各处理,不同生长时期组培苗的茎内源ABA含量变化趋势与 IAA 和 GAs 相反,BB 处理的 ABA 含量始终最高,组合光谱RB和RBG处理及对照CK次之,RR和GG 处理最低(图2a)。ABA 作为一种抗逆激素,可以改善植物对逆境的适应,增强抵抗能力。单色蓝光下马铃薯组培苗茎秆粗壮,而单色红绿光下则细弱,这可能与茎秆中较高的ABA含量增强了组培苗对组培微环境[27](低CO2浓度、高湿度、弱光照等)及单色光胁迫的逆境适应性有关。
正常发育的叶片可以合成细胞分裂素,该激素通过诱导营养物质转移至叶片而扩大叶器官的源[28]。单色蓝光处理下马铃薯组培苗叶片内源细胞分裂素(IPA,ZR 和DHZR)含量均显著(P<0.05)高于其他处理。可能是蓝光处理诱导叶片积累较高的细胞分裂素促进营养物质从其他部位转移至叶片利于叶片生长,造成叶片面积大而肥厚。蓝色荧光灯培养下马铃薯组培苗叶片面积及其内源细胞分裂素含量也显著高于白色荧光灯[5]。此外,细胞分裂素可以促进叶绿体发育,抑制叶片衰老[29],这可能是造成蓝光下组培苗叶色浓绿的重要原因。ABA具有促进叶片脱落的功能[30],单色红绿光处理下ABA含量始终高于CK和其他处理,这可能是造成RR处理下叶片发黄且易从茎秆处脱落的原因。
在组培植物生长过程中,因固体培养基环境的特殊性(渗透压大、营养元素浓度高且一次供应,无液态水等),生长在培养基内的马铃薯组培苗根系一定程度上处于一种胁迫状态。研究表明根系内适宜浓度的ABA 会缓解根系胁迫,促进根系生长[31];低浓度的GAs 会阻碍根系细胞分裂,抑制根系生长[32]。RR 处理下组培苗根系内源ABA 含量可能是较适宜的浓度,很大程度上缓解了培养基环境对根系造成的胁迫且该处理下内源GAs含量较高能够促进根细胞分裂,促进根系生长。这可能是造成单色红光下根系生长指标良好的一个重要原因。虽然IAA具有促进根系生长的功能,但根系对其浓度十分敏感,浓度过高就会抑制根系生长[30]。单色绿光下根系内源IAA含量始终最高而其根系生长指标却显著(P<0.05)低于CK,表明GG处理下诱导根系产生的高浓度IAA可能抑制了根系的生长。此外,单色绿光下根系内源GAs含量较低,阻碍了根系的细胞分裂,对根系生长也产生了阻碍。上述2种激素的协同抑制可能导致了单色绿光下马铃薯组培苗根系生长较差的重要原因。
不同波长LED光源及其组合通过影响马铃薯组培苗内源激素在不同器官中的积累与分布水平进而影响组培苗的形态生长。此外,光介导的植物内源激素调控对植物生长发育的影响是一个非常复杂的过程,加上马铃薯组培苗生长的特殊微环境[27],这期间也可能会涉及到其他如油菜素内酯、水杨酸、茉莉酸等激素的调控,尚有待进一步研究。
