聚多巴胺改性自支撑碳纤维固定化酶研究
2020-11-07苏丽访王翠娥蔡再生赵亚萍
苏丽访 王翠娥 蔡再生 赵亚萍
东华大学 生态纺织教育部重点实验室(中国)
相比于化学类催化剂,酶作为一种重要的生物催化剂,具有高效、专一、反应条件绿色等优异的特点[1-3]。然而,由于游离态酶催化活性低、稳定性较差,且不易于后续的分离回收,因此限制了其在各领域的广泛应用。基于绿色、经济及可持续化学的研究发展考虑,当前研究热点已转向采用生物催化剂固定化技术来合成高立体选择性和对应选择性的产物,这可以在一定程度上很好地改善游离酶的上述不足。目前研究中,载体材料对固定化酶工程的影响较大,目前在众多学者的研究中,多糖、天然高分子、无机材料及有机聚合物等载体材料被广泛应用于固定化酶的研究中,但是这些材料仍然存在着各种缺点,如尺寸较大、结构不易调控、力学性能差、使用寿命较短等[4]。碳材料因其三维立体结构而具有较大的比表面积、有序的孔结构、良好的热稳定性和化学稳定性,这些优良性质可以克服上述缺点,在固定化酶领域充当优良的载体[5-7]。

1 材料与方法
1.1 材料与试剂
盐酸多巴胺,上海阿拉丁生化科技股份有限公司;磷酸,无锡市亚盛化工有限公司;考马斯蓝G250,上海瀚思化工有限公司;棕榈酸对硝基苯酯,百灵威科技有限公司;无水碳酸钠,天津市北辰方正试剂厂;脂肪酶Lipozyme CALB,丹麦诺维信Novozymes;无水乙醇,无锡市亚盛化工有限公司;磷酸二氢钾,无锡市亚盛化工有限公司;磷酸氢二钾,无锡市亚盛化工有限公司,三聚氰胺泡沫,南京汉雄科技发展有限公司。
1.2 仪器与设备
电子天平,上海衡平仪器仪表厂;多功能磁力搅拌器,金坛市杰瑞尔电器有限公司;电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;磁力搅拌器,上海志威电器有限公司;真空管式炉,合肥科晶材料技术有限公司;水浴恒温振荡器,金坛市杰瑞尔电器有限公司;pH计,上海仪电科学仪器股份有限公司;摇床,太仓市实验设备厂;离心机,长沙湘智离心机仪器有限公司;扫描电子显微镜(SEM),日本电子株式会社;紫外分光光度计,上海元析仪器有限公司。
1.3 聚多巴胺改性碳纤维固定化酶的制备
1.3.1 碳纤维的制备
将长10 cm、宽5 cm、高1 cm的三聚氰胺泡沫放置在干净的载玻片上,将放置有三聚氰胺泡沫的载玻片放入管状升温炉中,升温至400 ℃,在此温度下煅烧1 h后获得碳纤维。
1.3.2 聚多巴胺改性碳纤维的制备
在20 mL磷酸缓冲液中(pH值为8.5)加入50 mg碳纤维载体(10块,每块质量为5 mg),超声分散30 min,然后加入盐酸多巴胺(2 mg/mL)常温搅拌3 h。反应完成后,用磷酸缓冲溶液(pH值为8.5)和乙醇多次洗涤反应产物,然后在40 ℃真空干燥箱内干燥8 h。所得产物即为聚多巴胺改性后的碳纤维。
1.3.3 聚多巴胺改性碳纤维固定化酶的制备
称取一定量的聚多巴胺改性后的碳纤维载体,加入脂肪酶溶液(质量浓度为1 mg/L)中,然后于30 ℃下在转速为120 r/min 的摇床内反应5 h。固定化反应结束后,用磷酸缓冲液(0.1 mol/L, pH值为7.0)多次洗涤以除去未结合的脂肪酶。同时,将反应液与洗涤液合并用于后续残留酶量的测定。所得固定化酶经室温自然干燥后,存放于4 ℃冰箱内以备后用。
1.4 测试与表征
1.4.1 固定化脂肪酶酶载的测定
1.4.1.1 试验原理
测量固定化酶含量采用考马斯亮蓝法,原理是利用蛋白质能够和染料结合,蛋白含量不同而显示出不同的颜色[12-13]。蛋白质与考马斯亮蓝结合的反应速率较快,2 min内即可反应完全,反应产物可以稳定1 d。考马斯亮蓝和蛋白质结合的产物在595 nm 处具有最大吸收波长,且在一定蛋白质浓度范围内与吸光度成正比,符合朗伯比尔定律。该法测定蛋白质含量的重复性好,灵敏度高,线性关系较好,干扰物质较少,可作为一种快速灵敏的定量测量微量蛋白质浓度的方法[14-15]。
载体上固定化的酶蛋白含量可采用式(1)计算。
(1)
式中:Ae——酶载量(mg/g);
Co——固定化前酶液质量浓度(mg/L);
C——固定化后酶液质量浓度(mg/L);
v——固定化酶所用的酶溶液体积(mL);
Cw——洗涤固定化酶后缓冲溶液中酶溶液的质量浓度(mg/L);
vw——洗涤固定化酶所用的缓冲溶液的体积(mL);
W——碳泡沫的质量(g)。
1.4.1.2 Bradford工作液的配制
首先将25 mL乙醇(质量分数为95%)、50 mL磷酸(质量分数为85%)和87.5 mg考马斯亮蓝试剂混合,配置Bradford储存液,在棕色瓶中于4 ℃下保存。然后将蒸馏水、磷酸、乙醇和Bradford储存液按体积比为425∶15∶30∶30混合,再用滤纸过滤,然后将工作液放入棕色瓶中于4℃下保存,待用。
1.4.1.3 标准曲线绘制
用pH为7.0的磷酸缓冲液配制质量浓度分别为0.1、0.2、0.3、0.4、0.5、0.6和0.7 mg/mL的脂肪酶标准溶液,按顺序分别取0.3 mL标准酶溶液于4 mL离心管中,再加入3 mL的Brodford储存液在室温下反应5 min,于595 nm处测吸光度。以0.3 mL磷酸缓冲液(pH为7.0)和3 mL Brodford储存液混合作为此次测试的空白对照组。所得数据以质量浓度为横坐标,吸光度值为纵坐标拟合得酶标准曲线。
1.4.2 酶活力测定
在一定条件下,硝基苯酚棕榈脂溶液可以被脂肪酶水解。试验采用硝基苯酚棕榈脂溶液和脂肪酶反应5 min,取其水解产物稀释至一定的倍数后,用紫外分光光度计测得波长为410 nm处的数值,用以表征产物的质量浓度,即可得出脂肪酶的酶活[16-17]。
对硝基苯酚棕榈脂溶液的配制:按14.41 mol/L的浓度配制,称取0.125 9 g的对硝基苯酚棕榈脂,置于25 mL的小烧杯中,加入无水乙醇,搅拌使其溶解。待完全溶解后转入25 mL的容量瓶中,用无水乙醇定容,低温保存,备用。底物溶液的配制:将1 mL的对硝基苯酚棕榈脂和1 mL的磷酸缓冲液(0.05 mol/L, pH值为7.0)混合,振荡使其充分混合,得到黄色的悬浮液。
将自由酶或固定化酶加入底物溶液中,置于一定温度的恒温水浴振荡器上反应,同时用秒表计时。5 min后取出,立即加入2 mL碳酸钠溶液(0.5 mol/L,),以中止反应。然后用离心机在10 000 r/min的转速下离心10 min。取出0.5 mL反应液置于小烧杯中,用去离子水稀释10倍,然后用紫外分光光度计测定其在410 nm处的吸光度。同时在不加酶的条件下,对底物溶液进行相同的处理,用所得的空白试样作为紫外测试的基线。在此反应液中对硝基苯酚棕榈脂的摩尔吸光系数为14.5×10-3L/(mol·cm)。
一个脂肪酶的活力单位对应于在检测条件下,每分钟反应体系生成1 μmol的对硝基苯酚棕榈脂量。固定化酶的活性定义为每克固定化酶的活性力单位数:
式中:Ac——固定化酶的活性[μmol/(L·g)];
A——410 nm处的吸光度值;
a——反应被稀释的倍数,本试验中a=20;
V——反应液的总体积(mL),本试验中V=2 mL;
ε——对硝基苯酚棕榈脂的摩尔吸光系数,具体数值为14.5×10-3L/(mol·cm);
I——比色皿的厚度(cm),本试验中I=1 cm;
t——水解时间(min),本试验中t=5 min;
m——固定化酶的质量(g)。
相对酶活=(每组中酶活力值/该组中最高酶活力值)×100%
1.4.3 固定化酶的稳定性
分别在不同温度、pH值和储存时间条件下测定固定化酶和游离酶的酶活力,评价固定化酶的稳定性。
2 结果与分析
2.1 聚多巴胺改性碳纤维的SEM分析
聚多巴胺改性前后碳纤维的SEM图如图1所示。由图1可以看出,改性前后的碳纤维均呈现出三维立体结构,经测量可知纤维直径为30~40 μm。由图1a)可以看出,未改性的碳纤维表面较光滑。由图1b)可以看出,聚多巴胺改性后的碳纤维表面存在颗粒状物质,且改性后纤维粗糙度明显增加,纤维表面被一层聚多巴胺膜包覆,说明聚多巴胺已成功在碳纤维上产生自聚。

a) 改性前
2.2 固定化脂肪酶蛋白含量
脂肪酶质量浓度分别为0.1、 0.2、 0.3、 0.4、 0.5、 0.6和0.7 mg/mL时,根据7组测试数据拟合得的酶标准曲线如图2所示。由图2可知,有6个试验数据点都位于线性方程上,表明其满足方程拟合条件。所得方程为Y=1.286 79X-0.015 86,该方程是计算酶载的基础。
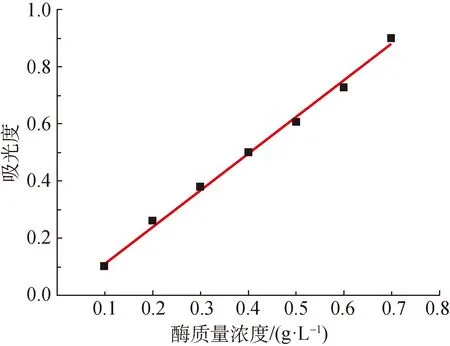
图2 酶液标准曲线图
配制固定化酶液的质量浓度Co=2 mg/mL,其他数据见表2,其中C=1.588 mg/mL,Cw=0.061 mg/mL,v=50 mL,vw=25 mL,W=0.125 g,计算可得固定化脂肪酶的酶载Ae=153 mg/g。这一高酶载量归因于碳纤维的三维立体网状结构,大大增加了载体的比表面积,使载体和酶的接触面积增大,发生反应的几率高。此外,聚多巴胺改性后碳纤维的表面官能团增加,其与脂肪酶发生席夫碱反应,使酶固定在碳纤维上,固定化酶的相对活性增加,使得酶载量较高[18-21]。
2.3 游离酶及固定化酶酶学性质对比分析
2.3.1 温度对酶活性的影响
温度对游离酶和固定化酶活性的影响如图3所示。由图3可以看出,在一定的温度范围内(20~70 ℃),随着温度的升高,游离酶和固定化酶的酶活均呈现出先增大后减小的趋势,且游离酶和固定化酶的酶活力均在30 ℃达最大值。但在30~70 ℃的范围内,固定化酶表现出更好的稳定性。温度为70 ℃时,游离酶的酶活性仅为7%,而固定化酶的酶活性仍达52%。其原因可能是发生共价结合后的固定化酶被稳定地固定在载体的小区域内,因此在较高的温度下仍能维持蛋白质的三级结构,并继续进行酶催化反应,保持较高的酶活性。
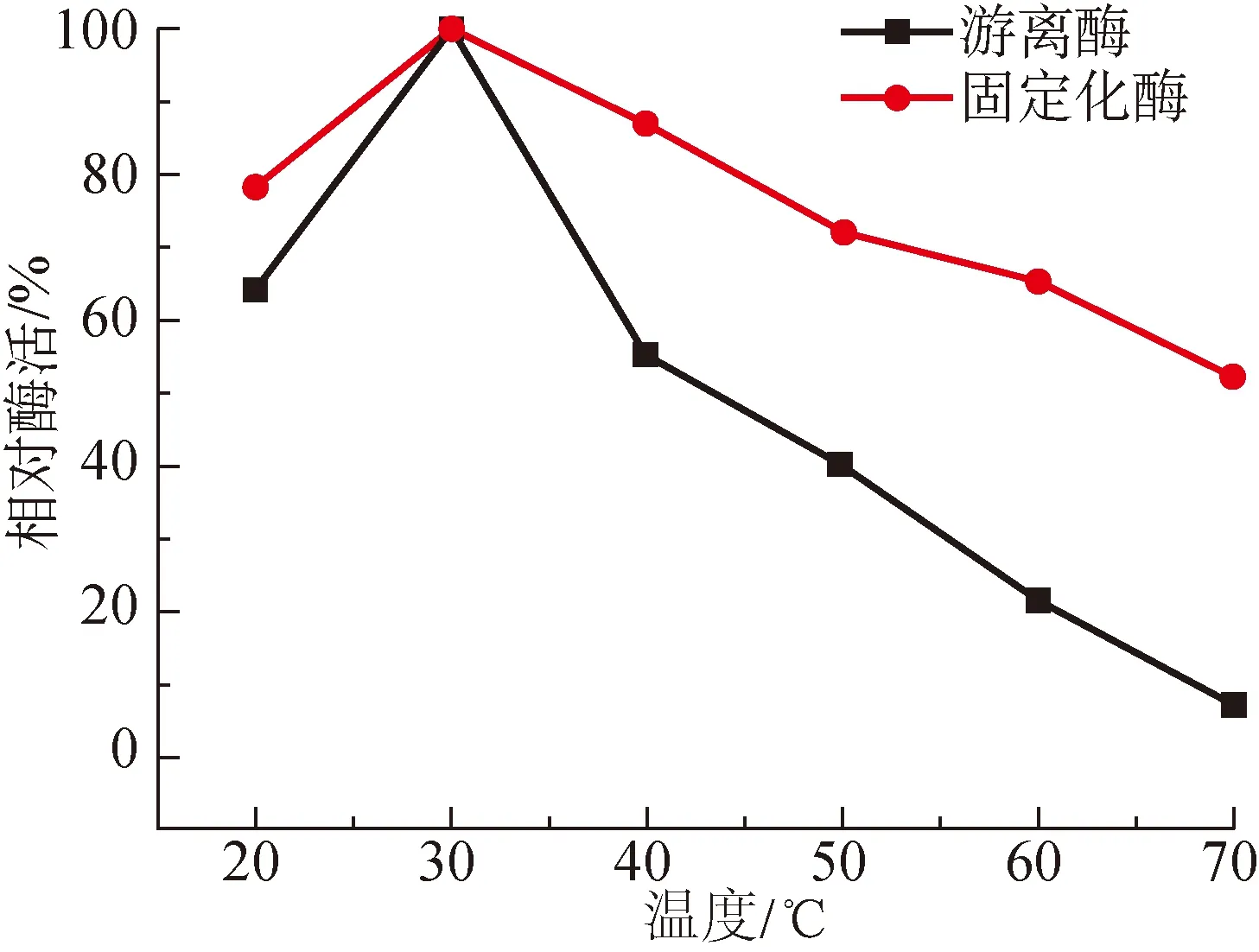
图3 温度对酶活性的影响
2.3.2 pH值对酶活性的影响
pH值对游离酶和固定化酶活性的影响如图4所示。由图4可以看出,在一定的pH值范围内(5~9),固定化酶和游离酶的活性随着pH值的变化呈现出一致的变化趋势。当pH值为5~7时,游离酶和固定化酶的活性均随着pH值的增大而增大,pH值为7时活性均达最大值,可知游离酶和固定化酶试验的反应pH值均为7。随着pH值的进一步增大,在pH值为7~9范围内,游离酶和固定化酶的活性均随着pH值的增大而减小,当pH为9时,游离酶的活性仅为39%,而固定化酶的活性仍可达75%。说明固定化酶可在更宽的pH值范围内保持较高的活性。原因可能是游离酶体系中,pH值的微小变化即会导致酶活性中心的基团离子化,从而明显降低酶的活性,而聚多巴胺改性后载体表面的羟基和氨基有pH缓冲作用,使脂肪酶微环境的变化小于溶液环境的变化,尤其是当pH值较高时,聚多巴胺改性载体上的羟基和氨基在pH值变化时,可保持酶分子处于较稳定的pH环境中,从而使脂肪酶的酸碱稳定性得以改善。

图4 pH值对酶活性的影响
2.3.3 储存时间对酶活性的影响
固定化酶的储存稳定性对其实际应用具有重要的意义。图5为固定化酶和游离酶在保存不同时间后呈现出的活性变化。
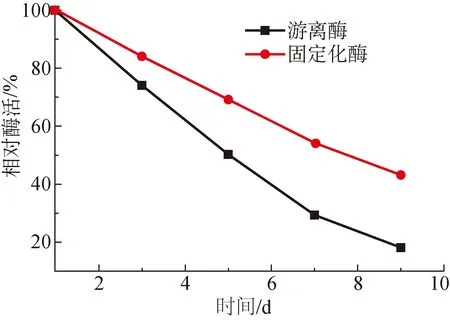
图5 储存时间对酶活性的影响
从图5可以看出,固定化酶和游离酶的活性均随着放置时间的延长而不断下降,但游离酶的活性下降更明显。当储存时间达9 d时,游离酶的活性仅为初始活性的18%,而固定化酶的活性仍可达到初始活性的43%,说明脂肪酶经固定化后,储存稳定性明显提高。这是因为载体对脂肪酶具有很好的保护作用,同时酶与载体之间的相互作用可使酶分子之间的刚性增强,因而储存稳定性明显提高。
3 结论
本文采用三聚氰胺泡沫制备出聚多巴胺改性自支撑碳纤维载体。该聚多巴胺改性自支撑碳纤维载体可直接用于共价固定化脂肪酶,碳纤维改性过程在pH值为8.5的反应条件下进行,反应条件绿色温和,可避免使用具有生物毒性的试剂连接酶和载体。试验结果表明,聚多巴胺改性复合材料具有高负载量和生物相容性,对目标酶亲和力强。与游离酶相比,所得固定化酶具有良好的环境稳定性和条件适用性。总体而言,本试验制备的聚多巴胺改性碳纤维复合材料对脂肪酶固定化的成功应用,展示了其在固定化酶工程领域的应用潜力。
