胸水细胞蜡块与“新鲜”胸水在肺腺癌EGFR基因检测中的应用
2020-11-06李晓玲黄仲刘美莲
李晓玲,黄仲,刘美莲
广东医科大学附属医院病理诊断与研究中心1、肿瘤中心肺部肿瘤病区2,广东 湛江 524001
肺癌是目前全球范围内众多恶性肿瘤类别中发病率最高的癌症,有权威大规模统计显示,中国位居世界肺癌发病率和病死率的榜首[1],且呈显著上升的趋势,已经成为严重威胁中国人群健康的主要公共卫生问题之一,备受社会各界关注。随着肺癌个体化靶向治疗理念的飞跃,2019 版美国国立综合癌症网络(national comprehensive cancer network,NCCN)指南更新,明 确 非 小 细 胞 肺 癌(nonsmall-cell lung cancer,NSCLC)在治疗前应检测基因状态[2]。然而遗憾的是,2/3 以上的肺癌患者在确诊时已属晚期,错过手术时机,临床难以获取肿瘤实体标本。作为晚期肺癌患者常见的并发症,胸水标本的获取相当简单而安全。采用胸水标本进行表皮生长因子(epithelial growth factor receptor,EGFR)突变的检测有两个路径,其一是临床医生将即时获取的“新鲜”胸水样本直接送到分子病理室检测,其二是临床医师将获取的胸水样本先送到常规细胞病理室,由细胞病理技术人员制作成细胞蜡块,由病理诊断医师做好蜡块切片质控(确定有一定量的肿瘤细胞数)后交由分子病理室进一步检测。从临床的角度,第一个路径简单、方便、快捷,第二个路径流程较为繁琐,费时较长。那么,从病理精准的角度,两个路径检测的结果是否一致?本研究旨在探讨胸水细胞蜡块与“新鲜”胸水在肺腺癌EGFR基因检测中的应用效果。
1 材料与方法
1.1 材料 选取2018 年1 月至2019 年6 月在广东医科大学附属医院住院治疗的胸腔积液患者67 例,一份胸水常规涂片及制作成细胞蜡块,切片经免疫组织化学染色明确为肺腺癌而进一步检测EGFR(实验组),另一份“新鲜”胸水直接检测EGFR(对照组)。每份胸水均为临床医生经胸腔穿刺术现抽即送的合格标本。
1.2 方法
1.2.1 制备细胞蜡块 取胸水100 mL 置于两管50 mL 离心管内,离心(5 min,800×g),弃上清液,滴入1~3 滴试剂A,震荡,使细胞与试剂A 充分混合,离心(2 min,800×g),取出离心管,弃掉多余上清后滴入2~3滴试剂B,轻晃试管,静置30 s,待细胞块与离心管底部分离,用软吸管将细胞块吸起,转移到包埋纸上包好,置入包埋盒,经过固定、脱水,石蜡包埋成细胞蜡块,然后切片、苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色。
1.2.2 免疫组织化学法 切片进行免疫组化染色,所用一抗CK7、TTF-1、NapsinA 均购于福州迈新生物技术开发有限公司,采用DAKO Omnis公司最新型全自动免疫组化仪进行染色,同时设阴、阳性对照。结果判定:CK7、NapsinA肿瘤细胞胞质着色为阳性,TTF-1 肿瘤细胞胞核着色为阳性。所选病例经此三项肺腺癌特异抗体明确诊断。
1.2.3 EGFR基因突变检测 细胞蜡块切片常规脱蜡后及新鲜胸水离心处理后沉渣提取DNA。DNA提取试剂盒为厦门艾德生物医药科技股份有限公司的核酸提取试剂盒-FFPE DNA(离心柱型),EGFR 基因检测试剂盒为厦门艾德生物医药科技股份有限公司的人类EGFR 基因突变检测试剂盒(荧光PCR法)。DNA提取完成后采用超微量紫外分光光度计测量其浓度及OD260/OD280,以验证所提取的DNA 样本是否合格,验证合格后上机进行检测。采用扩增阻遏突变系统(amplification refractory mutation system,ARMS)技术进行EGFR 基因突变检测。应用Roche cobas z480 荧光 定量PCR 仪检测EGFR 基因外显子18、19、20、21(Exon18-21)上的常见已知突变。
1.3 统计学方法 采用SPSS15.0 统计软件分析数据,计数资料以构成比或率(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 常规病理观察 传统涂片观察见癌细胞团(图1A);胸水制作成细胞蜡块做成HE切片观察,可见癌细胞排列成腺样、乳头状,有着与实体癌组织相似的空间排列结构(图1B、1C);切片加做免疫组化指标TTF-1、NapsinA、CK7显示阳性表达,协助确诊肺腺癌(图1D、1E、1F)。
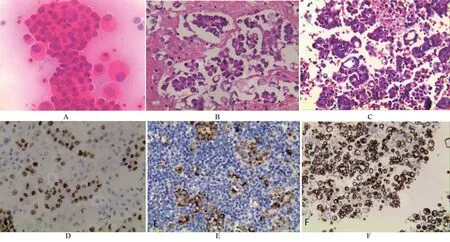
图1 胸水涂片及细胞蜡块切片HE染色、免疫组化染色
2.2 EGFR 检测结果 样本有任一突变类型为EGFR阳性(图2),无任何突变类型为EGFR阴性(图3)。检测结果显示,实验组EGFR 突变阳性42 例,阴性25例,阳性率为62.69%(42/67),而对照组EGFR 突变阳性30 例,阴性37 例,阳性率为44.78%(30/67);两组同为阳性27 例,同为阴性22 例。胸水细胞蜡块阳性率明显高于“新鲜”胸水,差异有统计学意义(χ2=67.000,P=0.008<0.05)。
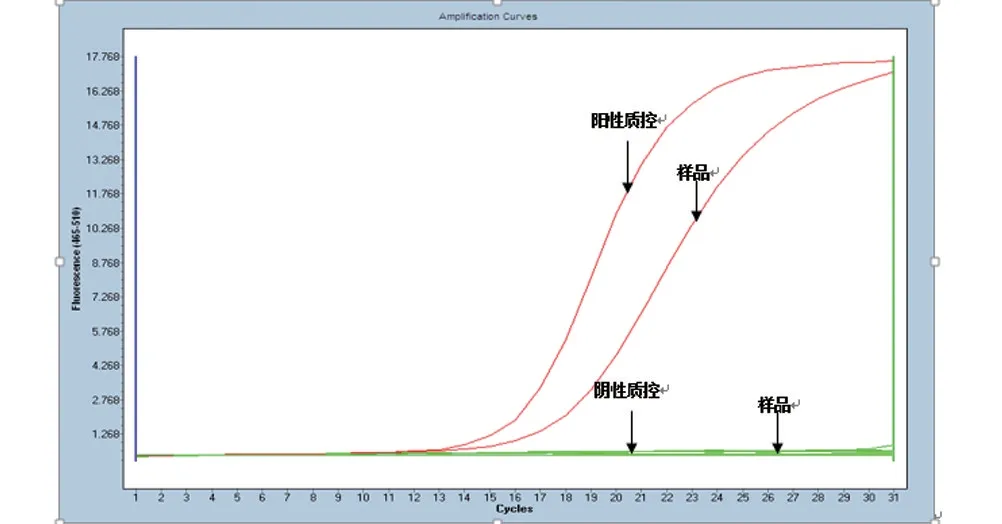
图2 EGFR阳性结果图

图3 EGFR阴性结果图
3 讨论
随着人类基因组学、蛋白质组学、肿瘤生物学技术和分子病理学技术的快速发展,研究学者对肺癌发病机制从细胞、分子、基因水平进一步的深入认识,持续不断推进了药物的研究与开发,肺癌的治疗取得了诸多理念上的飞跃,从根本上改变了既往的传统策略,发展到精准分子靶向治疗时代。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinaseinhibitors,EGFR-TKIs)靶向用药在发生EGFR敏感突变的肺腺癌患者及其他非小细胞肺癌患者的治疗中,取得了显著效果。用于检测EGFR 基因突变的首选标本为手术切除的肿瘤组织,其次是经皮肺穿刺组织及纤支镜活检组织。然而遗憾的是,多数病例确诊时已属晚期,错过手术时机。作为晚期NSCLC患者的常见并发症,高达60%以上肺癌患者会在病程中出现胸水,约15%肺癌患者于确诊时就已出现胸水[3],且临床上常呈难以遏制、进行性加重的表现,随着病情的进展,患者很快就出现胸痛、气短、不能卧躺等症状,严重降低患者的生活质量。而并发恶性胸水的晚期肺癌患者难以获取肿瘤的实体活检组织,相对而言,胸水的获得则较为容易。此时应用胸水不仅能够做病理的常规诊断,还能够检测EGFR 基因突变,有助于临床评估靶向药的选用,以及判断耐药机制等,从而更精准的制定个体化诊疗方案。所以,对于无法获取组织标本检测EGFR 突变的患者而言,通过获取胸水检测不失为一个不错的选择。
EGFR 是细胞膜上的一种跨膜糖蛋白,属于酪氨酸激酶型受体,表达于正常上皮细胞表面,而在一些肿瘤细胞中常常过表达,与肿瘤的转移、浸润、预后相关。检测非小细胞肺癌患者EGFR 基因的突变状态,具有举足轻重的临床意义,是评估患者能否应用EGFR-TKIs 靶向治疗的先决条件[4]。随着分子病理技术的进步和现阶段胸水处理方法的完善,应用胸水检测EGFR 基因突变已成为评估NSCLC 患者EGFR 基因突变状况的重要途径,为临床筛选适合应用EGFR-TKI治疗的患者提供关键的参考价值。
而为了明确肺癌的诊断及其分型,以及后续精准治疗方案的制定,务必有效保存胸水中可能极其有限的肿瘤细胞。通过常规细胞学病理技术,除了传统涂片观察,还可以将胸水制作成细胞蜡块,做成HE 切片,不仅能够直观看到肿瘤细胞与实体肿瘤组织相似的空间排列结构,还可以加做一些免疫组化指标,协助肿瘤分型确诊。李锐等[5]的研究显示胸水细胞蜡块EGFR 突变阳性率与手术标本相当,MIYOSHI 等[6]和ZHOU等[7]强调了细胞蜡块的诊断价值,王双双等[8]也肯定了细胞蜡块的重要意义。本研究表明,结合胸水细胞蜡块和免疫组化结果不仅可明确肺腺癌诊断,在做好切片质控(确保一定量的肿瘤细胞数)后进行EGFR检测,阳性率比“新鲜”胸水直接检测EGFR的阳性率更高,是更为可靠的检测路径。尤其是在未能开展基因检测的基层单位,“新鲜”胸水中肿瘤细胞的“保鲜”时间十分有限,其携带的生物学信息极易降解、丢失,从而可能出现假阴性,而将胸水制作成细胞蜡块后,肿瘤细胞携带的生物学信息可长久保存,后续再送上级单位检测则变得可靠,行之有效,值得推广。
