呼气冷凝液中性粒细胞趋化性与AECOPD患者不良结局的关系
2020-11-06邢媛媛陈金亮陈建荣吕学东
邢媛媛,陈金亮,陈建荣,吕学东
南通大学第二附属医院呼吸与危重症医学科1、急诊科2,江苏 南通 226001
慢性阻塞性肺疾病急性加重(acute exacerbation chronic obstructive pulmonary disease,AECOPD)是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者住院治疗的主要原因[1]。调查显示,14%~30%的AECOPD 患者在出院后60 d 内需要重新住院治疗[2-3]。由于急性加重是COPD 自然病程中的关键事件,减少早期再入院已成为COPD 患者管理的重要临床目标[4]。因此,确定住院和再入院的风险和预后因素可以实现这一目标。COPD 的特征是气道重塑和炎性细胞浸润,中性粒细胞在其中起关键作用[5]。研究发现,中性粒细胞在气道和组织中的浸润程度与COPD 的严重程度相关,并与稳定COPD 患者的支气管细菌定植和1秒用力呼气容积(FEV1)下降相关[6]。呼出气冷凝液(exhaled breath condensate,EBC)作为一种非侵入性方法,用于评估许多肺部疾病(如COPD)的炎症,在AECOPD患者中运用具有良好的耐受性[7]。EBC 来源于整个支气管树(近端和远端气道)的气溶胶颗粒,许多与COPD 患者痰中性粒细胞趋化活性有关的化学引诱剂,如白三烯B4、白介素-8 均可在EBC中检测到[8]。然而,目前关于AECOPD 住院患者EBC中性粒细胞趋化活性尚未被研究。因此,本研究旨在评价EBC 中性粒细胞趋化活性是否有助于预测AECOPD患者的早期不良结局。
1 资料与方法
1.1 一般资料 采集2016 年1 月1 日至2018 年12 月31 日在南通大学第二附属医院住院治疗的108例AECOPD 患者的临床资料,按照特定的ICD-10 初级出院代码进行的回顾性队列研究。本研究所分析的资料从医院电子病历系统中获取。所有数据收集均由其中一位作者审阅完成。研究人群包括出院报告中提到的18岁或18岁以上的无吸烟史的AECOPD患者。排除在住院期间死亡患者、违反医嘱出院的患者以及从另一个急性医疗机构转移或转移到另一个急性医疗机构的患者。AECOPD 定义为疾病自然过程中的一个事件,其特征是患者的基线呼吸困难、咳嗽和/或痰的变化超出正常的日常变化,急性发作,可能需要改变常规药物治疗[2]。该方案得到本院伦理委员会批准,受试者知情同意本研究。
1.2 资料收集 观察所有受试者在出院后60 d内因AECOPD 和任何原因再入院或死亡的发生率。从患者的电子病历中收集以下数据:①人口统计学:年龄、性别;②入院时生命体征:心率(HR)、收缩压和舒张压、呼吸环境空气时血氧饱和度(SO2);③共病:查尔森合并症指数、高血压、糖尿病、充血性心力衰竭及实体或血液恶性肿瘤史;④实验室检查值:白细胞计数(WBC)、pH、二氧化碳分压(pCO2)和血浆肌酐;⑤EBC中性粒细胞趋化性。使用Advia 120血液分析仪(德国西门子医疗诊断公司)测量血液学值。肌酐使用全自动生化分析仪Dimension(德国西门子医疗诊断公司)测量,血气分析使用GEM 3500血气分析仪(美国Instrumentation Laboratories 公司)。所有样本采集和测量均在病情恶化期间。
1.3 EBC收集方法 EBC通过EcoScreen商用冷凝器(德国Erich Jaeger Viasys GmbH 公司)收集。受试者通过与冷凝器相连的喉管以正常频率和潮气量呼吸,持续10 min。收集1.5~2 mL 的EBC,并在收集后5 min 内立即(以250 L 等份)在-80℃下储存,直到分析。通过测定α-淀粉酶浓度(酶比色法,检测限为3 U/mL),对所有样本进行唾液污染检测。
1.4 中性粒细胞分离 从同一非特应性和非吸烟健康志愿者的40 mL 外周静脉血中分离中性粒细胞。全血用6%右旋糖苷(瑞典Pharmacia 公司)处理45 min,沉淀红细胞。将富含白细胞的液相用磷酸盐缓冲液(PBS)洗涤3 次,并通过比重为1.077 的淋巴细胞分离液(天津市TBD生物技术发展中心)密度梯度离心(在室温下400×g 离心30 min)分离单核白细胞和粒细胞部分(>95%中性粒细胞)。中性粒细胞在PBS 中洗涤两次,然后置于Hank 的平衡盐溶液,调整细胞数为1×106个/mL。
1.5 EBC中性粒细胞趋化性测定 采用Boyden小室对EBC中性粒细胞的趋化活性进行评估。将28 μL的EBC等份置于下腔,将50 μL的细胞悬液(106个细胞/mL)置于上腔,两个腔室中间隔以0.8 μm孔径Nuclepore®膜(美国Whatman公司)。在37℃的5% CO2培养箱中孵育60 min。拆除小室,并从膜的上表面刮下未迁移的细胞。然后将膜浸入甲醇中并染色(Diff-Quick染色;美国Thermo Fisher Scientific公司)。高倍镜下对膜下表面的迁移细胞进行计数,结果表示为每10个高倍视野迁移的嗜中性粒细胞数。以细胞迁移率和EBC/细胞迁移率为指标计算趋化指数(chemotactic index,CI)。值为1.0表示没有趋化活性。本实验室CI正常范围是1.0~2.4。
1.6 统计学方法 定量变量以均值±标准差(x-±s)或中位数(四分位)表示,定性变量用例数和百分比表示。采用独立样本学生t 检验比较正态分布均值,或秩和检验比较非正态分布值。χ2检验或Fisher精确检验用于分析计数变量之间的差异。采用多元正逐步Logistic 回归分析患者的人口统计学因素、共病性、入院时生命体征、实验室检查结果和60 d不良事件之间的关系。根据与首次住院60 d 不良事件相关的双变量显著性水平(P<0.1),选择变量作为多变量分析的候选变量。为了评价CI 的预后能力,计算ROC 曲线下面积(AUC),通过AUC下面积的增加来评估CI对其他临床预测因子的附加预后价值。随后进行COX 回归分析,根据CI 的实验室上限生成调整后的生存曲线。以P<0.05 为差异具有统计学意义。数据分析采用SPSS23.0进行。
2 结果
2.1 患者的临床和实验室特征 108 例患者中,首次住院后60 d 再入院率为25.92%。其中42.86%的再入院由AECOPD引起。5例(4.6%)在出院后60 d内死亡(其中3例在死亡前至少再入院一次)。共记录30例(27.8%)不良事件。整个队列和60 d 不良事件患者的临床和实验室特征见表1。
2.2 多变量相关分析60 d不良事件相关因素 所有患者在出院前进行了血气分析,并纳入了相关性分析。其中49 例(45.4%)患者的CI 值正常(低于2.4)。表2 显示了人口统计学因素、合并症、入院时生命体征,实验室测试结果和60 d不良事件之间的相关性二元和多变量分析。结果显示,充血性心力衰竭、出院时pH 低于7.35 和出院时CI 异常(>2.4)是与复合不良结局相关的唯一变量。出院时CI异常(>2.4)和查尔森共病指数>5与AECOPD所致的再入院有关。
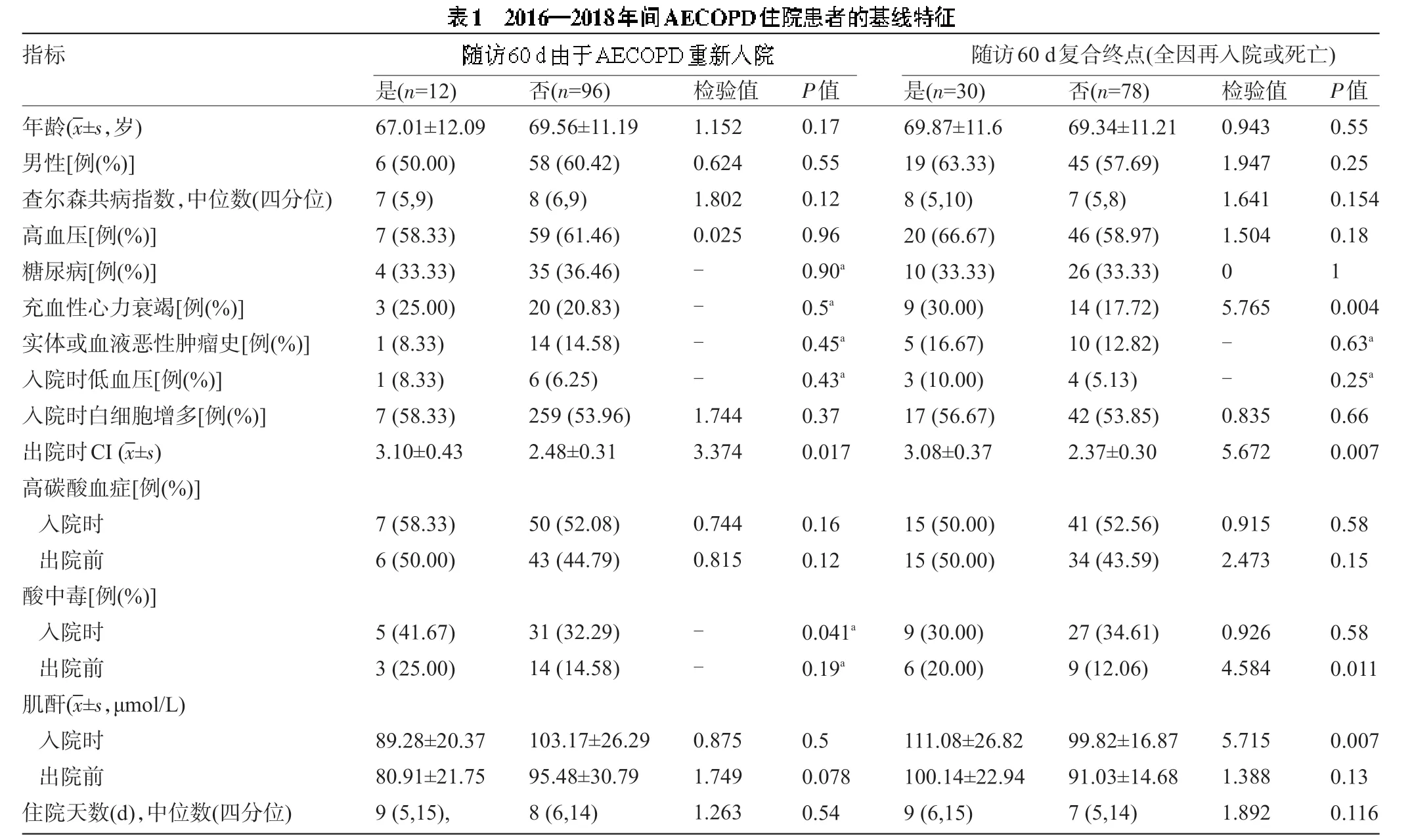
注:aFisher精确检验。
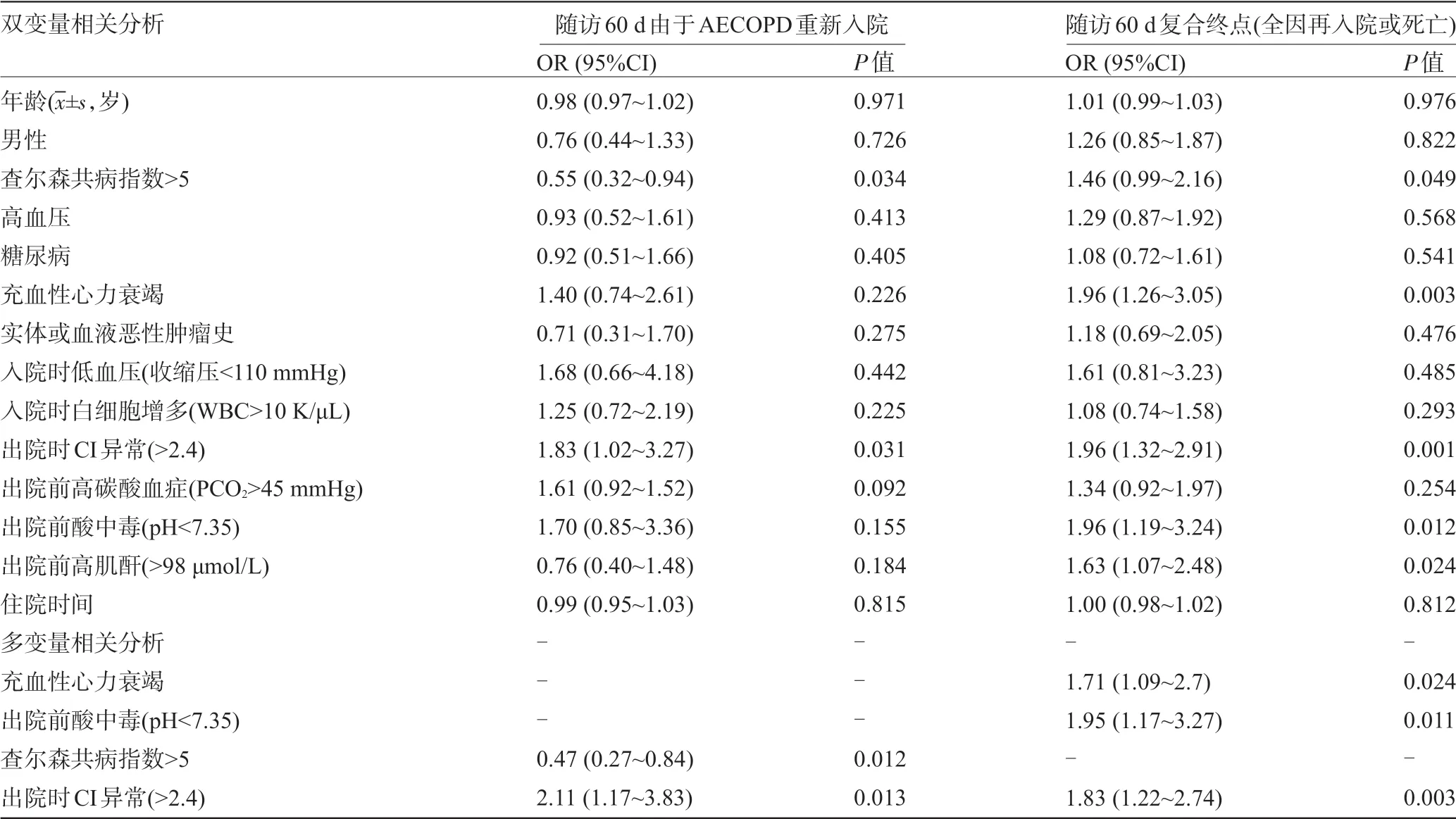
表2 人口统计学因素、共病性、入院时生命体征、实验室检查结果与60 d不良事件的双变量和多变量相关分析结果(n=108)
2.3 AECOPD 患者CI、查尔森共病指数与60 d AECOPD 导致的再入院率的关系 在所有查尔森共病指数四分位数中,CI异常与AECOPD导致的再入院风险增加相关(图1)。使用COX回归模型对每个CI亚组生成校正生存曲线,CI异常患者因AECOPD导致的再入院率(13.56%)显著高于CI 正常患者(8.16%)(P=0.034),见图2。
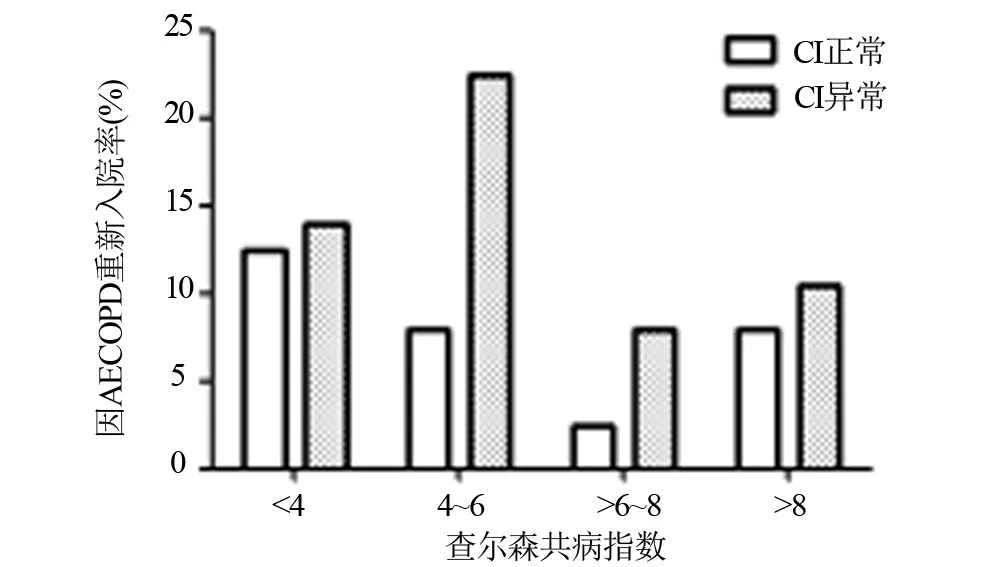
图1 CI、查尔森合并症指数与60 d因AECOPD再入院率之间的关系

图2 根据出院时CI 分组用高查尔森合并症指数校正AECOPD 患者60 d再入院的生存曲线
2.4 AECOPD患者CI、充血性心力衰竭、酸中毒与出院后60 d复合终点的关系 当模型中忽略CI时,充血性心力衰竭和出院前酸中毒是与两种不良结局相关的唯一变量。与无CI的模型相比,CI的加入显著改善了AUC(0.587~0.633,P=0.035)。CI、充血性心力衰竭和出院前酸中毒之间的关系如图3 所示,CI 异常与复合终点发生率增加相关。使用COX 回归模型对每个CI亚组生成校正生存曲线,CI异常患者因复合终点导致的再入院率(37.29%)显著高于CI 正常患者(16.33%)(P=0.014)(图4)。研究评估出院前CI 对出院后60 d 复合终点事件的预测价值:AUC 为0.615(95%CI:0.607~0.650),最适阈值为2.48,敏感性69.01%,特异性48.62%。
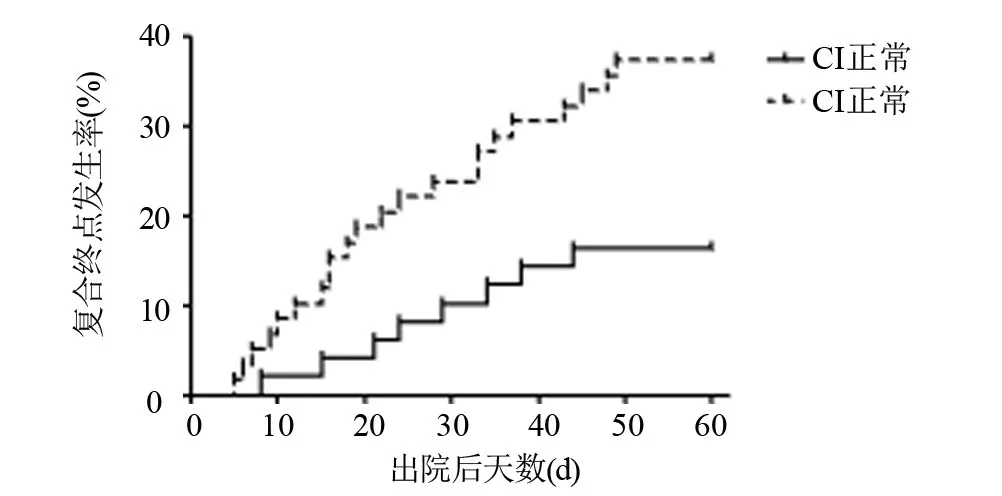
图4 根据出院时CI分组用充血性心力衰竭和出院前酸中毒校正60 d复合终点发生的生存曲线
3 讨论
AECOPD 严重影响患者的生活质量及预后[1]。AECOPD 导致的高再入院率是目前临床重点关注问题,如何减少AECOPD 患者再入院是当前研究的热点[3]。尽管许多人口学因素和合并症被认为是与早期再入院相关的重要危险因素,但尚无公开的算法将识别出的危险因素整合到可用于再入院预测的有效模型中[9]。确定需要再入院的AECOPD患者并在住院期间提前实施干预措施,对降低再入院率至关重要。
目前,仅有少数研究中提到了实验室指标在AECOPD 患者出院后危险分层中的指导价值,并证实pCO2是患者再入院的独立危险因素[10]。BAHADORI等[11]发现AECOPD 住院后高平均pCO2与再入院率之间存在显著相关性。此外,FUHRMAN等[12]认为pCO2是AECOPD患者住院后高死亡率的危险因素,但由于缺乏与AECOPD患者短期预后相关的客观变量,对降低再入院率极为困难。这项研究证明了CI 增加是一个稳健的独立的负性预后因素,与AECOPD住院后的不良结局相关,特别是与早期再入院率高相关。ROC分析表明,出院时CI的加入显著改善了充血性心力衰竭和出院前酸中毒预测出院后60 d 终点事件发生的AUC(0.587~063 3,P=0.035)。与以往的研究一致,充血性心力衰竭合并症和出院时酸中毒与再入院和死亡率相关[13]。值得注意的是,查尔森共病指数的增加与因AECOPD再入院率较低相关,而与全因导致的再入院率较高有关。这可以解释为病情较重的患者由于其他医疗状况差而使全因住院率升高,这些情况可能因AECOPD、药物治疗(例如皮质类固醇)或住院后继发的病情加重而恶化。
COPD的病理特征是气道重塑和由中性粒细胞和活化巨噬细胞组成的炎性细胞浸润[14]。研究发现,中性粒细胞与COPD 的发病有关,并且中性粒细胞在气道和组织中的浸润程度与COPD 的严重程度有关[6]。导致气道中性粒细胞积聚的机制还不清楚,目前认为它们可能与外周血中性粒细胞内流增强有关[6]。此外,COPD患者支气管分泌物中的髓过氧化物酶、弹性蛋白酶、IL-8 和LTB4 被认为是中性粒细胞的化学引诱剂[8]。EBC的取样为观察COPD患者和哮喘患者气道局部生化模式提供了一种无创、简便易行的方法,在健康人和COPD 患者的EBC 中也检测到中性粒细胞的一些化学引诱剂[15]。在稳定的COPD患者EBC中发现白三烯B4 浓度升高,并且在恶化期间进一步升高,而在抗生素治疗后逐渐减少[16]。此外,COPD患者呼出白细胞介素(IL)-6的增加被发现与EBC中性粒细胞的趋化活性有关[17]。然而,到目前为止对EBC的生物活性的研究却很少。本研究发现,出院时CI异常患者在随访60 d 因AECOPD 重新入院和复合终点发生情况均较CI正常患者高,并且进一步多变量相关分析显示CI 异常与复合不良结局以及AECOPD所致的再入院有关。表明COPD 急性发作期EBC 中性粒细胞趋化活性对预后产生影响。这些发现符合这样一个事实,即中性粒细胞性气道炎症确实是COPD 的一个主要特征。此外,由于吸烟已被证实增加了中性粒细胞的趋化活性,为了不受烟草的影响,本研究排除了吸烟者[18]。
总之,本研究证明AECOPD 患者出院时CI 升高与早期再入院和死亡率增加相关。CI 增加可能是患者中性粒细胞性气道炎症的一个重要指标。因此,CI参数可以提供有用的预测信息,并有助于高质量的出院决策。CI 值增加的患者应得到更密切和更深入的管理,以改善其临床结果。
