乳腺癌脊柱转移患者预后预测模型的构建
2020-11-06张伟滨沈宇辉
何 沁,张伟滨,沈宇辉
上海交通大学医学院附属瑞金医院骨科,上海200025
乳腺癌是女性最常见的恶性肿瘤,在病程中常发生远处转移,极大影响了患者的生存质量以及预后情况;在人体系统中,骨骼系统最易受累,而脊柱是最多发的骨转移部位[1]。乳腺癌脊柱转移会导致脊柱力学不稳定和脊髓神经受压,从而引发疼痛和感觉运动功能障碍,需要科学、及时的治疗。现有的乳腺癌脊柱转移治疗策略主要分为手术与非手术2 种,其中手术介入能够快速有效地解除局部疼痛、恢复脊柱稳定和神经功能。然而,考虑到手术的高风险性,并不是所有患者都适合进行手术治疗。为保证手术回报远大于其带来的风险和创伤就需要全面严谨的术前评估,而评估患者的生存预后是最基本,同时也是最关键的一步。
目前临床中主要依靠现有的脊柱转移瘤评分系统进行预后判断,以广泛应用的Tokuhashi 评分[2]为例,其从患者一般情况、脊柱外骨转移、脊柱骨转移、内脏转移、原发肿瘤类型以及脊髓瘫痪共6 个方面完成评估。然而,相关文献[3]表明,Tokuhashi 评分就乳腺癌脊柱转移患者的生存预测准确性差强人意,临床应用价值存疑;分析其原因,Tokuhashi 评分设计初衷为适用于多种原发肿瘤的脊柱转移患者,其仅考虑了原发肿瘤类型与生存的关系,而忽略了不同原发肿瘤的疾病特征与生物表型对预后的潜在影响。近年有研究[4]提出,不同激素受体表达的乳腺癌脊柱转移患者预后存在显著差异。综上考虑,对于乳腺癌脊柱转移患者,从原发灶特征与转移灶特征两方面建立特异的生存预测评分是大势所趋。
本研究回顾性分析乳腺癌脊柱转移患者的临床特征及生存情况,旨在探究脊柱转移后患者预后的影响因素,并构建相应的预后预测模型。
1 对象与方法
1.1 病例选择
选取2008 年1 月—2016 年1 月上海交通大学医学院附属瑞金医院收治的乳腺癌脊柱转移患者共160 例。本研究经上海交通大学医学院附属瑞金医院伦理委员会审核批准(伦理号RUIJIN2017NO173),并取得所有研究对象的知情同意书。
病例纳入标准:①患者为女性。②患者经组织病理学诊断为乳腺癌。③患者经组织病理学或CT、磁共振、骨扫描等影像学检查诊断为脊柱转移瘤。④患者随访时间至少为36 个月(以确诊乳腺癌脊柱转移为随访起始)。排除标准:①患者除乳腺癌以外还患有其他原发恶性肿瘤。② 患者未进行标准、科学的乳腺癌诊治。③患者失随访。
1.2 研究内容
回顾性收集患者的基本信息、疾病特征以及随访情况(随访间隔为3 个月,末次随访为2019 年1 月),包括患者年龄、一般情况、脊髓瘫痪情况、乳腺癌TNM 分期、肿瘤病理分级、激素受体表达情况、肿瘤标志物水平、骨转移灶分布、骨转移灶数量、脊柱转移间期、内脏转移情况、脊柱转移治疗情况、脊柱转移后总生存期等。就患者各临床特征对脊柱转移后总生存期的影响进行单因素和多因素生存分析,探究独立预后影响因素,并依据各因素回归系数的比值完成预后预测模型的构建。本研究中,应用卡氏评分(Karnofsky performance score,KPS)与Frankel分级评估患者一般情况和脊髓损伤情况。激素受体包括雌激素受体和孕激素受体,雌激素受体、孕激素受体阳性定义为免疫组织化学检测中≥1%的细胞核染色阳性,而雌激素受体阳性和(或)孕激素受体阳性定义为激素受体阳性。选取乳腺癌诊疗中常用的血清肿瘤标志物,包括糖类抗原15-3(carbohydrate antigen 15-3,CA15-3)、糖类抗原125(carbohydrate antigen 125,CA125)、癌胚抗原(carcinoembryonic antigen,CEA),并依据国际临床应用标准,以CA15-3 ≤25 U/mL、CA125 ≤35 U/mL、CEA ≤5 ng/mL 为正常范围。确诊乳腺癌至确诊脊柱转移的时间间隔为脊柱转移间期。确诊乳腺癌脊柱转移至患者死亡或末次随访日期的时间间隔为脊柱转移后总生存期。
1.3 统计学分析
采用SPSS 22.0 软件进行统计学处理。本研究中,将末次随访时存活的患者定义为删失,应用Kaplan-Meier 法分析患者的预后情况。依次采用Log-rank 检验(单因素分析)和Cox 比例风险回归模型法(多因素分析)分析患者临床特征与脊柱转移后总生存期的关系,并探究独立预后影响因素。依据Cox 分析中各预后影响因素的回归系数,定义最小回归系数对应影响因素的分值为1,并以最小回归系数为除数对其余回归系数进行取整,进而得出其余影响因素的具体分值。计算每位患者的预后评分总值并绘制各总分值的Kaplan-Meier 生存曲线,按照预后的差异合并归类,最终完成预后预测模型的构建。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 患者情况
本研究中,160 例乳腺癌脊柱转移患者平均年龄56.8 岁 (范围22 ~82 岁),中位随访时间40(24,55)个月。至末次随访日期,共有61 例患者仍存活,99 例患者已死亡,患者中位脊柱转移后总生存期为47 个月(95%CI37.9 ~56.1 个月)。
2.2 独立预后影响因素
就患者临床特征对脊柱转移后总生存期的影响进行单因素分析,结果如表1 所示,患者一般情况、脊髓瘫痪情况、激素受体表达情况、内脏转移情况、血清CA15-3水平、血清CA125 水平对患者预后存在显著影响(均P<0.05)。在进行多因素分析之前,先完成共线性诊断,结果显示,上述6 项影响因素的容忍度均大于0.1,方差扩大因子均小于10,证明不存在显著共线性问题[5],可纳入Cox 比例风险回归模型分析。
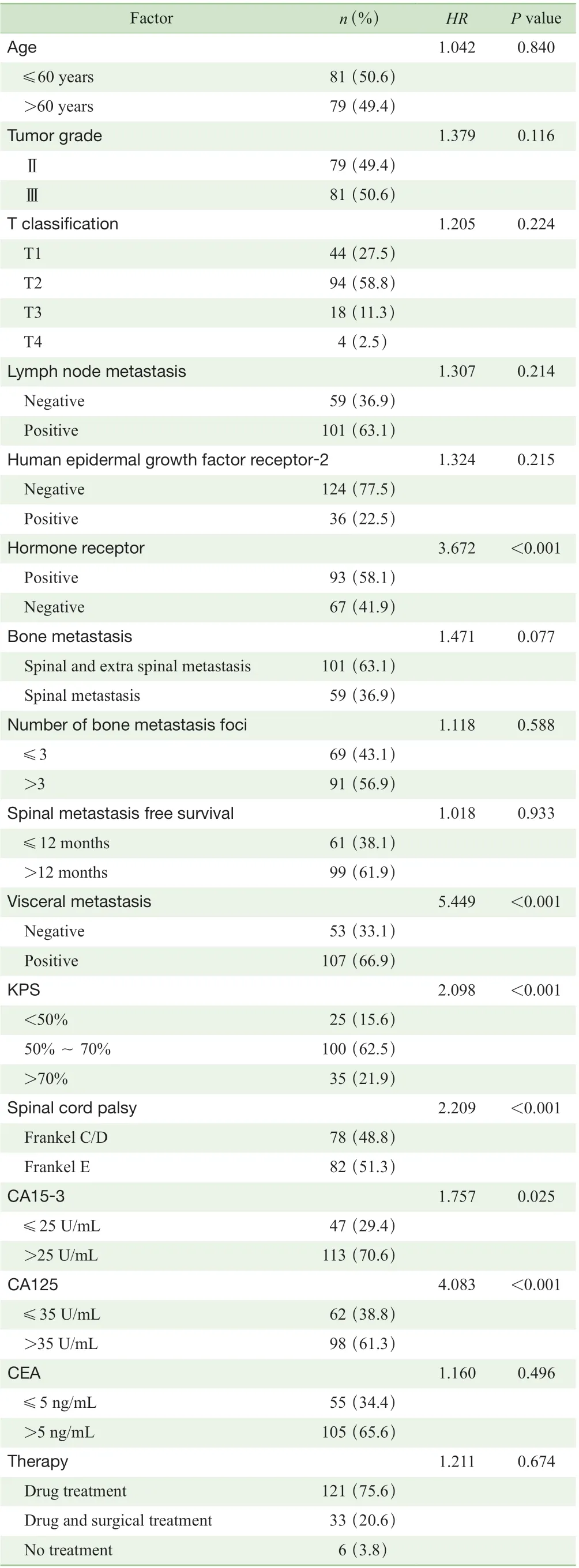
表1 乳腺癌脊柱转移患者预后影响因素的单因素分析Tab 1 Univariate analysis of prognostic factors for breast cancer patients with spinal metastasis
多因素分析结果如表2 所示,患者一般情况、激素受体表达情况、内脏转移情况、血清CA125 水平为乳腺癌脊柱转移患者的独立预后影响因素(均P<0.05),而脊髓瘫痪情况(P=0.139)和血清CA15-3 水平(P=0.611)对脊柱转移后总生存期的影响不具有统计学意义。
2.3 预后预测模型
纳入多因素分析证实的4 项独立预后影响因素为预测模型评分项目,包括患者一般情况、激素受体表达情况、内脏转移情况、血清CA125 水平,而各评分项目的分值由Cox 比例风险回归模型中各因素的回归系数比值决定。激素受体表达情况的回归系数最小,为0.897,以此作为除数,对其余3 项因素的回归系数进行取整,得出各因素的分值:KPS 评分>70%为0 分,50%~70%为1分,<50%为2 分;激素受体表达阳性为0 分,阴性为1分;内脏转移阴性为0 分,阳性为2 分;血清CA125 水平≤35 U/mL 为0 分,>35 U/mL 为1 分。计算患者4 项评分项目的总分,范围0 ~6 分,不同总分患者的Kaplan-Meier 生存曲线如图1 所示。整合归纳生存曲线分布相近的总分值,如表3 所示将患者分为低危组、中危组、高危组,3 组分值分别为0 ~1 分、2 ~4 分、5 ~6 分。低危组、中危组、高危组病例数分别为23 例、95 例、42 例, 3 组患者5 年生存率分别为100.0%、40.5%、3.2%。3 组患者的Kaplan-Meier 生存曲线如图2 所示,组间脊柱转移后总生存期差异具有统计学意义(P=0.000)。计算预后预测模型的Harrell C 值为0.748,提示该评分能够有效区分不同预后的患者。

表3 乳腺癌脊柱转移患者的预后预测模型分组Tab 3 Overall survival of breast cancer patients with spinal metastasis by prognostic algorithm

图1 不同总分值乳腺癌脊柱转移患者的Kaplan-Meier 生存曲线Fig 1 Kaplan-Meier survival curves of the breast cancer patients with spinal metastasis with different total scores
3 讨论
近年来,随着乳腺癌治疗技术的快速发展,包括内分泌治疗、分子靶向治疗、免疫治疗等,乳腺癌患者的预后不断改善,然而脊柱转移的发生率也逐步上升。乳腺癌脊柱转移灶多为溶骨性骨质破坏,常引发局部疼痛、感觉运动障碍等临床症状,极大影响了患者生存质量与预后情况;乳腺癌骨转移往往需要及时的治疗,而手术能够快速恢复脊柱稳定性、解除脊髓神经压迫,是当下主流的治疗策略。考虑到手术的高风险性和并发症,全面科学的术前评估尤为关键。Paton 等[6]和Laufer 等[7]均提出,良好的预后情况是手术治疗的基本条件。目前,已经建立了多种脊柱转移瘤生存预测评分,包括Tokuhashi 评分[2]、Tomita 评分[8]、Bauer 评分[9]等,但相关文献证明这些评分的准确性偏低。分析原因:Tokuhashi 等[10]认为,应综合考虑原发灶与转移灶两方面对患者预后的影响,针对不同的原发肿瘤提出不同的预后评分。因此,本研究旨在通过探究乳腺癌脊柱转移患者的预后影响因素,从而构建其特异的生存预测模型。
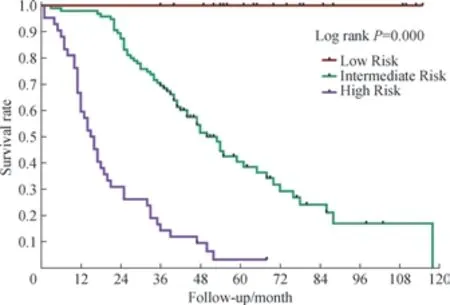
图2 不同风险组乳腺癌脊柱转移患者的Kaplan-Meier 生存曲线Fig 2 Kaplan-Meier survival curves of the breast cancer patients with spinal metastasis in different risk groups
本研究结果显示,患者一般情况、激素受体表达情况、内脏转移情况、血清CA125 水平为乳腺癌脊柱转移患者的独立预后影响因素。Tabouret 等[11]和Wibmer 等[12]的研究也证实,一般情况良好且无重要内脏受累的脊柱转移瘤患者的抵抗力和治疗耐受性较好,生存期较长。激素受体包括雌激素受体与孕激素受体,Sciubba 等[13]进行的meta 分析提示激素受体表达阴性与预后不佳紧密相关,与本研究结论一致。在乳腺癌的诊疗中,激素受体作为内分泌治疗的靶点起到了重要作用。对于激素受体阳性的患者,可以使用他莫昔芬、芳香化酶抑制剂阻断受体激活以及下游信号通路,抑制肿瘤的原位生长和远处转移。此外,激素受体表达水平越高,内分泌治疗的效果越好,体内肿瘤负荷越低,患者生存期随之延长[14]。CA125 作为一类广谱肿瘤标志物,与CA15-3 和CEA 共同被用于乳腺癌的诊疗,其血清浓度变化可提示肿瘤的进展与复发。有学者[15]发现CA125 能够促进免疫细胞凋亡以及下调免疫识别,从而参与肿瘤的早期发病与远处转移。血清CA125水平异常升高反映机体内肿瘤细胞增殖活跃,不利于患者的长期生存。值得注意的是,本研究多因素分析结果显示,骨转移灶特征与患者预后无显著关系;然而Parkes等[16]认为,多个骨转移病灶、中轴骨与四肢骨同时发生肿瘤侵犯均提示生存期缩短,因此关于骨转移灶特征与患者预后的关系还需要进行后续的研究验证。
本研究完成了乳腺癌脊柱转移患者脊柱转移后预后预测模型的构建,按生存期长短将患者依次分为低危组(0 ~1 分)、中危组(2 ~4 分)、高危组(5 ~6 分)。模型的Harrell C 值为0.748,预测效价高,能够较准确地区分预后差异,帮助临床医师制定个体化治疗策略。对于症状明显的低危组患者,其预计生存期长,一旦脊柱稳定性受损、脊髓神经压迫显著,在排除其余手术禁忌证的情况下,可积极进行手术治疗从而达到彻底的肿瘤切除和牢固的脊柱固定。对于症状明显的中危组患者,其预计生存期一般,开放手术的选择应格外谨慎,推荐选择安全快速的脊柱微创手术缓解症状,如经皮椎体成形术、经皮椎弓根螺钉固定术等[17]。此外,随着介入技术的发展,各类消融术逐渐成熟,也为治疗策略提供了一种可能性[18]。对于症状明显的高危组患者,其预计生存期短,往往不适合进行手术,推荐进行保守支持治疗减轻疼痛和改善神经功能,提升患者的生活质量。现常用的药物包括骨吸收抑制剂、消炎镇痛药、神经营养药等,同时局部理疗和支撑护具也具有较好的疗效。
综上所述,本研究证实患者一般情况、激素受体表达情况、内脏转移情况、血清CA125 水平为乳腺癌脊柱转移患者脊柱转移后总生存期的影响因素,其构成的预后预测模型能够较准确地预测此类患者的预后,有助于制定科学的治疗策略。
参·考·文·献
[1] Harries M, Taylor A, Holmberg L, et al. Incidence of bone metastases and survival after a diagnosis of bone metastases in breast cancer patients[J]. Cancer Epidemiol, 2014, 38(4): 427-434.
[2] Tokuhashi Y, Matsuzaki H, Oda H, et al. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis[J]. Spine, 2005, 30(19): 2186-2191.
[3] Kim J, Lee SH, Park SJ, et al. Analysis of the predictive role and new proposal for surgical strategies based on the modified Tomita and Tokuhashi scoring systems for spinal metastasis[J]. World J Surg Oncol, 2014, 12: 245.
[4] Wang M, Jensen AB, Morgen SS, et al. Survival analysis of breast cancer subtypes in patients with spinal metastases[J]. Spine, 2014, 39(19): 1620-1627.
[5] O'brien RM. A caution regarding rules of thumb for variance inflation factors[J]. Qual Quant, 2007, 41(5): 673-690.
[6] Paton GR, Frangou E, Fourney DR. Contemporary treatment strategy for spinal metastasis: the “LMNOP” system[J]. Can J Neurol Sci, 2011, 38(3): 396-403.
[7] Laufer I, Rubin DG, Lis E, et al. The NOMS framework: approach to the treatment of spinal metastatic tumors[J]. Oncologist, 2013, 18(6): 744-751.
[8] Tomita K, Kawahara N, Kobayashi T, et al. Surgical strategy for spinal metastases[J]. Spine, 2001, 26(3): 298-306.
[9] Bauer HC, Wedin R. Survival after surgery for spinal and extremity metastases. Prognostication in 241 patients[J]. Acta Orthop Scand, 1995, 66(2): 143-146.
[10] Tokuhashi Y, Uei H, Oshima M, et al. Scoring system for prediction of metastatic spine tumor prognosis[J]. World J Orthop, 2014, 5(3): 262-271.
[11] Tabouret E, Cauvin C, Fuentes S, et al. Reassessment of scoring systems and prognostic factors for metastatic spinal cord compression[J]. Spine J, 2015, 15(5): 944-950.
[12] Wibmer C, Leithner A, Hofmann G, et al. Survival analysis of 254 patients after manifestation of spinal metastases: evaluation of seven preoperative scoring systems[J]. Spine, 2011, 36(23): 1977-1986.
[13] Sciubba DM, Goodwin CR, Yurter A, et al. A systematic review of clinical outcomes and prognostic factors for patients undergoing surgery for spinal metastases secondary to breast cancer[J]. Global Spine J, 2016, 6(5): 482-496.
[14] Rastelli F, Crispino S. Factors predictive of response to hormone therapy in breast cancer[J]. Tumori, 2008, 94(3): 370-383.
[15] Nakamura H, Nishimura T. History, molecular features, and clinical importance of conventional serum biomarkers in lung cancer[J]. Surg Today, 2017, 47(9): 1037-1059.
[16] Parkes A, Warneke CL, Clifton K, et al. Prognostic factors in patients with metastatic breast cancer with bone-only metastases[J]. Oncologist, 2018, 23(11): 1282-1288.
[17] Bernard F, Lemée JM, Lucas O, et al. Postoperative quality-of-life assessment in patients with spine metastases treated with long-segment pedicle-screw fixation[J]. J Neurosurg Spine, 2017, 26(6): 725-735.
[18] Wallace AN, Robinson CG, Meyer J, et al. The metastatic spine disease multidisciplinary working group algorithms[J]. Oncologist, 2019, 24(3): 424.
