负载骨形态发生蛋白2 微球的可注射水凝胶的抑菌和成骨 性能评价
2020-11-06刘立立崔文国
刘立立,崔文国,
1. 苏州大学药学院,苏州 215000;2. 上海交通大学医学院附属瑞金医院,上海市伤骨科研究所,上海市中西医结合防治骨与关节病损重点实验室,上海 200025
骨髓炎是指细菌感染骨骼,形成炎性反应,累及单一或多处骨骼并导致骨质破坏的骨炎症性疾病[1]。高能量损伤导致的开放性骨折容易引发感染[2],形成死骨,进而导致骨折迁延不愈甚至骨髓炎发生。由于局部感染难以控制、成骨较困难,慢性骨髓炎更是难以治疗,从而导致高截肢率和高致残率[3]。目前,临床上常常全身应用抗生素治疗骨感染,但抗生素的广泛应用促使了耐甲氧西林金黄色葡萄球菌等耐药菌株的出现[4-5]。由于普通抗生素不能完全杀死耐药细菌,所以装载普通抗生素的植入材料在治疗骨感染中的价值有限[6]。因此,开发一种无耐药性且具有抗菌及骨再生作用的材料已成为骨感染治疗的迫切 需要。
水凝胶具有高含水量、良好的生物相容性和可调的机械性能等特点,是一种良好的骨组织再生支架材料[7]。各种功能性水凝胶均已开发并有望应用于临床,如细胞膜抗炎水凝胶[8]、响应性水凝胶[9]、黏附性水凝胶[10]、可注射水凝胶[11]、自愈合水凝胶[12]等。聚乙二醇[poly (ethylene glycol),PEG]水凝胶是基于美国食品药品管理局批准的聚乙二醇均聚物,由于其具有良好的生物相容性而被广泛应用于生物医学材料的研发[13]。Ag+交联的PEG 水凝胶具有优良的抗菌性能。然而,当PEG 水凝胶被植入机体后,成骨生物活性分子会快速释放,难以在病灶局部维持有效浓度,降低了成骨生物活性分子的生物利用度,促成骨作用差,且导致了昂贵的成骨生物活性分子的浪费。因此,有必要开发一种能增加目标组织中生物活性分子缓释性的水凝胶。
基于此,本研究利用Ag+和巯基(-SH)的配位交联原理,开发一种无活性基团的可注射、抗菌和自愈合的PEG 水凝胶,再使用微流控技术制备负载重组人骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)的光交联明胶微球,将两者混合从而构建负载BMP-2 微球的可注射水凝胶BMP/Gel/SH-Ag,并评价其抗菌和成骨性能。该体系具有如下优点:①BMP/Gel/SH-Ag 中的Ag+具有广谱抗菌性和优良的抗菌性能,可在一定程度上缓解抗生素滥用问题。②负载BMP-2 的明胶微球通过缓释作用,长期维持局部药物浓度,持续发挥促成骨作用。因此,BMP/Gel/SH-Ag 的载药系统在促成骨和抗感染方面有良好的表现,并有望在骨髓炎的预防中发挥作用。
1 材料与方法
1.1 实验材料和仪器
1.1.1 试剂 明胶(批号 180LB8,罗赛洛明胶有限公司),甲基丙烯酸酐(CAS 号760-93-0,阿拉丁试剂有限公司),2-羟基-4′-(2-羟基乙氧基)-2-甲基苯丙酮(CAS 号106797-53-9,北京百灵威科技有限公司),巯基化的聚乙二醇[4-arm thiol-terminated poly (ethylene glycol),4SH-PEG]( 批 号TZQ09095, 美 国Creative PEG Works;相对分子质量20 000),硝酸银溶液(批号20170808,国药集团化学试剂有限公司),红色钢笔墨水(货号 204,上海英雄有限公司),BMP-2(批号10426-HNAE,北京索莱宝科技有限公司),ELISA 试剂盒 (货号 70-EK1108-48,杭州联科生物技术股份有限公司),CCK-8试剂盒(货号CK04,日本Dojindo),氯化硝基四氮唑蓝/氯化硝基四氮唑蓝(nitrobluete trazolium chloride/5-bromo-4-chloro-3-indolyl phosphate,BCIP/NBT)碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(批号C3206,上海碧云天生物技术有限公司),SD 大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)成骨诱导培养基(货号RASMX-90021,赛业生物科技有限公司),α-MEN 培养基(货号30265.01,美国Hyclone)。
1.1.2 细胞和菌株 大鼠BMSCs(实验室自提取并分选鉴定),金黄色葡萄球菌(Staphylococcus aureus,S. aureus)和大肠埃希菌(Escherichia coli,E. coli)(货号Atcc43300、Atcc11229,北京陆桥技术股份有限公司)。
1.1.3 仪器 微流控装置(保定兰格恒流泵有限公司),荧光显微镜(德国Zeiss),扫描电子显微镜(scanning electron microscope,SEM)(日本Hitachi),酶标仪(美国BioTek)。
1.2 BMP/Gel/SH-Ag 的制备及表征
1.2.1 光交联明胶的制备 将10 g 明胶溶解在 100 mL 磷酸缓冲盐溶液(phosphate buffer saline,PBS)。待明胶完全溶解后,在60 ℃下,向锥形瓶内逐滴加入8 mL 甲基丙烯酸酐,滴加过程持续0.5 h。滴加结束2 h 后,将预热至50 ℃的400 mL PBS 加入锥形瓶中稀释溶液以停止反应,再持续搅拌30 min。之后将锥形瓶内的液体倒入透析袋中(截留相对分子质量8 000 ~14 000),透析2 周。 收集透析袋内的液体,冷冻干燥得到修饰后的光交联 明胶。
1.2.2 光交联明胶微球的制备 微流控技术用于制备负载BMP-2 的光交联明胶微球(图1)。简而言之,制备明胶微球,向10.0%(质量分数)的光交联明胶溶液加入2.5%的BMP-2,再加入1.0% 2-羟基-4′-(2-羟基乙氧基)-2-甲基苯丙酮(光引发剂) 和0.25%的海藻酸钠作为分散相,含有15.0%山梨醇酐单油酸酯的肉豆蔻酸异丙酯作为连续相。将2 种相分别注入微通道,分散相形成单分散液滴。调节分散相和连续相的流速以获得直径约350 μm 的液滴。收集的油包水型乳状液在紫外光(365 nm)照射15 s 后聚合成光交联明胶微球(图1)。
1.2.3 BMP/Gel/SH-Ag 的 制 备 称 取4SH-PEG 10 mg,溶 解 于50 μL 去 离 子 水,再 加 入40 μL 负 载BMP-2 的光交联明胶微球。将30 μL 硝酸银溶液(0.1 mol/L)用20 μL 去离子水稀释。将2 种液体混合,其在数秒后形成负载光交联明胶微球的水凝胶BMP/Gel/SH-Ag(图1)。称取4SH-PEG 10 mg,溶解于50 μL 含有1 mg BMP-2 的去离子水中,再与硝酸银溶液混合,以类似方式制备负载BMP-2 的水凝胶BMP/SH-Ag。
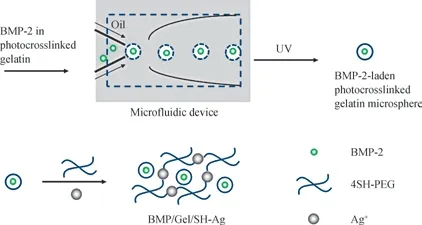
图1 BMP/Gel/SH-Ag 形成的示意图Fig 1 Schematic formation of BMP/Gel/SH-Ag
1.2.4 BMP/Gel/SH-Ag 的表征 利用SEM 对冷冻干燥后的水凝胶进行评价。切取冷冻干燥2 d 的厚度为2 mm 的水凝胶片,固定在导电板上,采用离子溅射仪对其进行45 s 喷金处理,最后利用SEM 采集图像。为了考察BMP/Gel/SH-Ag 和BMP/SH-Ag 的释药行为,将每组3 个样品浸没于PBS 中,于转速为100 转/min、37 ℃的摇床中进行药物释放实验。温育1、2、4、6、8 d 取释放介质,用ELISA 试剂盒测定BMP-2 的释放量。用1 mL 注射器(针头直径0.5 mm)注射携带红色钢笔墨水的BMP/Gel/SHAg,观察BMP/Gel/SH-Ag的可注射性。用琼脂扩散法测试水凝胶抗菌性能。将100 μLS. aureus和100 μLE. coli[吸光度值D(600 nm)约0.07]分别分散到LB 琼脂平板上。分别将BMP/Gel/SH-Ag 和BMP/SH-Ag 置于琼脂平板上并在37 ℃下温育24 h,每组3 个样品,观察水凝胶样品周围的细菌环并于24 h 测定抑菌环直径。
1.3 细胞实验
1.3.1 CCK-8 收 集BMP/Gel/SH-Ag 和BMP/SH-Ag 的 浸出液,加至铺有BMSCs 的96 孔板中(5 000 个/孔),分别于第1、3、5 日去除培养液,用PBS 洗涤2 次,每孔加入100 μL 培养基和10 μL CCK-8 试剂,放入培养箱避光孵育2 h。酶标仪450 nm 波长下检测吸光度值[D(450 nm)]。以使用α-MEM 培养基培养的BMSCs 作为对照组。每组3个样品。
1.3.2 活/死细胞染色 使用BMP/Gel/SH-Ag 和BMP/SH-Ag 的 浸 出 液 于24 孔 板 中 培 养BMSCs(30 000 个/孔)。以使用α-MEM 培养基培养的BMSCs 作为对照组。每组3 个样品。培养1 d 后,去除培养液,用PBS 洗涤3 次。 将5 μL 钙黄绿素和20 μL 溴乙非啶豪莫二聚体分别加入10 mL PBS,配制成活/死细胞染色溶液。将200 μL 活/死细胞染色溶液加入每孔中,室温避光孵育30 min,去除染色溶液,PBS 洗涤2 次,用荧光显微镜采集图像。
1.3.3 ALP 测定 将大鼠BMSCs 接种在24 孔Transwell板中(30 000 个/孔),并加入α-MEM 培养基进行培养。1 d 后,分别将BMP/Gel/SH-Ag、BMP/SH-Ag 放于Transwell 板的上室中,不加入水凝胶材料的BMSCs 作为对照组,每组3 个样品,并用成骨诱导培养基替代α-MEM 培养基。14 d 后,PBS 洗涤2 次,无水乙醇于室温下固定细胞30 min,去离子水洗涤3 次,加入ALP 染色液。在室温下避光孵育30 min 后,去离子水洗涤,用光学显微镜采集图像。
1.3.4 茜素红S 染色 将大鼠BMSCs 接种在24 孔Transwell 板中(30 000 个/孔),并加入α-MEM 培养基进行培养。1 d 后,将BMP/Gel/SH-Ag、BMP/SH-Ag 放于Transwell 板的上室中,不加入水凝胶材料的BMSCs 作为对照组,每组3 个样品,并用成骨诱导培养基替代α-MEM 培养基。21 d 后,PBS 洗涤2 次,无水乙醇于室温下固定细胞 30 min,去离子水洗涤3 次,加入茜素红S 染色液。在室温下孵育10 min 后,去离子水洗涤2 次,用显微镜采集图像。
1.4 统计学分析
2 结果
2.1 BMP/Gel/SH-Ag 的考察
2.1.1 BMP/Gel/SH-Ag 的外观、微观结构和药物释放 光交联明胶微球外表光滑,粒径分布均匀(~350 μm)(图2A)。将稀释后的硝酸银溶液加入4SH-PEG 溶液中, 2 种溶液在数秒后形成淡黄色的BMP/Gel/SH-Ag(图2B)。SEM 结果显示,BMP/Gel/SH-Ag 和BMP/SH-Ag 都呈现孔洞状的微观结构,孔径为50 ~150 μm(图2C、2D)。在药物释放考察中,BMP/Gel/SH-Ag 和BMP/SH-Ag 在第8 日分别释药(81.8±3.6)%和(84.4±3.2)%(图2E)。相较于BMP/SH-Ag,BMP/Gel/SH-Ag 具有更好的缓释效果。
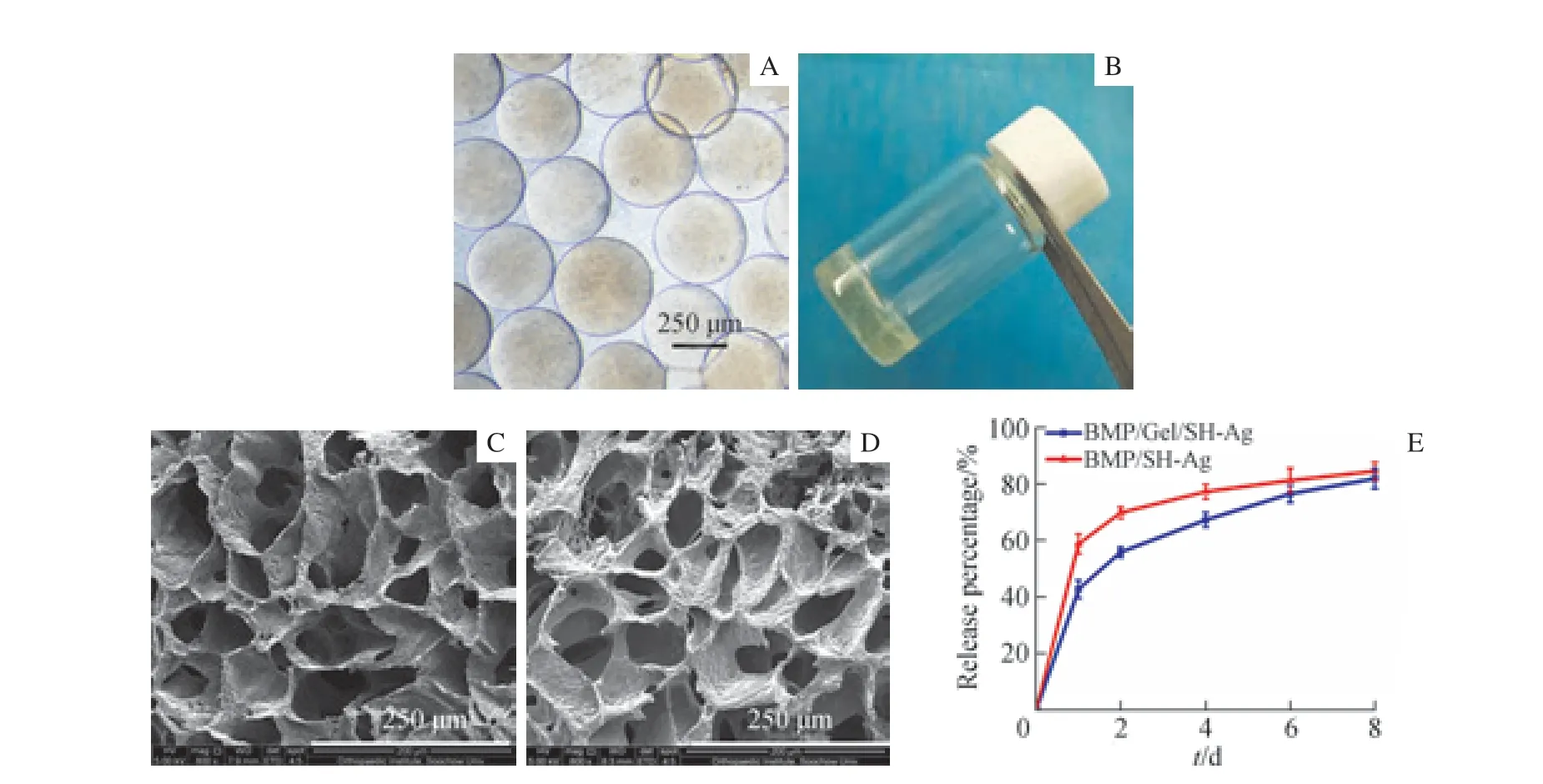
图2 光交联明胶微球及BMP/Gel/SH-Ag 形态和药物释放Fig 2 Morphology of photocrosslinked gelatin microspheres and BMP/Gel/SH-Ag and the drug release profile
2.1.2 BMP/Gel/SH-Ag 的可注射性 BMP/Gel/SH-Ag 可以用针头直径小至0.5 mm 的1 mL 注射器来注射,以产生水凝胶细丝(图3),从而能够较好地填充骨感染区域。

图3 红色墨水染色的BMP/Gel/SH-Ag 水凝胶的注射性Fig 3 Injectability of red ink-dyed BMP/Gel/SH-Ag
2.1.3 BMP/Gel/SH-Ag 的抗菌性能 BMP/Gel/SH-Ag 和BMP/SH-Ag 分别置于涂有S. aureus和E. coli的琼脂板1 d 后,均出现了抑菌环,表明BMP/Gel/SH-Ag 和BMP/SH-Ag 对S. aureus(图4A、B)和E. coli(图4D、E)有抑制作用。BMP/SH-Ag 的抗菌效果与BMP/Gel/SH-Ag 相当,抑菌环直径差异无统计学意义(图4C、F)。
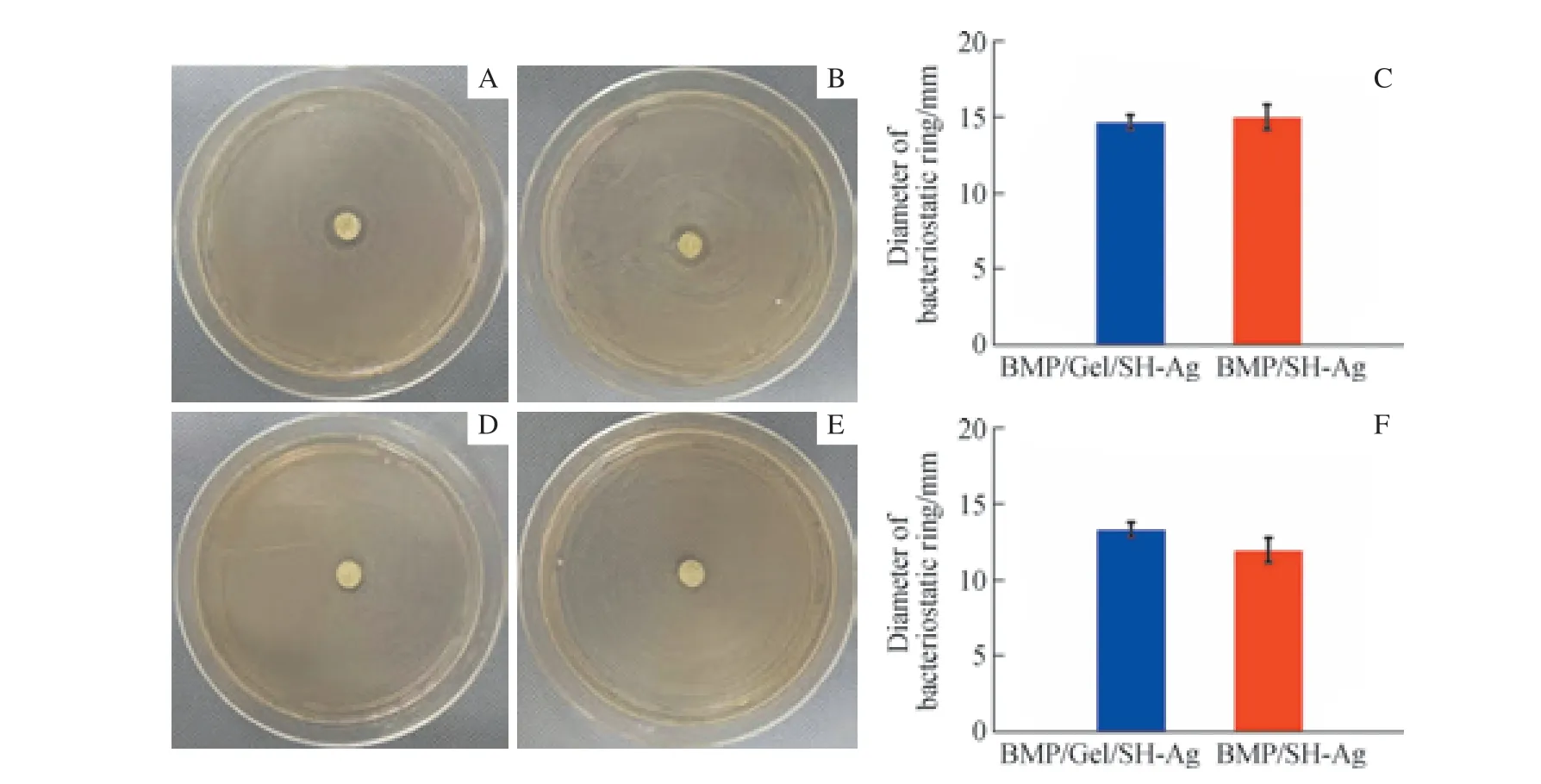
图4 BMP/Gel/SH-Ag 及BMP/SH-Ag 的抗菌性能Fig 4 Antibacterial properties of BMP/Gel/SH-Ag and BMP/SH-Ag
2.2 BMP/Gel/SH-Ag 的生物相容性
为了研究BMP/Gel/SH-Ag 的生物相容性,使用CCK-8 实验考察BMP/Gel/SH-Ag 和BMP/SH-Ag 浸出液对BMSCs 增殖的影响。CCK-8 结果显示,在第1、3、5日,BMP/Gel/SH-Ag 组和BMP/SH-Ag 组的吸光度值略低于对照组,但各组吸光度值之间的差异无统计学意义(图5A)。观察BMSCs 存活情况,发现BMP/Gel/SH-Ag 组、BMP/SH-Ag 组和对照组的细胞生长状态良好(图5B),进一步证明了BMP/Gel/SH-Ag 的生物安全性。
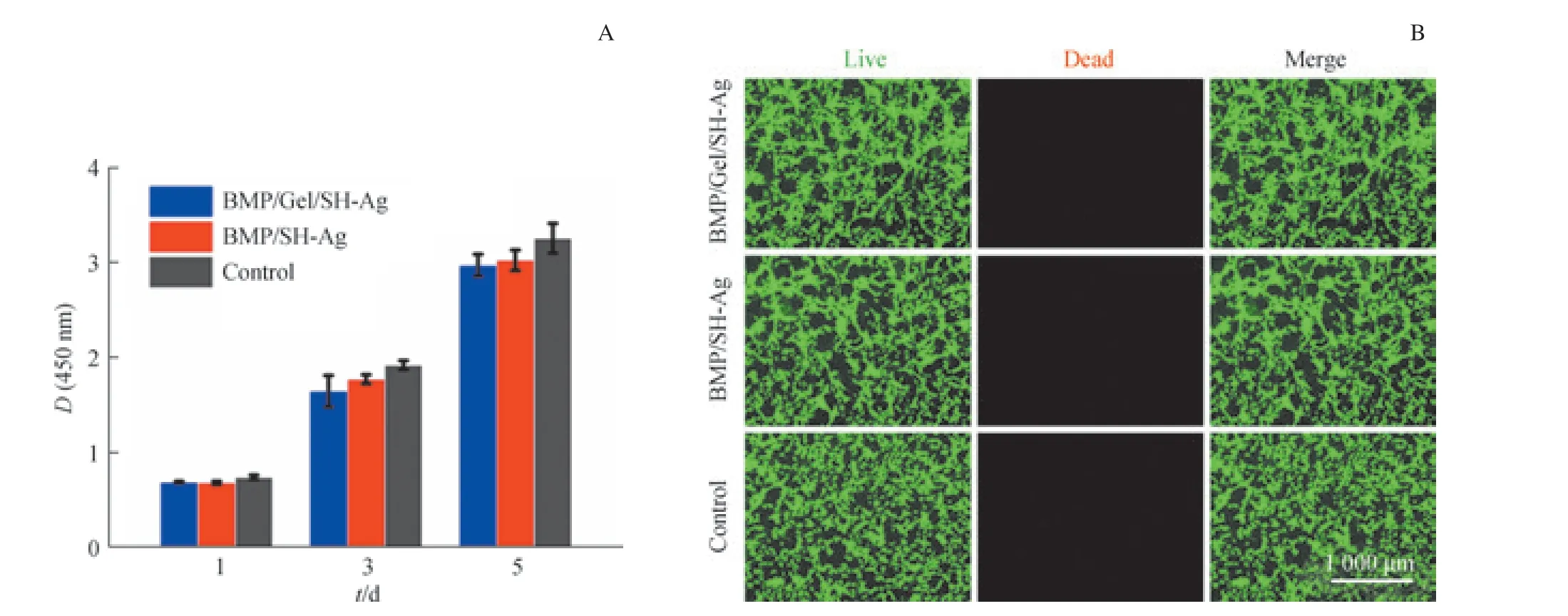
图5 BMP/Gel/SH-Ag 及BMP/SH-Ag 的生物相容性Fig 5 Biocompatibility of BMP/Gel/SH-Ag and BMP/SH-Ag
2.3 BMP/Gel/SH-Ag 的促成骨分化
采用ALP 染色和茜素红S 染色对BMP/Gel/SH-Ag 和BMP/SH-Ag 的促成骨分化能力进行评价。ALP 染色越深,表示其活性越高。BMSCs 在成骨诱导培养基中培养14 d后,BMP/Gel/SH-Ag 组的ALP 活性高于BMP/SH-Ag 组和对照组(图6),表明BMP/Gel/SH-Ag 的促成骨能力要强于BMP/SH-Ag。
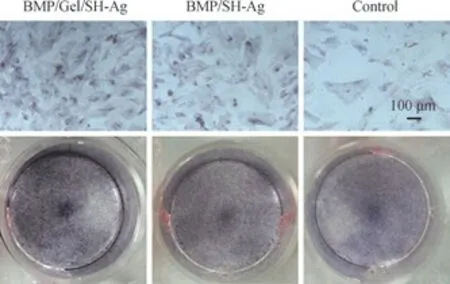
图6 BMSCs 的ALP 染色情况Fig 6 ALP staining images of the BMSCs
在成骨分化后期,成骨细胞分泌矿化基质,形成的钙结节可被茜素红S 染成橘红色。BMSCs 在成骨诱导培养基中培养21 d 后,BMP/Gel/SH-Ag 组的钙结节水平高于BMP/SH-Ag 组和对照组 (图7),表明BMP/Gel/SH-Ag 的促成骨分化能力高于BMP/SH-Ag。
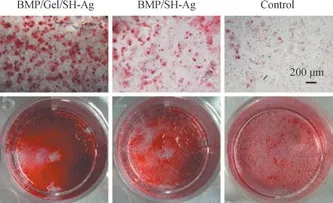
图7 BMSCs 的茜素红S 染色情况Fig 7 Alizarin red staining images of the BMSCs
3 讨论
本研究基于Ag+和-SH 之间的配位反应,制备了一种4SH-PEG 和Ag+交联的PEG 水凝胶。然而,单纯负载BMP-2 的水凝胶无法延缓BMP-2 释放,导致BMP-2 的生物利用度降低。因此,在PEG 水凝胶中复合了装载有BMP-2 的光交联明胶微球,利用微球水凝胶的缓释作用在局部持续递送BMP-2 以促进感染性骨损伤的修复。
微球是指药物分散在成球材料中,形成的骨架型微小球形微粒,可以供注射、口服、滴鼻或皮下埋植使用[14]。根据其制备材料的不同,分为天然高分子微球、合成高分子微球和无机微球。由于广泛分布于自然界且具有良好的生物相容性,天然高分子成为备受欢迎的制备微球的材料。常用天然高分子材料包括多糖、明胶、类聚异戊二烯、聚酯、聚酚。明胶是动物结缔组织或表皮组织中的胶原降解的产物,具有非常低的抗原性[15]。分子内部含有丰富精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)序列,对细胞的黏附和迁移有促进作用[16]。因此,明胶微球不但可以发挥药物载体的作用,还可以促进细胞黏附和迁移。目前,明胶微球可以负载药物、生长因子和细胞。Kudva 等[17]通过明胶微球负载转化生长因子β1 (transforming growth factor-β1,TGF-β1)在体外促进软骨形成。Zhao 等[18]通过制备负载BMSCs 的明胶微球促进成骨;明胶微球可在靶部位释放至BMSCs,并促进其分化。因此,明胶微球已经成为一种极具吸引力的生物医用材料。
微流控技术比传统的机械搅拌乳化技术更具优越性。本研究用甲基丙烯酸酐与明胶中的氨基进行化学反应,合成了光交联明胶,并用微流控装置制备了负载BMP-2 的明胶微球。该微流控装置产生的液滴具有高度的单分散性和大小可控的特点。光交联明胶溶液和油相的流速是控制微球尺寸的重要因素。通过改变光交联明胶溶液与油相速率的比值可调节明胶微球粒径的大小。对于负载药物的微球载体而言,微球的粒径越大,药物缓释效果越好。Zhao 等[18]制备负载BMSCs 的明胶微球。其选择163 μm的微球尺寸是为了平衡2 个要求:尺寸大于60 μm,可确保有足够数量的封装细胞以促进细胞接触和增殖[19];小于200 μm,可允许通过水凝胶随时进行氧气交换,以实现细胞的长期存活[20]。而本研究采用的尺寸 (约350 μm)是为了确保单个微球能够负载足量的BMP-2 以提升缓释效果。
本研究将稀释后的Ag+溶液加入负载光交联明胶微球的4SH-PEG 溶液中,2 种溶液在数秒后形成BMP/Gel/SHAg。其机制可能是通过Ag-S 和二硫键的作用,形成了相互交错的水凝胶网络[21]。BMP/Gel/SH-Ag 和BMP/SH-Ag都呈现孔洞状结构,孔径相对较大,可能是由于内部化学交联程度不高所致。BMP/Gel/SH-Ag 可以用注射器注射来产生水凝胶细丝,具有优良的可注射性,能通过微创的方式更好地填充骨感染区域。但是当注射的水凝胶面临恒定的机械力时,可能导致变形或损坏。在这种情况下,拥有自我修复功能的水凝胶将拥有更长的应用寿命[22]。Cai等[23]通过双重交联的方法制备了一种负载干细胞的可注射水凝胶来提高细胞的存活率。当水凝胶被注射时,星形多肽-聚乙二醇共聚物与工程重组蛋白组装形成的物理网络会被破坏;但当注射完成后,物理网络能够重新形成。而BMP/Gel/SH-Ag 可能可以通过恢复损伤的水凝胶碎片来实现自愈合。此外,这种水凝胶还可以允许医师在预先不知道缺损的情况下填充复杂的形状,例如,其可应用于复杂骨折的治疗[24]。这可能是因为当BMP/Gel/SH-Ag 水凝胶受到剪切力时,Ag+与SH 的配位键会断裂;而当剪切力消失时,Ag+与SH 的配位键重新恢复。
BMP/Gel/SH-Ag 和BMP/SH-Ag 对S. aureus和E. coli均有抑制作用。这是由于BMP/Gel/SH-Ag 和BMP/SH-Ag释放的Ag+能够干扰细菌膜通透性、抑制呼吸酶活性和使DNA 分子凝聚[25]。Guo 等[26]通过Ag+交联鞣酸(tannin)制备一种可注射的抗菌黏性水凝胶。因为Ag+在水凝胶中不仅用作抗菌剂,而且还用作水凝胶的交联剂,使得水凝胶具有优良的抗菌性能和生物相容性。Tian 等[27]用无毒抗菌剂(Fe3+)与乙二胺四乙酸交联透明质酸制备了可自愈合的抗菌水凝胶。作为交联剂的一部分,Fe3+可填充整个水凝胶,大大提高了抗菌剂的负载量,延长了抗菌剂的有效期,使水凝胶能够持续释放抗菌剂,直到水凝胶被完全分解。BMP/Gel/SH-Ag 中的Ag+同样作为水凝胶的抗菌剂和交联剂。将抗菌的金属离子作为水凝胶的交联剂不仅可以提高抗菌剂的负载量,提高抗菌性能,而且还可以延长抗菌的有效期。这是由于金属离子与其他化合物的化学键作用限制了金属离子的释放。因此,BMP/Gel/SH-Ag是具有优良的抗菌性能的骨修复生物材料。
作为促成骨和抗感染的生物材料,BMP/Gel/SH-Ag 的生物相容性十分重要。而BMP/Gel/SH-Ag 中的Ag+有较低的生物毒性,同时也有研究[28]表明当Ag+在涂层中的装载量低于9.0 μg/cm2时,材料无细胞毒性。本研究中,BMP/Gel/SH-Ag 装载的Ag+远低于这一细胞毒性阈值。此外,Ag+还用作水凝胶的交联剂。与直接在水凝胶中装载Ag+相比, BMP/Gel/SH-Ag 中的Ag+与4SH-PEG 结合,导致Ag+释放较慢,降低了Ag+的毒性。4SH-PEG 本身良好的生物相容性也可能对此有所贡献。CCK-8 和活/死细胞染色实验结果印证了BMP/Gel/SH-Ag 对于BMSCs 没有毒性作用。
尽 管BMP/Gel/SH-Ag 和BMP/SH-Ag 中BMP-2 的 装载量一致,BMP/Gel/SH-Ag 组的ALP 表达量和产生的钙结节数量均高于BMP/SH-Ag 组。这些结果印证了BMP/Gel/SH-Ag 装载光交联明胶微球的缓释作用提升了BMP-2的生物利用度。Li 等[29]研发了一种负载辛伐他汀微球的水凝胶系统,在体外释放实验的第3 日,未负载微球的水凝胶释放近75%的药物,而负载微球的水凝胶释放近37%的药物,表明微球可增强药物的缓释作用。而相较于BMP/SH-Ag、BMP/Gel/SH-Ag 的BMP-2 的释放需要突破2 层屏障,首先BMP-2 要从微球释放到水凝胶,然后释放到水中。因此,BMP/Gel/SH-Ag 具有更好的缓释效果。
综上,本研究通过微流控技术制备负载BMP-2 的光交联明胶微球;为了实现BMP-2 的缓释,将光交联明胶微球负载到4SH-PEG 和Ag+交联的PEG 水凝胶中,制备出BMP/Gel/SH-Ag。体外试验表明,BMP/Gel/SH-Ag 具有优良的抗菌性能、可注射性、生物相容性和促成骨分化性能。因此,这种负载BMP-2 微球的可注射水凝胶在促成骨和抗感染方面有良好的表现,有望在骨髓炎的预防中发挥作用。
参·考·文·献
[1] Lew DP, Waldvogel FA. Osteomyelitis[J]. Lancet, 2004, 364(9431): 369-379.
[2] 虞伟琴, 谢垒, 钱小毛. 开放性骨折患者手术部位感染的危险因素分析[J]. 中国骨与关节损伤杂志, 2017, 32(5): 550-551.
[3] Maffulli N, Papalia R, Zampogna B, et al. The management of osteomyelitis in the adult[J]. Surgeon, 2016, 14(6): 345-360.
[4] Kullar R, Sakoulas G, Deresinski S, et al. When sepsis persists: a review of MRSA bacteraemia salvage therapy[J]. J Antimicrob Chemother, 2016, 71(3): 576-586.
[5] Byrne FM, Wilcox MH. MRSA prevention strategies and current guidelines[J]. Injury, 2011, 42(Suppl 5): S3-S6.
[6] Li Y, Liu LN, Wan P, et al. Biodegradable Mg-Cu alloy implants with antibacterial activity for the treatment of osteomyelitis:in vitroandin vivoevaluations[J]. Biomaterials, 2016, 106(6): 250-263.
[7] Kim SH, Lee HR, Yu SJ, et al. Hydrogel-laden paper scaffold system for origami-based tissue engineering[J]. Proc Nat Acad Sci U S A, 2015, 112(50): 15426-15431.
[8] Fan ZY, Deng JJ, Li PY, et al. A new class of biological materials: cell membrane-derived hydrogel scaffolds[J]. Biomaterials, 2019, 197(44): 244-254.
[9] Yu YB, Feng RX, Yu SH, et al. Nanostructured lipid carrier-based pH and temperature dual-responsive hydrogel composed of carboxymethyl chitosan and poloxamer for drug delivery[J]. Int J Biol Macromol, 2018, 114(29): 462-469.
[10] Hong S, Pirovich D, Kilcoyne A, et al. Supramolecular metallo-bioadhesive for minimally invasive use[J]. Adv Mater, 2016, 28(39): 8675-8680.
[11] Wang K, Han ZC. Injectable hydrogels for ophthalmic applications[J]. J Control Release, 2017, 268(39): 212-224.
[12] Hsieh FY, Han HW, Chen XR, et al. Non-viral delivery of an optogenetic tool into cells with self-healing hydrogel[J]. Biomaterials, 2018, 174(23): 31-40.
[13] Hoogenboom R, Schubert U, Fischer DC, et al. Poly(ethylene glycol) in drug delivery: pros and cons as well as potential alternatives[J]. Angew Chem Int Ed Engl, 2010 , 49(36): 6288-6308.
[14] 陆新月, 吕慧侠. 微球给药系统载体材料的研究进展[J]. 中国药科大学学报, 2018, 49(5): 528-536.
[15] Santoro M, Tatara AM, Mikos AG. Gelatin carriers for drug and cell delivery in tissue engineering[J]. J Control Release, 2014, 190(17): 210-218.
[16] Wang HN, Boerman OC, Sariibrahimoglu K, et al. Comparison of micro-vs. nanostructured colloidal gelatin gels for sustained delivery of osteogenic proteins: bone morphogenetic protein-2 and alkaline phosphatase[J]. Biomaterials, 2012, 33(33): 8695-8703.
[17] Kudva AK, Dikina AD, Luyten FP, et al. Gelatin microspheres releasing transforming growth factor drivein vitrochondrogenesis of human periosteum derived cells in micromass culture[J]. Acta Biomater, 2019, 90(12): 287-299.
[18] Zhao X, Liu S, Yildirimer L, et al. Injectable stem cell-laden photocrosslinkable microspheres fabricated using microfluidics for rapid generation of osteogenic tissue constructs[J]. Adv Funct Mater, 2016, 26(17): 2809-2819.
[19] Shah RK, Shum HC, Rowat AC, et al. Designer emulsions using microfluidics[J]. Mater Today, 2008, 11(4): 18-27.
[20] Herrero EP, Valle EMMD, Galán MA. Immobilization of mesenchymal stem cells and monocytes in biocompatible microcapsules to cell therapy[J]. Biotechnol Prog, 2007, 23(4): 940-945.
[21] Chen H, Cheng RY, Zhao X, et al. An injectable self-healing coordinative hydrogel with antibacterial and angiogenic properties for diabetic skin wound repair[J]. NPG Asia Mater, 11(1): 32-38.
[22] Li L, Yan B, Yang JQ, et al. Novel mussel-inspired injectable self-healing hydrogel with anti-biofouling property[J]. Adv Mater, 2015, 27(7): 1294-1299.
[23] Cai L, Dewi RE, Heilshorn SC. Injectable hydrogels within situdouble network formation enhance retention of transplanted stem cells[J]. Adv Funct Mater, 2015, 25(9): 1344-1351.
[24] Rahman CV, Saeed A, White LJ, et al. Chemistry of polymer and ceramic-based injectable scaffolds and their applications in regenerative medicine[J]. Chem Mater, 2012, 24(5): 781-795.
[25] Liu JY, Sonshine DA, Shervani S, et al. Controlled release of biologically active silver from nanosilver surfaces[J]. ACS Nano, 2010, 4(11): 6903-6913.
[26] Guo JS, Sun W, Kim JP, et al. Development of tannin-inspired antimicrobial bioadhesives[J]. Acta Biomater, 2018, 72(11): 35-44.
[27] Tian R, Qiu XY, Yuan PY, et al. Fabrication of self-healing hydrogels with ondemand antimicrobial activity and sustained biomolecule release for infected skin regeneration[J]. ACS Appl Mater Interfaces, 2018, 10(20): 17018-17027.
[28] He M, Wang Q, Zhang J, et al. Substrate-independent Ag-nanoparticleloaded hydrogel coating with regenerable bactericidal and thermoresponsive antibacterial properties[J]. ACS Appl Mater Interfaces, 2017, 9(51): 44782-44791.
[29] Li XW, Liu XH, Ni SL, et al. Enhanced osteogenic healing process of rat tooth sockets using a novel simvastatin-loaded injectable microsphere-hydrogel system[J]. J Cranio-Maxillofac Surg, 2019, 47(7): 1147-1154.
