miR-181a通过调控Toll样受体参与儿童过敏性紫癜肾炎PS/iPS的激活
2020-11-06王彩芳陈瑞珊
王彩芳,么 鑫,陈瑞珊
(开滦总医院儿科,唐山 063000;*通讯作者,E-mail:pbaby0227@163.com)
儿童过敏性紫癜(Henoch-Schonlein purpura,HSP)是一种较常见的微血管变态反应性出血性疾病,主要表现为皮肤紫癜以及胃肠道和关节受累。儿童过敏性紫癜重要的并发症是过敏性紫癜性肾炎(Henoch-Schonlein purpura nephritis,HSPN),其易反复,且治疗复杂,致使部分患儿走向透析之路,需要昂贵的费用,给家庭和社会带来沉重的经济负担[1]。
黏膜免疫被认为在HSP的启动过程中起着关键作用,与上呼吸道或胃肠道感染有着密切的联系。很多HSPN患儿临床表现为上呼吸道感染和肉眼血尿。上呼吸道感染可以激活黏膜免疫[2]。黏膜免疫是由识别病原相关分子模式(PAMPS)受体参与的免疫调节过程,这些PAMPS主要在细菌、病毒和真菌起源的病原体上表达,其中最常见的代表是Toll样受体(TLR)[3]。TLR是I型跨膜糖蛋白,与配体结合后触发级联反应,激活核因子κB(NF-κB)和干扰素调节因子(IRF)[4]。干扰素途径可以通过将蛋白酶体(PS)机制转换为免疫蛋白酶体(iPS),从而激活树突状细胞成熟并迁移至淋巴结,进一步催化β1,β2,β5转化为低分子量蛋白质(LMP2和LMP7)和内肽酶样复合物(MECL-1),从而导致T淋巴细胞活化。IRF和NF-κB诱导黏附分子、炎性细胞因子和趋化因子的转录,在免疫应答中起着关键作用。黏膜相关免疫系统以及适应性免疫系统由调节性T(Treg)细胞系统控制,通过反馈机制避免T细胞过度活化。FoxP3可以反映这种调节活性。而Th17通过产生白细胞介素17(IL-17)[5],抑制FoxP3的表达水平,进一步抑制Treg细胞[6],从而发挥促炎活性。
miR181a是一种与血管炎性反应有关的miRNA,并且在小细胞肺癌、结肠癌等恶性肿瘤中呈现高表达的趋势[7]。miR181a可以负向调控Prospero同源蛋白1(Prospero homeobox protein 1,PROX1),PROX1生理条件下可以维持血管内皮细胞的稳定,减少血液中有害物质以及免疫蛋白复合物在血管中的黏附作用。此外,miR181a还可以诱导细胞凋亡,参与凋亡相关信号通路的激活[8]。
本课题组在先前的研究中发现,在HSPN患儿血清中的miR-181a的表达水平高于HSP-nonN的患儿。miR-181a是一种与血管炎性反应有关的miRNA,可以维持血管内皮细胞的稳定,减少血液中有害物质以及免疫蛋白复合物在在血管中的黏附作用。此外,miR-181a还可以诱导细胞凋亡,参与凋亡相关信号通路的激活。本课题主要研究miR-181a在Toll样受体激活,蛋白酶体/免疫蛋白酶体转换以及信号通路的作用。
1 一般资料
1.1 样本收集
收集2017年6月1日至2019年5月31日儿童过敏性紫癜肾炎100例,其中男性患者56例,女性患者44例,分为儿童过敏性紫癜肾炎(HSPN)患儿和过敏性紫癜不伴随肾炎患儿(HSP-nonN)。随机选取50名健康体检儿童外周血为健康对照组(HC),均排除感染。收集所有患者的病例资料,以及初诊时外周血,分离PBMC和血清,冻存在-80 ℃冰箱中,统一批次进行检测。
1.2 过敏性紫癜性肾炎(HSPN)诊断标准
参照中华医学会儿科学分会肾脏学组,紫癜性肾炎诊治循证指南(2016)[9]:过敏性紫癜患者患病6个月内,出现血尿和(或)蛋白尿。血尿的诊断标准:肉眼血尿或1周内3次镜下血尿红细胞I>3个/高倍视野(HP)。蛋白尿诊断标准,满足以下任一项者:①1周内3次尿常规定性示尿蛋白阳性;②24 h尿蛋白定量>150 mg或尿蛋白/肌酐>0.2 mg/mg;③1周内3次尿微量白蛋白高于正常值。
1.3 血清miR-181a水平测定
采集患者血清后送实验室用细胞分离液(美国罗氏公司)分离外周血单个核细胞。用Trizol试剂提取细胞总RNA,操作按照All-in-One miRNA实时定量试剂盒(美国Genecopoeia公司)说明书进行。miR181上游引物序列:5′-AACAUUCAACGCUGUCGGUGAGU-3′、下游引物序列:5′-ACUCACCGACAGCGUUGAAUGUU-3′,内参U6上游引物序列:5′-GCTTCGGCAGCACATATACTAAA-3′,下游引物序列:3′-CGCTTCACGAATTTGCGTGTCAT-5′。miR-181a/U6(内参)表示miR-181a的相对表达量。根据正常的体检者HC组的miR-181a的含量作为对照组,分析实验组血清miR-181a的表达情况。
1.4 TLR2、TLR4、β1亚基、LMP2的mRNA测定
采集健康对照组和患者血清后送实验室用细胞分离液(美国罗氏公司)分离外周血单个核细胞。采用TLR2抑制剂INH14(5 μmol/L,美国Slleck货号:S6715)处理或者不处理空白对照组(等量DMSO)24 h,用Trizol试剂提取细胞总RNA,建立RT-PCR反应体系及条件,根据逆转录试剂盒方法进行实时定量PCR(RT-PCR),以β-actin为内参照物,引物序列参见表1。引物均由上海生工合成。在Applied Biosystems荧光定量PCR仪(美国赛默飞世尔公司)上,按照默认的反应程序进行反应。每个标本设3个重复管,结果Ct值取3个重复孔的平均值。ΔΔCt=目的基因ΔCt-对照组ΔCt,表达量采用2-ΔΔCt方法计算。

表1 TLR2、TLR4、β1亚基、LMP2引物序列
1.5 蛋白质免疫印迹(Western blot)检测PBMC中TLR1,TLR2,TLR3,TLR4,TLR9以及P65,p-P65的蛋白水平
采集健康对照组和患者PBMC,采用TLR2抑制剂INH14(5 μmol/L)或者等量DMSO(空白对照组)处理细胞24 h,收集细胞,使用预冷的含有蛋白酶体抑制剂的强RIPA细胞裂解液提取总蛋白,用BCA定量试剂盒测定相应的蛋白浓度,调整浓度为1 μg/μl,每孔上样量20 μl,进行蛋白电泳,转膜。用5%TBST配制的脱脂奶粉封闭后,加入一抗(1 ∶1 000一抗稀释液稀释),4 ℃过夜孵育,TBST洗3次,每次10 min;室温孵育二抗(1 ∶1 000 TBST稀释)2 h,TBST洗3次,每次10 min孵育抗体。以GAPDH为内参照,辣根过氧化物酶标记的羊抗兔抗体为二抗,一抗用特定的Western一抗稀释液稀释(1 ∶1 000),二抗用TBST稀释(1 ∶1 000)。PVDF膜化学发光显影,ImageQuant LAS4010成像分析仪拍照,定量分析各蛋白含量。TLR1(美国CST货号:2209),TLR2(美国CST货号:12276),TLR3(美国CST货号:6961),TLR4(美国CST货号:14358),TLR9(美国CST货号:13674),p65(美国CST货号:8242),p-P65(美国CST货号:3033),GAPDH(美国CST货号:2118),抗兔二抗Anti-rabbit IgG,HRP-linked Antibody(美国CST货号:7074),抗鼠二抗Anti-mouse IgG,HRP-linked Antibody(美国CST货号:7076)。
1.6 统计学分析
2 结果
2.1 HSPN患儿PBMC中高表达miR-181a
HSP患儿的外周血单个核细胞中miR-181a表达水平高于健康对照,HSPN组miR-181a水平高于HSP-nonN组,差异有统计学意义(P<0.005,见图1)。

与HC比较,**P<0.005;与HSP-nonN组比较,##P<0.005图1 HSP组和健康对照组PBMC中miR-181a表达水平Figure 1 The expression of miR-181a in PBMC of HSP group and HC group
2.2 HSPN患儿PBMC中TLR蛋白的差异化表达
与健康对照组相比,HSP组PBMC中TLR2和TLR4 mRNA表达显著增加,差异有统计学意义(P<0.05)。HSPN组TLR2 mRNA和蛋白表达水平高于HSP-nonN组,差异有统计学意义(P<0.05)。HSPN组TLR4 mRNA和蛋白表达水平略高于HSP-nonN组,差异无统计学意义。HSP和HC两组PBMC中TLR1,TLR3和TLR9 mRNA和蛋白的表达没有明显差异(见图2)。
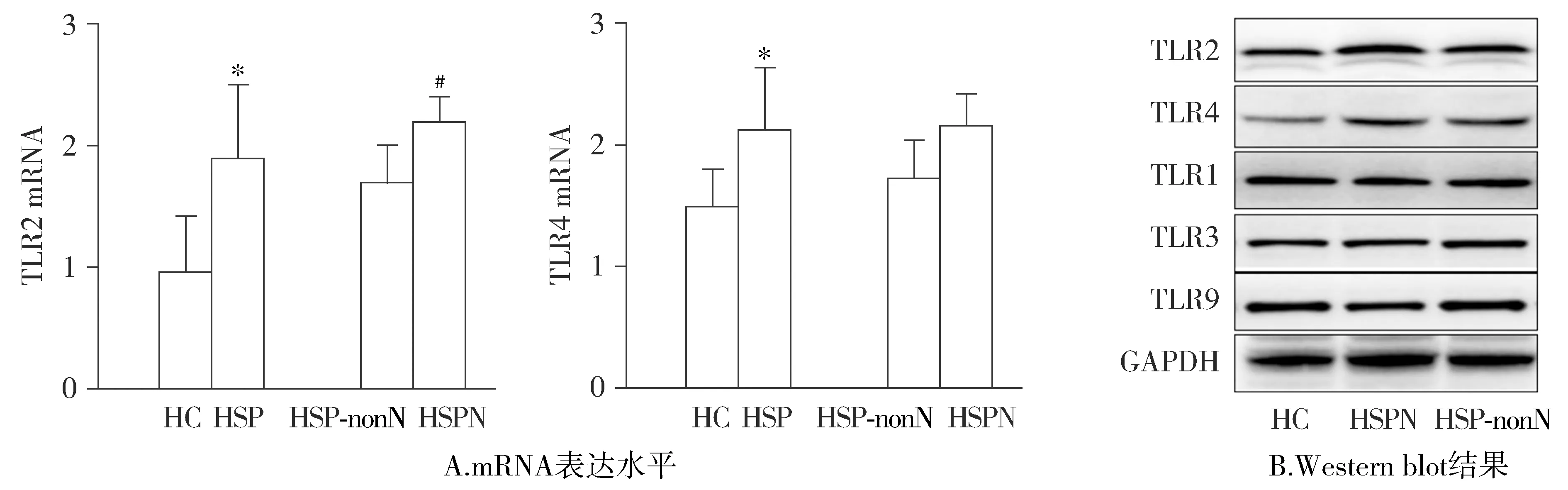
与HC比较,*P<0.05;与HSP-nonN组比较,#P<0.05图2 HSP组和健康对照组PBMC中TLR表达水平Figure 2 TLR expression level in HSP group and HC group
2.3 HSPN的PBMC存在PS到iPS的转换
HSP患儿PBMC中LMP2/β1亚基比值表达显著高于HC,差异有统计学意义(P<0.05)。HSPN患儿LMP2/β1亚基比值高于HSP-nonN患儿,差异有统计学意义(P<0.05,见图3)。
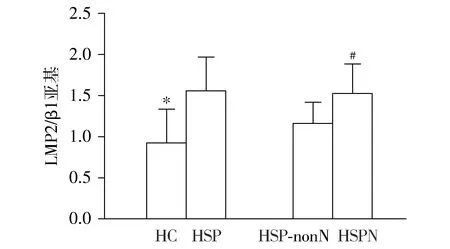
与HC比较,*P<0.05;与HSP-nonN组比较,#P<0.05图3 HSP组和健康对照组PBMC中LMP2/β1亚基表达水平Figure 3 LMP2/β1 subunit expression levels in PBMC in HSP patients and healthy controls
2.4 INH14可以抑制PS到iPS的转换和P65磷酸化
INH14处理后,HC组LMP2/β1亚基比值未见明显改变,HSP组比值有所降低,差异有统计学意义(P<0.05)。与HSP-nonN相比,HSPN患儿的LMP2/β1亚基比值降低明显,差异有统计学意义(P<0.05,见图4)。HSPN患儿的p-P65表达最多,INH14处理后,P65磷酸化程度减少。HC组变化不明显(见图5)。
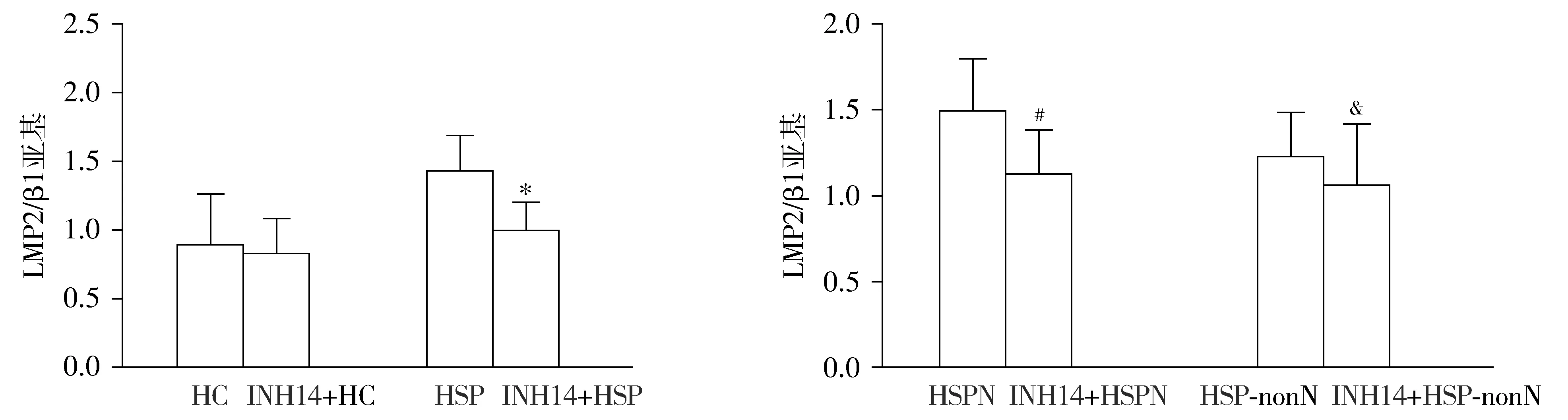
与HSP比较,*P<0.05;与HSPN组比较,#P<0.05;与HSP-nonN组比较,&P<0.05图4 INH14抑制剂处理各组后检测其LMP2/β1亚基表达水平Figure 4 LMP2/β1 subunit expression level in HSP patients and controls after INH14 treatment
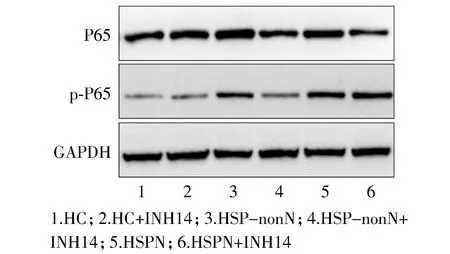
图5 INH14抑制剂处理各组后检测其P65/p-P65表达水平Figure 5 The expression of P65/p-P65 in each group after INH14 treatment
3 讨论
过敏性紫癜肾炎(HSPN),肾受累的是肾小球,其特征是免疫球蛋白A(IgA)和补体沉积在系膜中,从而造成肾脏的损害,临床特征主要表现为血尿和蛋白尿。HSPN患儿通过激素和免疫抑制剂治疗后,镜下血尿和轻度蛋白尿会完全消退,只有少数人进入慢性病阶段,伴有持续性肾损害,最终可能发展为终末期肾衰竭[1]。普遍认为HSPN发病机制为:抗原性刺激触发了糖基化IgA1(脱乳糖基化IgA1)的产生,导致IgA1大分子聚集体的形成,进入血液循环,形成真正的免疫复合物。这些复合物能够针对半乳糖基化的IgA1的特异性抗原产生抗体。这些含有IgA1的大分子最终沉积在系膜区,导致炎症激活和肾损害的发生发展。
多数HSP患儿在接受外界抗原刺激后,激活先天性免疫系统,从而引发一系列全身性的变态反应疾病。目前研究看来,HSP患儿黏膜免疫系统激活在疾病的发生发展中发挥着巨大的作用,其中TLRs系统的激活尤为重要[10],TLRs系统通过INF途径增强适应性免疫,进一步导致PS转换为iPS,从而促进了抗原呈递细胞功能[11],促进了T细胞反应。
研究表明[12],与正常儿童相比,过敏性紫癜患儿的血清中,存在miRNAs的上调,进一步分析发现,在上调的多个miRNAs中,儿童过敏性紫癜肾炎患儿miR-181a、miR-21、miR-155、miR-32a上调大于非肾型紫癜患儿的表达上调水平。本研究通过提取外周血单核细胞(PBMC)发现,HSP患儿外周血单个核细胞中miR-181a表达水平高于健康对照,HSPN患儿miR-181a水平高于HSP-nonN患儿。同时利用生物信息学分析的方法,发现miR-181a的靶基因与TLRs系统高度相关。
进一步研究TRL在HSP患儿PBMC中的表达。与健康对照相比,HSP患儿TLR2转录表达增多,先天免疫系统激活,参与整个疾病的发生发展过程。本研究通过细胞分选分析HSP患儿的PBMC,进一步检测到TLR2蛋白的表达显著增加。
HSPN患儿的LMP2/β1比值显著高于健康对照,也高于HSP-nonN患儿。在免疫蛋白酶体的研究中发现存在两种PS/iPS酶促LMP7/β5和MECL-1/β2的转换[13],因此,我们可以推测LMP2/β1转换可能是HSP特殊存在的。利用INH14处理HC,HSP-nonN和HSPN的PBMC,进一步检测不同分组中LMP2/β1亚基比值发现,HC组未见明显改变,而HSP组LMP2/β1亚基比值有所降低。进一步比较HSPN和HSP-nonN患儿,发现INH14处理后HSPN患儿的LMP2/β1亚基比值降低明显,而INH14处理后HSP-nonN患儿的LMP2/β1亚基比值降低。检测正常对照、HSP-nonN和HSPN患儿PBMC中NF-κB相关蛋白P65和p-P65发现,HSPN患儿的p-P65表达最多,INH14处理后,P65磷酸化程度减少;而HC组变化不明显。因此,我们进一步推测miR-181a可能通过TRL2激活NF-κB信号通路参与儿童过敏性紫癜肾炎的PS/iPS转换的作用机制。
我们检测到了先天免疫指标,即HSPN患儿的PBMC中TLR2 mRNA表达水平明显高于HSP-nonN患儿和正常对照,表明TLRs在HSP的发生发展过程,可能介导T淋巴细胞选择性激活。TLR2配体包括代表广泛物种的多种微生物分子,例如革兰氏阳性和革兰氏阴性细菌,可识别细胞壁成分,例如肽聚糖,脂蛋白酸和脂蛋白[14]。我们无法推测HSP中TLR2是选择性激活,还是iPS单独性的激活,但是这些发现值得进一步研究。确实,针对TLR的治疗为多种炎症性疾病的治疗策略和免疫系统调节提供了可能性[15]。HSP患儿的TLR2的激活增加了免疫蛋白酶体转换,可能暗示了HSP血管病变存在特有的先天免疫途径。HSP的免疫调节领域值得进一步研究,为更深层次的治疗提供理论依据。
