FERMT1在Stanford A型主动脉夹层患者中的表达及其临床意义
2020-11-04陈太强蒋丁胜魏翔陈军
陈太强 蒋丁胜 魏翔 陈军
430030 武汉,华中科技大学同济医学院附属同济医院心脏大血管外科
主动脉夹层(aortic dissection,AD)是一类病情凶险、死亡率高的心血管急危重症,如未及时诊治,在患者发病48 h内,病死率会以每小时增加1%的速度增长,1周时达70%,3个月时可高达90%[1]。由于血管内异常血流或高血压损伤血管内膜,血流经破口进入中膜层,AD患者的血管壁中层会沿血管长轴方向撕裂剥脱形成真假两腔。调查结果显示,AD发病率约为3人/10万人/年[2]。目前除血管置换和覆膜支架置入等治疗方法外,尚无有效的保守治疗方案,并且AD发病机制尚不完全清楚。有研究提示主动脉中层退变(包括平滑肌细胞减少、弹性纤维断裂、蛋白聚糖聚集等)、炎症细胞浸润等是导致AD发生的重要病理因素[3],但调控这些病理过程的分子机制知之甚少。因此,进一步阐明AD发生的分子机制,对于寻找新的治疗靶点有重要的临床价值。
FERMT1基因位于染色体20p12.3位点,编码fermitin家族同源蛋白1(又称kindlin1),是FERMT家族成员之一[4]。研究表明,FERMT1是一个磷酸蛋白且参与表皮角质细胞的极化、增殖和死亡[4]。同时,FERMT1缺失使角质细胞对紫外线诱导的炎症反应和DNA损伤更敏感[5]。此外,FERMT1通过激活ERK信号通路抑制细胞的氧化应激损伤[6]。在AD的病理过程中,平滑肌细胞的增殖、迁移、表型转化,炎症细胞的浸润以及氧化应激损伤都在其中发挥重要作用。尽管FERMT1对角质细胞的增殖、炎症反应以及氧化应激损伤的调控作用已经明确,但其是否参与主动脉平滑肌细胞的功能以及其是否影响AD的发生发展尚未见报道。因此,本研究旨在明确FERMT1在AD发生过程中的表达模式及其对AD可能的影响,为阐明AD的发病机制以及筛选潜在的治疗靶点提供理论和实验依据。
1 材料与方法
1.1 实验材料
随机选取在我院确诊为Stanford A型AD(Stanford type A aortic dissection,TAAD)并接受手术治疗的患者13例作为夹层组,因终末期心力衰竭行心脏移植的患者11例作为对照组。排除标准:合并动脉炎、马凡综合征、肿瘤、创伤性或医源性AD以及艾滋病等传染性疾病的患者。本研究中所有涉及人体组织样本的采取程序均符合世界医学协会《赫尔辛基宣言》的原则,获得患者本人或家属的知情同意,且经过华中科技大学同济医学院附属同济医院伦理委员会批准。
1.2 方法
1.2.1 基本资料 收集各组患者基本信息,包括年龄、性别、饮酒史、吸烟史、高血压史、糖尿病史、入院心率、收缩压和舒张压。采集患者的CT血管成像和三维重建影像,并测量主动脉弓部、升主动脉部、降主动脉部和腹主动脉部的主动脉内径。
1.2.2 组织样品收集 13例夹层组样本与11例对照组组织获取后迅速分装,分别于4%中性甲醛固定和-80℃冻存用于下一步实验。
1.2.3 组织化学检测 固定组织经脱水、石蜡包埋处理。包埋后的主动脉壁组织制备成5 μm厚的切片,依次按脱蜡、水化、染色等标准处理,分别完成苏木精-伊红(HE)染色和弹性纤维(EVG)染色,封片后镜下观察拍照。
1.2.4 RT-PCR检测 取液氮冻存血管组织标本约100 mg,低温液氮中研磨,加入Trizol(15596-26,Invitrogen)裂解,10 min后加入氯仿抽提,12 000 rpm离心15 min,水相上清加入异丙醇进行RNA沉淀,加入DEPC配制的75%乙醇进行RNA沉淀漂洗。待白色沉淀干燥,加入DEPC水溶解。测定RNA浓度,将RNA反转录为cDNA,-20℃保存备用。准备PCR反应体系(SYBR Green、FERMT1正向引物GCTTCTGAAAACCCACTGGA、FERMT1反向引物ATCTTCAAATTCGGCAGACG、ddH2O),实时荧光定量PCR检测仪内测定并记录。
1.2.5 Western blot检测 取冻存血管组织标本约100 mg,低温液氮中研磨组织,加入RIPA裂解缓冲液提取总蛋白。使用BCA蛋白定量试剂盒(ThermoFisher scientific,23225)测定蛋白浓度。蛋白定量,电泳,转膜。5%脱脂牛奶室温封闭1 h,4℃下用含一抗(FERMT1,Cat No. 22215-1-AP,Proteintech)的抗体稀释液孵育过夜。次日TBST缓冲液洗膜3次,加入相对应的二抗(Jackson ImmunoResearch Laboratories,111-035-003),室温孵育1 h,ChemiDocTM XRS+成像系统(Bio-Rad)下显影,检测FERMT1蛋白表达信号。
1.2.6 免疫组织化学检测 固定组织常规脱水,透明、石蜡包埋,制备5 μm切片。烘箱中烤片60 min,二甲苯中脱蜡处理3次,梯度浓度酒精水合,于柠檬酸盐缓冲液中微波修复10 min,3%过氧化氢37℃孵育20 min去除内源性过氧化物酶,PBS浸洗切片3次,8%羊血清封闭60 min,FERMT1一抗4℃孵育过夜,PBS浸洗3次,HRP标记二抗湿盒内孵育90 min。PBS浸洗,滴加DAB工作液显微镜下观察显色效果,洗去余色,苏木精复染,自来水冲洗,脱水、透明、封片,于显微镜下观察拍照,并用Image J软件进行定量分析。
1.3 统计学方法

2 结果
2.1 两组的基本临床数据比较
较对照组,AD组患者的年龄较大,合并更多高血压,收缩压水平显著升高(均为P<0.05),其余基本资料两组间无明显差异,见表1。
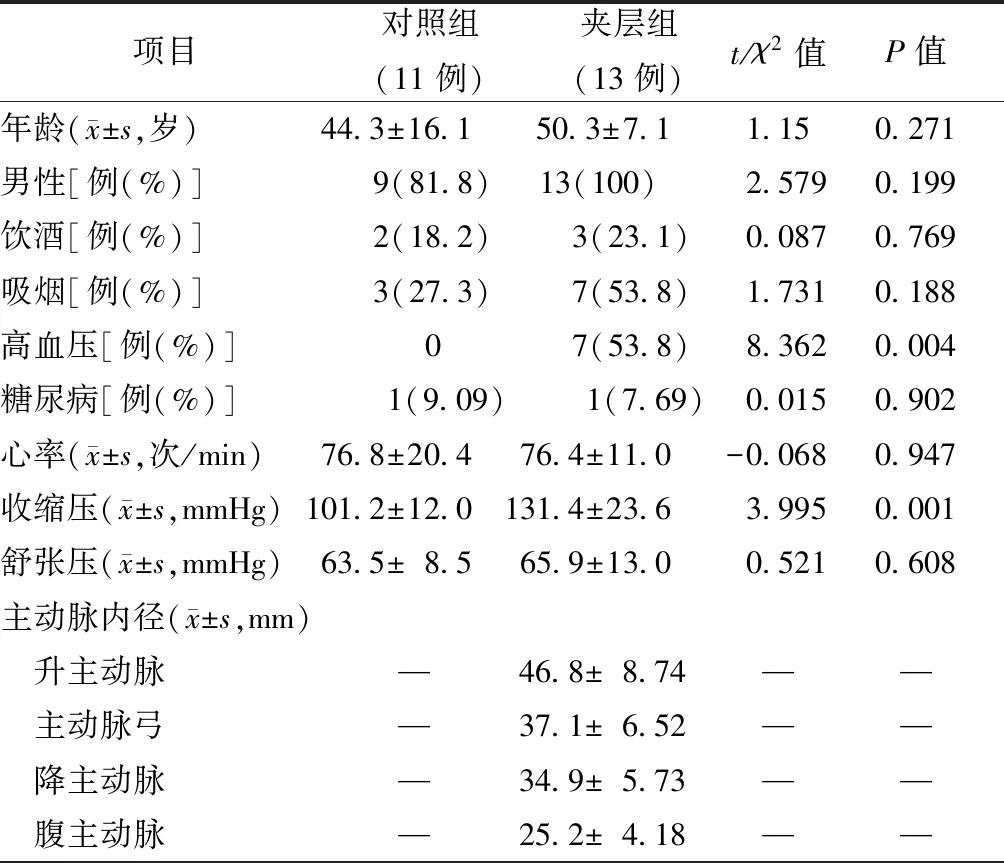
表1 TAAD患者与对照组临床资料对比
2.2 各组的组织样本结构分析比较
HE染色和EVG染色显示,对照组主动脉壁结构完整,平滑肌细胞排列紧密有序,弹性纤维完整连续;而夹层组主动脉血管壁组织明显破坏,平滑肌细胞形态不规则,胞核缩小,平滑肌细胞间少量红细胞浸润,弹性纤维不完整,断裂严重,呈碎片化(图1)。
2.3 各组的FERMT1 mRNA与蛋白表达分析
RT-PCR检测组织中FERMT1的mRNA含量,发现与对照组相比,FERMT1的mRNA表达水平在夹层组主动脉血管组织中显著降低,差异具有统计学意义(P<0.05)(图2)。
免疫印迹法检测主动脉壁中FERMT1的蛋白表达水平,结果发现夹层组主动脉壁中FERMT1的蛋白水平显著低于对照组(P<0.05)(图3)。免疫组织化学染色结果同样证明,FERMT1蛋白含量在夹层组中显著降低(P<0.05),且FERMT1蛋白主要分布在细胞质中(图4)。

图1 两组主动脉壁的HE和EVG染色

图2 实时荧光定量PCR检测FERMT1基因在对照组(n=11)和夹层组(n=13)主动脉组织中mRNA表达水平

图3 Western blot检测FERMT1在对照组(n=7)和夹层组(n=7)主动脉组织中的蛋白表达水平
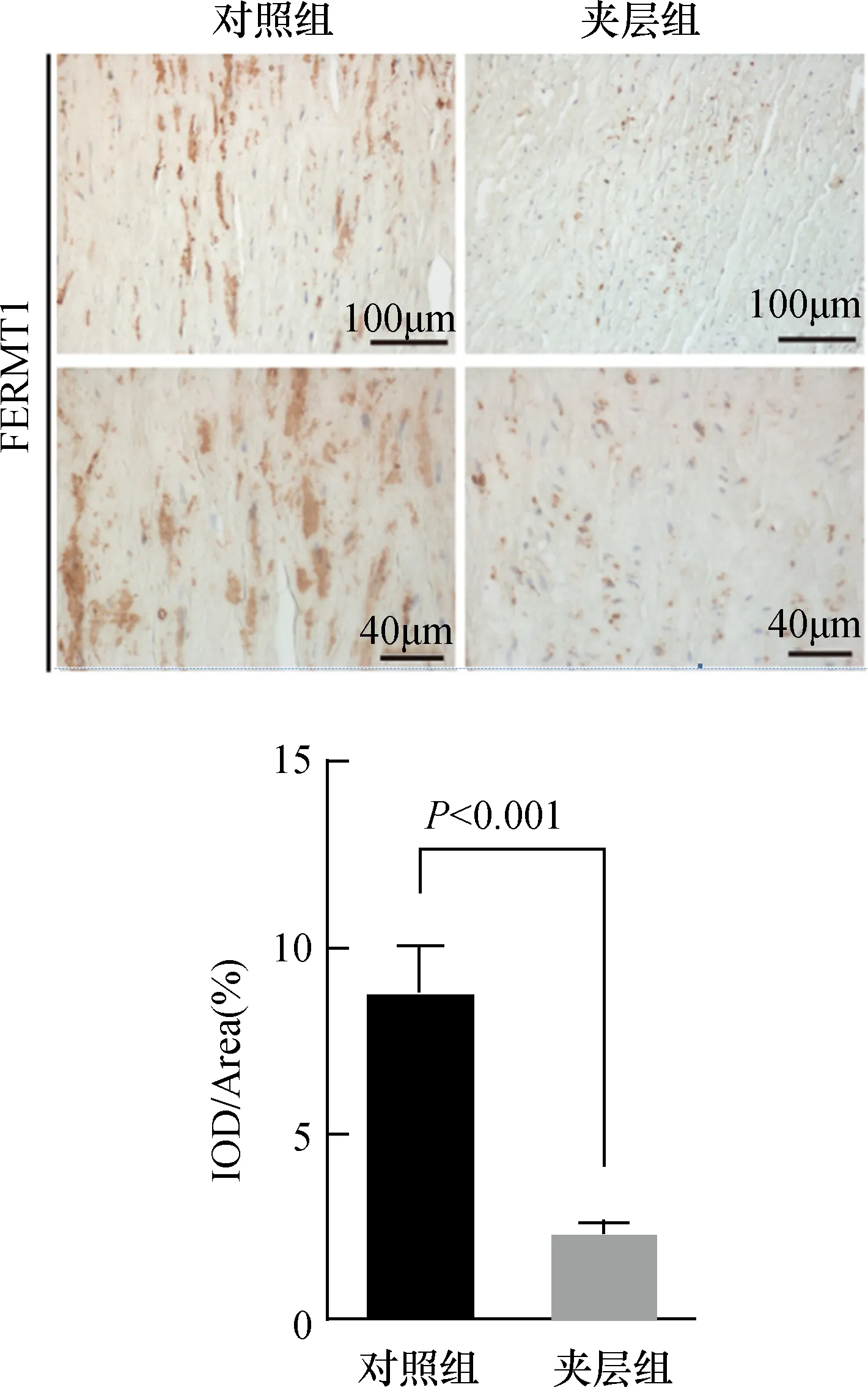
图4 免疫组织化学染色显示FERMT1的表达及在主动脉壁中细胞定位
2.4 主动脉直径与FERMT1 mRNA表达量相关性分析
Pearson相关性分析发现,升主动脉内径、主动脉弓内径、胸主动脉内径、腹主动脉内径与FERMT1 mRNA表达水平无显著相关(图5)。

图5 AD患者的主动脉直径与FERMT1 mRNA表达水平的相关性分析
3 讨论
FERMT1基因在2003年被首次报道与Kindler综合征有关[4],与FERMT2、FERMT3基因共同属于FERMT家族,分别编码kindlin1、kindlin2、kindlin3蛋白。Kindlin1主要表达于内皮细胞,kindlin2在体内广泛表达,而kindlin3表达于造血细胞和内皮细胞[4,7-8]。Kindlin1和kindlin2参与细胞的局部粘附作用,其中kindlin2还参与细胞间连接作用[7,9],kindlin3定位于细胞伪足[10]。有报道称,kindlin1缺失后,角化细胞的迁移、粘附和伸展能力均下降,细胞出现多尖端和多极形状变化[11-13]。另有研究发现,kindlin1参与整合素的功能调控,而整合素是一类含α和β亚基位于细胞表面的糖蛋白,作为细胞的受体兼具细胞粘附和信号传导的功能[14]。Kindlin1与整合素胞内段β亚基相互作用,调控细胞的生存、增殖、粘附和分化。研究显示,Filamin A(FLNA)在AD患者中表达量发生显著变化,而FLNA可与整合素相互作用,调控细胞骨架从而影响细胞的形状和迁移[15]。TGF-β信号通路对AD具有重要的调控作用,其中转化生长因子β(transforming growth factor-β,TGF-β)信号通路中多个分子的突变与AD的发生密切相关,如TGFBR1、TGFBR2、TGFB2、TGFB3、SMAD2、SMAD3、SMAD4等[16],不仅如此,该通路对平滑肌细胞的功能、细胞外基质的分泌等均具有重要调控作用。FERMT1可通过调控Wnt和TGF-β信号通路影响皮肤干细胞的增殖[17],但在AD发生过程中,FERMT1是否也可以通过调控TGF-β信号通路影响AD的发生发展尚不清楚。除TGF-β信号通路外,FERMT1还可调控β-catenin的转录活性影响结肠癌的转移[18],通过调控ERK信号通路抑制细胞的氧化应激损伤[6]。
本研究结果发现,与无夹层的正常主动脉相比,AD患者主动脉壁中FERMT1的mRNA和蛋白水平均显著降低,提示FERMT1可能参与调控AD的病理过程,而且本团队已发表的研究成果也显示,在AD患者主动脉壁中,β-catenin以及MAPK-ERK信号通路均被明显抑制[19],提示FERMT1有可能通过调控β-catenin以及MAPK-ERK信号通路影响AD的病理过程以及进展。相关性分析发现,FERMT1的基因表达与主动脉内径无显著相关性,该分子可能成为AD的预测分子,与AD的发生相关,而与AD的进展过程无关[20]。
综上,本研究发现FERMT1的mRNA和蛋白水平在AD患者中均显著降低,提示其对AD可能具有重要的调控作用,其调控AD的分子机制可能与整合素、TGF-β、β-catenin以及MAPK-ERK信号通路相关。然而,FERMT1对AD的具体作用以及分子机制均需进一步研究,本文的研究结果提示FERMT1与AD的发生可能存在一定的联系,为该基因对AD的功能研究奠定基础,为临床治疗AD提供潜在的治疗靶点和参考。
利益冲突:无