结肠灵通过调节NLRP3炎性小体活化对感染后肠易激综合征大鼠内脏敏感性的机制研究
2020-11-04韩棉梅宋雨鸿梁嘉恺
韩棉梅,马 军,宋雨鸿,梁嘉恺
1.广州市第一人民医院中医科,广东 广州 510180; 2.广州医科大学附属第二医院质控科
肠易激综合征(irritable bowel syndrome,IBS)是一种常见的功能性胃肠病,主要表现为腹痛或腹部不适,伴有大便习惯改变及排便异常,缺乏生化和病理学改变证据。部分患者在急性肠道感染恢复后,仍存在腹泻、腹痛、腹部不适等症状,即为感染后肠易激综合征(post-infection irritable bowel syndrome,PI-IBS)[1-2]。研究表明,低水平的炎症反应在IBS,特别是PI-IBS的发病机制中起到重要作用[3-4]。但目前有关PI-IBS发病的分子机制尚不完全清晰,临床药物治疗效果不佳。
核苷酸结合寡聚化结构域样受体3(NLRP3)炎症小体是目前NLR家族研究最为广泛的炎症小体,由NLRP3、Caspase-1和凋亡相关斑点样蛋白(ASC)三部分组成[5]。以往研究发现,活化NLRP3炎症小体可以介导IL-18和IL-1β表达增加,诱导组织炎症反应,导致胃肠道组织损伤[6-7]。因此,通过寻找有效药物抑制NLRP3炎症小体活化对改善PI-IBS尤为重要。
结肠灵汤是广东省名中医潘锦瑶教授自拟的经验方,由党参15 g、茯苓15 g、白花蛇舌草30 g、火炭母15 g、黄连10 g、白芍12 g、素馨花10 g、枳壳12 g、糯稻根15 g、甘草6 g组成。结肠灵汤具有行气、消胀、止痛作用[8-9],在临床上广泛用于治疗IBS。研究证实,结肠灵具有调节结肠炎症反应的作用,改善IBS症状,在临床上广泛用于治疗IBS;在肝郁脾虚型PI-IBS大鼠模型中,结肠灵可以通过降低肠道黏膜炎症反应,调节免疫应答,进而改善大鼠PI-IBS[9]。但有关结肠灵对改善IP-IBS的分子机制尚不明确。因此,本研究拟通过建立PI-IBS动物模型,采用Western blotting和ELISA等方法观察结肠灵对大鼠肠道NLRP3炎性小体表达的影响,以此探讨结肠灵是否通过介导NLRP3,抑制炎症小体的活化及炎症细胞因子的释放,从而缓解肠道炎症反应,改善PI-IBS大鼠内脏敏感性。
1 材料与方法
1.1 材料
1.1.1 实验试剂:结肠灵汤的药材饮片购自广州市第一人民医院中药房;苏木素-伊红染色试剂盒购自北京中杉金桥生物技术公司;NLRP3抗体、ASC抗体、Caspase-1抗体、IL-1β抗体、IL-18抗体购自美国Cell Signaling Technology公司;HRP标记兔二抗、HRP标记鼠二抗β-actin抗体购自武汉博士德公司;一抗稀释液、二抗稀释液购自江苏碧云天公司。实验所需培养基和耗材购自北京中杉金桥生物技术公司。
1.1.2 实验动物及分组:SPF级SD大鼠40只,雌雄各20只,体质量为180~220 g,购自广东省动物实验中心。40只SD大鼠随机分为4组:正常对照组、模型组、结肠灵组和阳性对照组,每组10只。
1.1.3 主要仪器和设备:组织匀浆仪购自武汉维塞尔生物科技有限公司;-80 ℃超低温冰箱购自青岛海尔集团;4 ℃、-20 ℃冰箱购自合肥美菱股份有限公司;高速台式冷冻离心机购自湖南湘仪实验室仪器有限公司;荧光倒置显微镜购自日本Olympus光学工业株式会社;电镜购自北京京科瑞达科技有限公司;Western blotting检测装置购自美国Bio-Rad伯乐公司;高纯水机购自美国Millipore公司。
1.2 方法
1.2.1 造模方法:三硝基苯磺酸(TNBS)法是目前应用较广泛的PI-IBS动物模型制备方法[10]。取TNBS[(5 mg·0.8 ml)只-1]距肛门8 cm处结肠灌注制备PI-IBS大鼠模型。
1.2.2 药物制备:按结肠灵方药配比,将全方150 g药物饮片浸泡30 min,煎煮2次,第1次加1.2 L水,煎煮l h,取煎液;第2次加0.8 L水,煎煮30 min,取煎液,2次煎液混合浓缩,大鼠按60 kg的成人临床等剂量换算,结肠灵汤浓缩为原材料3.00 g/ml。
1.2.3 干预方法:阳性对照组:马来酸曲美布汀片,剂量为0.2 mg/kg,溶入生理盐水2 ml/次,1次/d,灌胃,持续给药1周。结肠灵组:每只大鼠给予30 g/kg灌胃,1次/d。空白对照组:常规喂养、给水。
1.2.4 内脏感觉功能测定:通过腹壁回缩反射(AWR)评分和粪便含水量评估大鼠内脏敏感性。小鼠禁食不禁水24 h,将带气囊的导管石蜡油润滑后经肛门插入结肠,插入深度约1 cm。将导管远端在肛门口上用胶布固定于小鼠的尾部,导管根部开口经三通管与压力计和5 ml注射器相连接,注气压力由压力计监测。经肛门插入带气囊的导管,待适应后开始检测。操作者随机注气,达到目标压力后持续20 s,观察者评分后压力回至零点,气囊内压力由20 mmHg(1 mmHg=0.133 kPa)开始,每隔5 min分别递增至40、60、80 mmHg,每一压力测5次,取平均值。评分过程中操作者与评分者为双盲进行。AWR评分标准:0分,结肠扩张时无反应;1分,结肠扩张时身体静止不动,头部运动减少;2分,结肠扩张时腹部肌肉收缩,但腹肌未抬离桌面;3分,结肠扩张时腹部肌肉收缩,腹肌抬离桌面;4分,结肠扩张时骨盆抬起,身体呈弓形,会阴部离开地面。
1.2.5 苏木素-伊红(HE)染色:大鼠结肠组织用4%多聚甲醛固定,梯度酒精脱水,二甲苯透明,石蜡包埋、切片,行HE染色。详细操作可按照说明书进行。
1.2.6 酶联免疫吸附测定(ELISA):按照中杉金桥生物有限公司大鼠IL-1β和IL-18检测试剂盒说明书进行胰岛素含量测定。具体步骤如下:(1)标准品加样:96孔酶标包被板,每孔加入50 μl不同浓度的标准品溶液;(2)待测品加样:将待测样品稀释5倍后加入酶标板内,轻轻摇晃并混匀;(3)加酶:每孔加入100 μl酶试剂;(4)孵育:封板膜封板后,置于37 ℃恒温烘箱内孵育1 h;(5)稀释液配置:使用去离子水稀释20×的浓缩液为1×备用;(6)洗涤酶标板:揭去封板膜,倾去液体,并加入洗涤液清洗,重复3~5次,甩干;(7)显色:每孔加入A∶B=1∶1(50 μl∶50 μl),轻摇混匀后,避光置于37 ℃恒温烘箱内孵育15 min;(8)终止反应:每孔加入50 μl终止液,终止显色反应;(9)吸光度值测定:单功能酶标仪450 nm处测定各孔吸光度值。
1.2.7 蛋白免疫印迹(Western blotting):(1)取出大鼠的小肠组织,剪碎后置于1.5 ml的组织研磨管内并按照1∶3~1∶2比例加入组织裂解液置于已预冷后的组织匀浆仪中进行研磨;(2)高速离心机4 ℃ 12 000×g离心15 min,收集小肠组织上清液,采用BCA法进行蛋白质浓度定量检测;(3)按照每孔上样量为30 μg进行蛋白质凝胶电泳实验,根据目的蛋白分子量大小及蛋白标记物指示进行切胶,湿转转膜法将蛋白转移至PVDF膜上,5%脱脂牛奶封闭2 h,孵育对应一抗(1∶1 000)4 ℃过夜,孵育二抗(1∶5 000)1 h,于摇床摇晃洗膜,含吐温磷酸盐缓冲液(TPBS)洗涤后加入发光聚合物(ECL),使用胶片曝光,图片扫描后用Image J软件计算各条带的灰度值,以各目标条带灰度值与内参β-actin条带灰度值的比值表示目标蛋白的相对表达量。每组实验重复3次。
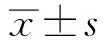
2 结果
2.1 结肠灵对大鼠内脏敏感性的影响为确定结肠灵给药后对大鼠内脏敏感性的影响,通过HE染色检测各组大鼠结肠黏膜组织形态变化、测定大鼠AWR值及粪便含水量评估大鼠内脏敏感性。结果显示,正常对照组大鼠结肠黏膜结构完整,无炎症细胞浸润,给药前模型组、阳性对照组及结肠灵组结肠黏膜受损,且有大量的中性粒细胞浸润。给予结肠灵干预后,结肠灵组大鼠结肠黏膜结构恢复,且炎症细胞浸润降低(见图1)。
如表1~2所示,与正常对照组相比,模型组AWR评分值、粪便含水量均显著增加(P<0.01);给予结肠灵灌胃给药后的大鼠AWR评分值、粪便含水量均显著降低(P<0.05);阳性对照药物(马来酸曲美布汀)也可降低大鼠粪便含水量,但对AWR评分无影响。

图1 HE染色检测各组大鼠结肠黏膜形态学变化(放大100倍)Fig 1 Morphological changes of colonic mucosa in each group detected by HE staining

表1 各组大鼠AWR评分值Tab 1 AWR score of rats in each group n=10)
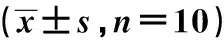
表2 各组大鼠粪便含水量比较Tab 2 Comparison of fecal water content of rats in each group %
2.2 结肠灵对大鼠炎症细胞因子表达的影响通过ELSIA检测各组大鼠血清中IL-1β和IL-18含量,结果显示,模型组大鼠血清中IL-1β和IL-18含量显著升高(P<0.01),给予结肠灵干预后降低了炎症细胞因子水平(P<0.01);进一步通过Western blotting检测大鼠结肠组织IL-1β和IL-18蛋白表达,相比于模型组,结肠灵组IL-1β和IL-18蛋白表达显著降低(P<0.05),结肠灵组与正常对照组相比,IL-1β蛋白表达差异有统计学意义(P<0.05),IL-18蛋白表达差异无统计学意义(P>0.05)(见表3、图2)。提示结肠灵可能通过降低炎症细胞因子IL-1β和IL-18释放,改善大鼠内脏敏感性。
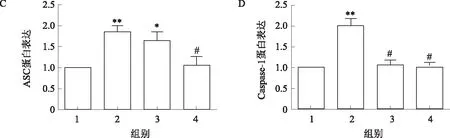
2.3 结肠灵对大鼠肠道NLRP3炎症小体活化的影响NLRP3炎症小体由NLRP3、ASC和Caspase-1组成。通过Western blotting检测大鼠结肠组织NLRP3、ASC和Caspase-1表达。结果显示,与正常对照组相比,模型组NLRP3、ASC和Caspase-1表达显著升高(P<0.01);与模型组相比,结肠灵药物干预后可降低NLRP3、ASC和Caspase-1表达(P<0.05);结肠灵组与阳性对照组相比可降低NLRP3蛋白表达水平(P<0.05)(见图3)。

表3 各组大鼠血清IL-1β和IL-18含量比较 Tab 3 Comparison of serum levels of IL-1β and IL-18 in each ng/L

注:1:正常对照组;2:模型组;3:阳性对照组;4:结肠灵组;与正常对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05;与阳性对照组相比,&P<0.05。

注:1:正常对照组;2:模型组;3:阳性对照组;4:结肠灵组;与正常组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05;与阳性对照组相比,&P<0.05。
2.4 结肠灵对大鼠肠道组织NF-κB表达的影响NF-κB是一种炎症反应中心蛋白。为探究结肠灵对大鼠肠道NLRP3炎症小体活化的机制,我们通过Western blotting检测结肠组织中NF-κB和p-NF-κB表达水平。结果显示,4组大鼠结肠组织NF-κB表达差异无统计学意义(P>0.05);模型组p-NF-κB蛋白表达显著升高(P<0.05),与模型组相比,阳性对照组和结肠灵组p-NF-κB蛋白表达显著降低(P<0.05)(见图4)。表明结肠灵可能通过p-NF-κB,抑制NLRP3炎症小体活化,降低组织炎症,进而改善PI-IBS大鼠内脏敏感性。

注:1:正常对照组;2:模型组;3:阳性对照组,4:结肠灵组。与正常对照组比较,**P<0.01; 与模型组比较,#P<0.05。
3 讨论
IBS是一种临床常见的肠功能紊乱性疾病,以腹痛、排便习惯和(或)大便性状改变等症状为主要表现,但无肠道器质性病变。研究证实,内脏高敏感性是引发IBS重要的病理生理机制[11]。在我国有关IBS的患病率高达6.5%,且女性患病率高于男性[12]。PI-IBS是指患者此前无IBS的临床症状,当其感染后会出现腹痛、大便异常等症状。以往研究表明,持续性的肠道低度炎症会导致PI-IBS内脏的高敏感性[13]。但目前有关炎症与PI-IBS肠道敏感性的分子机制尚不完全清楚。
NLRP3炎症小体是一种由NLRP3、ASC和Caspase-1组成的复合型炎症小体。研究发现,在炎症性小鼠的结肠组织中NLRP3呈现高表达水平,抑制NLRP3炎症小体活化可降低IL-1β和IL-18的释放,改善炎症性肠道疾病的发生、发展[14-15]。但有关NLRP3炎症小体在PI-IBS大鼠中的研究甚少。因此,本研究拟通过构建PI-IBS大鼠模型,探究NLRP3在大鼠肠道灵敏性中的作用与分子机制。结果发现,PI-IBS大鼠结肠组织黏膜受损,且有大量的中性粒细胞浸润;AWR评分值及粪便含水量均显著增加。上述结果表明,PI-IBS大鼠模型建立成功。为验证NLRP3炎症小体在此过程中的生物学作用,我们通过Western blotting检测了大鼠结肠组织中NLRP3炎症小体相关蛋白表达。结果显示,模型组NLRP3、ASC和Caspase-1的表达显著升高。IL-1β和IL-18炎症细胞因子,作为Caspase-1的下游靶蛋白,广泛参与PI-IBS的发生、发展。在急性肠感染后PI-IBS患者的直肠黏膜中IL-1β、IL-18 mRNA和蛋白表达显著高于正常对照组人群[16-17]。此外,IL-1β可诱导神经递质(如乙酰胆碱)和其他炎症因子(如IL-2、IFN-γ等)合成增多,导致胃肠的高敏感性[18]。为此,我们通过ELISA和Western blotting共同检测了PI-IBS大鼠血浆和结肠组织中的IL-1β和IL-18。结果显示,模型组血浆和结肠组织中IL-1β和IL-18表达均显著升高。综上所述,PI-IBS大鼠内脏灵敏性增加可能与NLRP3炎症小体活化进而促进下游炎症因子(IL-1β和IL-18)释放增加引起。NF-κB是炎症反应的中心环节,可通过活化NLRP3炎症小体,促进炎症细胞因子表达[19-20]。基于NF-κB在整个炎症反应中的重要性,我们同样检测了大鼠结肠组织中NF-κB蛋白的表达变化。与正常对照组比较,模型组大鼠结肠组织NF-κB表达差异无统计学意义,p-NF-κB表达显著升高。因此,通过药物干预NF-κB/NLRP3信号轴,对防治PI-IBS胃肠炎症反应引发的内脏敏感性至关重要。结肠灵具有行气、消胀、止痛作用,其可通过降低大鼠结肠黏膜炎症和免疫反应,改善PI-IBS。通过大鼠结肠灵(1 ml/100 g)灌胃,1次/d,结果发现,与模型组比较,结肠灵组大鼠黏膜组织完整性恢复,炎症浸润减少,AWR评分值和大鼠粪便含水量均显著降低。进一步研究发现,结肠灵药物干预后也可以降低p-NF-κB、NLRP3、ASC、Caspase-1、IL-1β和IL-18表达,抑制结肠炎症。
综上所述,PI-IBS大鼠可能通过NF-κB活化NLRP3炎症小体,促进IL-1β和IL-18。给予结肠灵药物干预后可通过NF-κB抑制NLRP3炎症小体活化,降低炎症,进而改善大鼠内脏敏感性。本研究为结肠灵防治PI-IBS诱发内脏敏感性提供了新的视角。但也存在一定的不足,即未能通过特异性抑制NF-κB进而检测NLRP3炎症小体的活化情况。因此,在后续的研究中,我们将通过特异性抑制NF-κB进而观测NLRP3炎症小体的活化情况,来研究结肠灵防治PI-IBS的作用机制。
