MCM8在胃癌中的表达及其与临床病理特征及预后的相关性分析
2020-11-04谭宁平张文静朱祖安
谭宁平, 李 莉, 张文静, 朱祖安
1.徐州医科大学临床学院,江苏 徐州 221000; 2.徐州医科大学附属医院消化内科
全球癌症状况最新数据显示,胃癌是全球第五大常见癌症,其病死率居于癌症病死第3位,2018年新发胃癌病例超过1 000 000例,估计有783 000例死亡(相当于全球每12例死亡1例)[1]。我国是胃癌高发区,胃癌的发病率仅次于肺癌,位于第2位,死亡率位于第3位[2]。早期胃癌的5年生存率可达95%,而进展期胃癌的生存率低于20%[3],因此提高胃癌的早期诊断率对胃癌的早期治疗至关重要。目前,胃癌早期治疗的主要手段是手术治疗,但大多数胃癌患者就诊时已处于进展期,失去了最佳的手术机会,因此寻找与胃癌相关的生物学标志物是提高胃癌早期诊断率的重要方法之一,为新型抗肿瘤药物的研发提供新思路。
微小染色体维持蛋白(minichromosome maintenance proteins,MCMs)家族最初是在酿酒酵母基因筛选中发现的,是一种广泛存在于高等真核生物中且高度保守的蛋白质,DNA复制前复合物的重要组成部分,在DNA复制起始、延伸、转录、染色体重构和基因组稳定中起重要作用,且在多种人类癌前病变及癌症中异常表达,成为人类恶性肿瘤生物学标志物[4]。MCM8是MCMs家族的重要成员,在DNA修复和重组中起关键作用,被发现在多种人类恶性肿瘤中均有过度表达和DNA拷贝数增加的现象,有学者研究分析了MCM8在多种人类癌症,包括乳腺癌、非小细胞肺癌、肝癌、成髓细胞瘤和多形胶质母细胞瘤中过表达,过表达的幅度是正常表达量的2~5.2倍,表明MCM8过表达在人类恶性肿瘤中具有广泛的意义[5]。
然而,目前关于MCM8在胃癌中的表达及其意义的研究还很少。本研究采用组织芯片技术及免疫组织化学方法,研究MCM8在胃癌组织中的表达与胃癌发生、发展及预后的关系,分析其在胃癌发生、发展中的作用及意义,为胃癌诊断及治疗提供新思路。
1 材料与方法
1.1 一般资料收集2009年1月至2009年12月徐州医科大学附属医院普外科手术切除的胃癌组织标本84例,同一患者癌旁正常组织(距离肿瘤边界>5 cm,并经病理切片证实)84例作为对照。男61例,女23例,年龄26~85岁,中位年龄62岁;临床资料包括性别、年龄、肿瘤直径、TNM分期、组织分化程度、淋巴结转移、浸润深度、远处转移等。所有患者均为初诊患者,且术前均未行放、化疗及生物免疫治疗,所有胃癌标本均经本院病理证实。
1.2 主要试剂兔抗人MCM8单克隆抗体购自美国赛默飞世尔公司,工作浓度为1∶100。兔二步法检测试剂盒、DAB显色液均购自北京中杉金桥生物技术有限公司。
1.3 方法采用免疫组化SP法,实验步骤按试剂盒说明书进行。使用预实验中反复证实的阳性切片作阳性对照,PBS代替一抗作阴性对照,DAB显色。
1.4 结果判定免疫组织化学结果判定以镜检显示细胞核或细胞质染为黄色或棕黄色颗粒为阳性。判定方法如下:(1)免疫组化阳性细胞百分比评分:阳性细胞百分比<25%为1分;≥25%且<50%为2分;≥50%且<75%为3分;≥75%为4分。(2)根据细胞着色强度评分:分为无、弱、中、强4个等级,分别记为0、1、2、3分;0分为胞浆及胞核上无棕黄色颗粒,与背景无区别;1分为胞浆及胞核上有淡棕黄色颗粒,明显高于背景底色,也明显高于阴性对照;2分为细胞浆及胞核上有染色较清晰的棕色颗粒,介于强弱之间;3分为细胞浆及胞核上有大量的深棕色颗粒,阳性染色强。判定标准:免疫组化结果判定以阳性细胞百分比评分和着色强度评分的乘积为最终结果,>3分为阳性,≤3分为阴性。
1.5 统计学处理采用SPSS 22.0软件对数据进行统计分析。分类计数资料均以例数/%表示,组间比较采用χ2检验;预后单因素生存分析采用Kaplan-Meier生存分析和Log-rank检验分析方法,P<0.05为差异有统计学意义。
2 结果
2.1 MCM8在胃癌组织及癌旁正常组织中的表达情况MCM8阳性表达主要位于细胞核及细胞质,呈黄色或棕黄色颗粒(见图1)。MCM8在胃癌组织中表达阳性78例,阴性6例,阳性率92.9%;MCM8在癌旁正常组织中表达阳性38例,阴性46例,阳性率45.2%;经χ2检验结果显示,胃癌组织中MCM8的阳性表达率明显高于癌旁正常组织,差异有统计学意义(P<0.001)(见表1)。
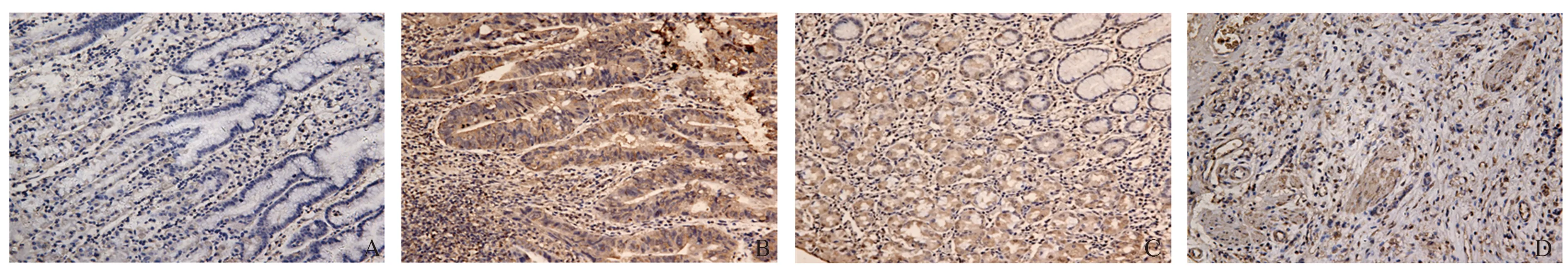
图1 MCM8在胃癌组织和癌旁正常组织中的表达(SP染色,放大200倍) A:癌旁正常组织阴性表达;B:胃癌组织
2.2 胃癌组织中MCM8的表达与临床病理特征的关系胃癌组织中不同临床病理特征患者MCM8表达情况结果如表2所示。不同临床病理特征患者MCM8表达经χ2检验结果显示,MCM8在胃癌组织中的异常表达与肿瘤细胞分化程度及浸润深度相关(P<0.05),而与性别、年龄、肿瘤大小、淋巴结转移、TNM分期、远处转移无相关性(P>0.05)。
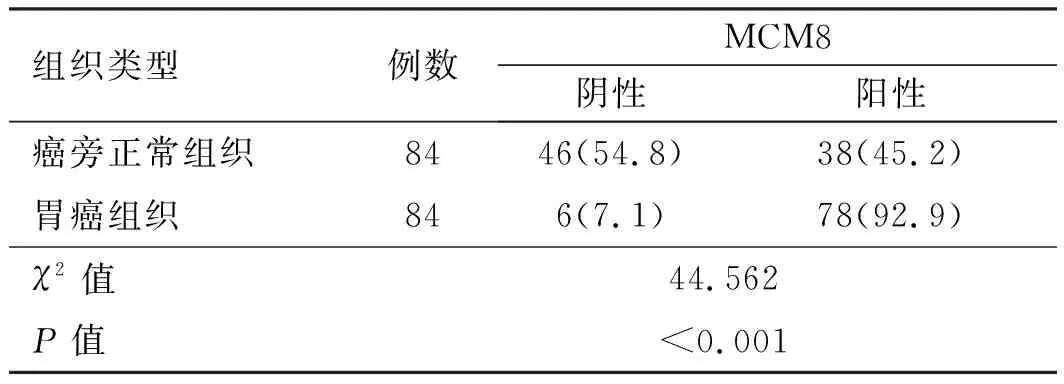
表1 胃癌组织和癌旁正常组织中MCM8表达情况[例数(%)]Tab 1 Expressions of MCM8 in gastric carcinoma tissues and normal gastric tissues adjacent to the carcinoma [n(%)]
2.3 MCM8表达与胃癌预后的关系对84例胃癌患者进行随访,详细记录患者术后情况,对随访获取的资料进行归纳整理,进行预后随访研究。随访截至2014年3月,随访时间为1~63个月。将随访病例分为MCM8表达阳性组及MCM8表达阴性组,其中阳性组78例,阴性组6例(仅选取临床与随访资料完整的病例),对MCM8表达与胃癌术后预后的关系进行分析。胃癌术后预后单因素分析采用Kaplan-Meier生存分析和Log-rank检验分析方法,结果显示:MCM8在胃癌组织中表达阳性者总生存期低于表达阴性者(χ2=4.166,P=0.041,见图2)。
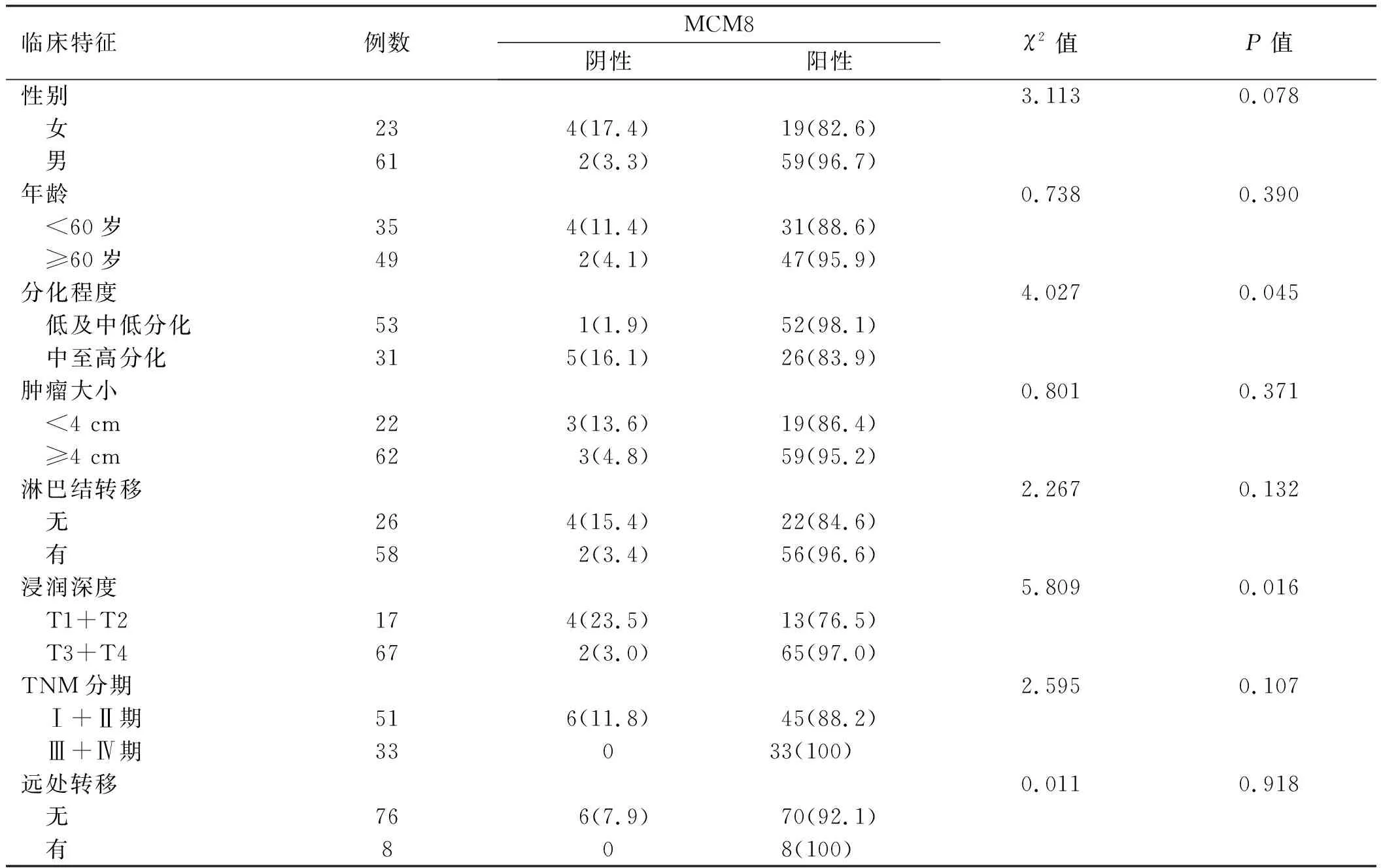
表2 胃癌中MCM8的表达与临床病理特征的关系[例数(%)]Tab 2 Correlation between expression of MCM8 and clinicopathologic features in gastric carcinoma [n(%)]
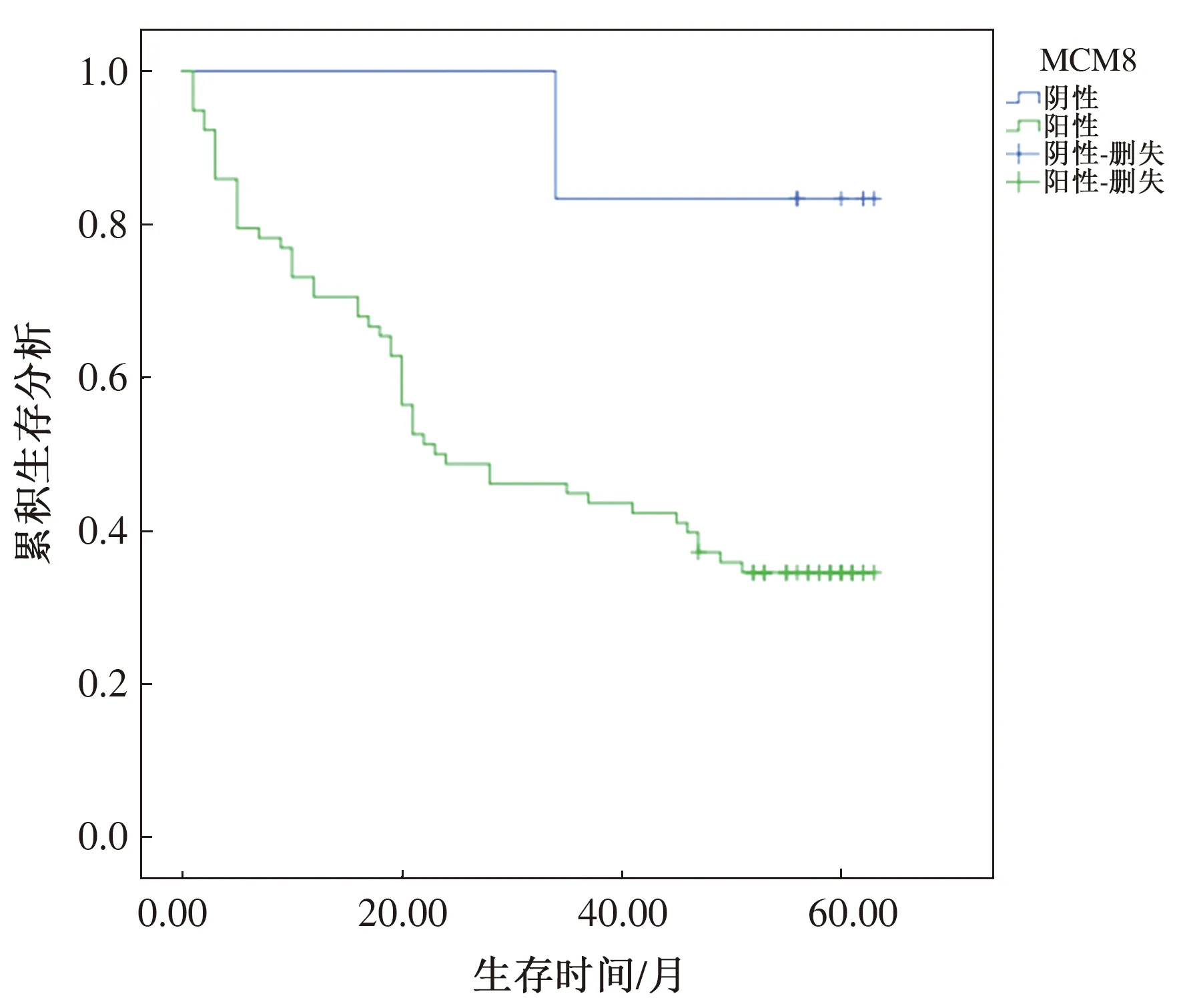
图2 84例胃癌患者MCM8表达不同的生存曲线 Fig 2 Different survival curves of MCM8 expression in 84 patients with gastric carcinoma
3 讨论
在1980年代初期,MCMs家族由Tye教授等在筛选酿酒酵母菌突变体的研究中首次发现[6],随后在高等真核生物中鉴定出了同系物。MCMs在DNA复制起始、延伸、转录、染色体重构和基因组稳定中起重要作用,且在多种人类癌前病变及癌症中异常表达,成为人类恶性肿瘤生物学标志物[4]。目前共发现了10个MCMs家族成员,包括MCM1~10。每个MCM亚基均具有独特的功能,在细胞内通过调节多种基因的转录激活并影响细胞周期,调节细胞凋亡、生长和分化过程,并相互组合形成多种异聚体,参与启动DNA合成[7]。MCM2~7通常形成六聚体复合物发挥生物学功能[8]。MCM8和MCM9均基于与MCM2~7的序列同源性而被鉴定为仅存在于高等真核生物中的MCMs家族成员[6],MCM8和MCM9可以形成二聚体复合物。同一家族中的另外两个成员MCM1和MCM10与MCM2~7无同源性,不含MCMs共有的MCM盒,也有学者认为两者不属于MCMs家族,但两者均在DNA复制中发挥作用[9-10]。
MCM8是MCMs家族重要成员,是在研究携带乙型肝炎病毒的肝癌患者定向基因时发现的[11],该基因包括19个外显子,位于20p12.3-13染色体带处与GCD10的相对位置,编码一个由840个氨基酸组成的蛋白质,在胎盘、肺、肝脏和心脏中表达[12]。与MCM2~7或MCM10不同,MCM8在酵母中无直接的对应物,仅存在于果蝇或更高级的真核生物中,在几种高级真核生物中高度保守。MCM8 mRNA 在G1/S期积累,而MCM8蛋白可在整个细胞周期中检测到,且在整个细胞周期中稳定存在[13]。有研究称MCM8和细胞分裂周期蛋白6(CDC6)相互作用形成复制前复合物的组成部分[14]。后来发现,MCM8解旋酶活性主要在复制延伸过程中发挥作用,而不是在启动过程中起作用[15]。最近的研究表明,MCM8被募集到DNA修复位点以促进DNA同源重组和双链断裂[16-17]。MCM8基因突变可导致卵巢早衰[18]。
许多研究表明,MCMs家族的扩增和过表达与侵袭性恶性肿瘤相关[19]。为调查MCM8过表达的原因,发现MCM8在多种人类恶性肿瘤中的基因拷贝数增加,包括前列腺癌、胶质母细胞瘤、乳腺癌、结肠癌、胰腺癌、卵巢癌、食管癌、肝癌、肺腺癌、肺鳞状细胞癌、肉瘤、弥漫性大细胞淋巴瘤、甲状腺癌、直肠腺癌、急性髓细胞性白血病和膀胱癌,推测MCM8基因的拷贝数增加可能是人类恶性肿瘤中MCM8过表达的潜在机制。
在本实验中,我们应用免疫组化SP法检测MCM8在胃癌组织及癌旁正常组织中的表达情况,结果显示,MCM8在胃癌组织中阳性率为92.9%(78/84),在癌旁正常组织中阳性率为45.2%(38/84),两组比较,差异有统计学意义。Cai等[20]通过实时PCR测量MCM8 mRNA在慢性粒细胞白血病患者和健康个体中的表达水平,结果显示,慢性粒细胞白血病患者MCM8 mRNA表达水平明显高于健康对照组。敲低MCM8后分析细胞活力和凋亡率,显示细胞活力显著降低,凋亡率升高,表明MCM8在慢性粒细胞白血病中起重要作用,而敲除MCM8可能是慢性粒细胞白血病的潜在靶向治疗方法。Liu等[21]使用定量聚合酶链反应(qPCR)及聚合酶链反应(PCR)分析了肝细胞癌及正常肝脏中MCMs mRNA的表达,发现在肝细胞癌中MCM8 mRNA表达较正常肝脏显著升高。Li等[22]采用Oncomine数据库比较了肺腺癌中MCMs的转录水平与癌旁组织中的MCMs转录水平,发现MCM8 mRNA表达在肺腺癌组织中较癌旁组织显著升高。我们的研究结果同上述结果一致,提示MCM8可较好地反映胃癌细胞的增殖特性,推测MCM8可能作为促癌基因参与了胃癌发生、发展的过程。
本研究还发现,MCM8的表达与组织分化程度、浸润深度有关。随着分化程度降低,MCM8的表达逐渐升高;浸润程度越深,MCM8的表达逐渐升高。MCM8的表达与性别、年龄、肿瘤大小、淋巴结转移、TNM分期、远处转移无相关性。He等[5]发现,MCM8的获得与几种人类癌症的侵袭性临床特征有关,来自TCGA的前列腺癌数据集分析表明,MCM8的获得与更高的格里森氏评分、更高的病理分期及淋巴结转移相关;MCM8的增加还与更高水平的肺腺癌残留肿瘤、淋巴结转移有关;与食管癌的更高级别及淋巴结转移相关;与结肠癌更高级别分期及淋巴结转移有关。本研究与其研究不完全一致,可能与实验样本量较小有关,今后会进一步扩大样本量验证结果。
本实验通过Kaplan-Meier生存分析和Log-rank检验分析结果显示,MCM8在胃癌组织中表达阳性者总生存期低于表达阴性者。Peng等[23]发现,MCM8在胰腺癌中过表达与较短的总生存期相关,MCM8是胰腺癌的独立预后因素。Liu等[24]也发现MCM8与较差的肺腺癌总生存期显著相关。Quan等[25]选取了4个独立的GEO数据集分析MCMs的表达与骨髓瘤进展和生存的关系,发现MCM8高表达与无病生存期(disease-free survival,DFS)和总生存期呈负相关。Li等[22]还发现,高MCM8 mRNA表达与总生存期缩短显著相关。我们的研究结果同上述研究结果一致,推测MCM8可能通过调节细胞周期、DNA复制等途径来影响胃癌预后,MCM8可作为判断胃癌预后的指标。
综上所述,MCM8是一种可靠的细胞增殖标志物,可以用于判断肿瘤的分级、恶性程度及预后。MCM8表达在癌细胞中上调,为癌细胞和具有潜在恶性的细胞提供了诊断标记。MCM8作为一个新兴的细胞增殖标志物,也有待于进一步进行基础理论及临床应用上的研究。
