核酸扩增技术构建目标物转换策略在电化学发光生物传感器中的研究进展
2020-11-03姚佳爽补姝淳孟华颖
杨 芳, 姚佳爽, 补姝淳, 孟华颖, 卓 颖
(西南大学化学化工学院,重庆 400715)
0 引言
核酸扩增技术是一种可使微量核酸高速扩增的技术,自问世以来,被广泛应用于分析生物学领域。 目前,核酸扩增技术被研究者们不断改进, 在生物传感领域的研究应用不断走向成熟,成为了一种有力的信号放大策略。 常见核酸扩增技术主要有杂交链式反应(HCR)、催化发夹自组装(CHA)、滚环扩增(RCA)和聚合酶链式反应(PCR)和核酸剪切酶辅助的放大策略等。HCR 是一个由动力学因素控制的反应,具有较高的灵敏度和好的选择性,并且整个过程操作简便,不需要酶的参与,可以消除精确控制pH 值、温度和缓冲介质的限制。 在2004 年,Dirks 和Pierce 首次报道HCR 是一种无酶的目标物诱导的信号放大策略[1]。 CHA 是另一种无酶的核酸放大策略,其通过DNA 杂交(自组装和去组装)而不是链式反应完成的。 具体地讲,首先设计两个在室温下能稳定共存的发夹结构(H1 和H2),然后使用外加的催化分子打破二者的能量平衡形成H1/H2 双链杂交结构,同时释放催化分子并进行循环放大反应[2]。 RCA 是一种等温扩增技术,在环形模板、引物探针和聚合酶的辅助作用下能实现多个互补序列的拷贝,从而在引物探针上延伸并产生一个长的单链DNA[3-4]。 一般情况下,线性RCA 可以在短时间内实现约103倍的扩增, 并且随着共反应物的引入,其扩增量还可以进一步增加。 因此,RCA 被认为是一种高灵敏度、 特异性的核酸放大技术,并且被广泛应用于各种核酸的检测中[5-7]。在众多的核酸信号放大策略中,PCR 是一种应用最广泛的DNA 体外扩增技术。 其特点在于,PCR 可实现短时间内扩增产物的指数级增长[8-9]。 典型的PCR 过程由三个基本反应步骤构成:(1) 高温条件下模板DNA 的变性;(2) 模板DNA 与引物链的退火(复性);(3)以dNTPs 为反应原料,在聚合酶的作用下,引物沿模板延伸;上述三步反应组成一个循环, 通过多次循环反应,使目标DNA 得以迅速扩增。 近年来,核酸扩增技术成功应用于电化学生物传感器的研究工作已得到广泛报道,所构建的生物传感器的灵敏度不断提高,甚至达到单分子检测水平。 核酸扩增技术的成功应用促进了生物传感的发展同时为更灵敏、高效的生物分子检测提供了新的思路。
1 电化学发光生物传感器
20 世纪60 年代,Clark和Lyon 首次对生物传感器的基本概念进行了定义[10]。 自此,生物传感器进入人们的视野并迅速发展起来。 进入21世纪,微处理器技术、计算机技术和信息处理技术的高速发展使融合了化学、生物、材料、计算机等多种学科知识与技术的生物传感器渗透到了环境保护、生物工程、疾病诊疗和食品安全等各个邻域。 从豌豆杂交理论的提出,到DNA 双螺旋结构的发现, 生命科学一直在不断地进步与发展,科研工作者们对生物体系的探究深入到了分子水平,这对相关疾病的预防、诊断和治疗具有重大意义。 然而疾病相关标志物在癌症早期表达极低, 人们对分析技术提出了更高的的要求,使得生物传感器的发展面临着巨大的挑战。 电化学发光生物传感器(Electrochemiluminescence biosensor) 是以生物活性物质如蛋白质、DNA/RNA、小分子、离子等作为检测对象,将特异性识别过程中产生的信号转换为电化学发光信号,从而实现对目标物定量检测的分析器件。 它融合了电化学发光和生物传感技术,与其他传感技术相比,ECL 传感技术具有灵敏度高、背景信号低、可控性高和应用范围广等特点,是检测一些低丰度的重要疾病标志物,实现疾病早期诊断和治疗的可靠平台。
2 目标物转换策略概述
生物体中的核酸、蛋白质、小分子以及离子在复杂的生命活动中起着至关重要的作用,它们在生命体中的表达水平与各种人类疾病(如恶性肿瘤、心脑血管疾病)的发生密切相关,因此被广泛用作相关疾病的标志物[11-12]。 如何实现其高效灵敏的检测成为了生物分析领域的研究热点之一。 目标物转换策略是通过化学反应或分子间特异性识别作用将少量目标物转换成大量模拟目标物的一种信号放大技术。 它的出现和应用为疾病标志物的分析提供了高灵敏检测手段,在疾病标志物痕量分析中占据重要地位[13-16]。
3 核酸目标物转换策略及其分析应用
核酸是由许多核苷酸聚合成的生物大分子化合物,为生命的最基本物质之一,根据化学组成不同,核酸可分为脱氧核糖核酸(DNA)和核糖核酸(RNA)。 目前,核酸检测的主要方式是利用碱基互补配对原则。 在目标核酸存在时,其与相应核酸经过识别互补诱导核酸扩增或DNA 自组装,之后,少量靶标核酸分子转换成与ECL 信号相关联的模拟目标物,以此实现目标核酸的检测。
He 等[17]通过改善自组装单链DNA 探针的位置分布和空间取向, 提高了超支化滚环扩增(HRCA)的效率,实现了目标物的高效转换(图1)。 当靶DNA 存在时,HRCA 反应启动并快速积累了大量的扩增产物,这些扩增产物含有不同长度的双链DNA(dsDNA)片段,然后大量的Ru(Phen)32+作为ECL 指示剂插入dsDNA 片段的沟槽中,输出强的ECL 信号。因此,ECL 信号与扩增产物的量呈正相关, 从而实现靶DNA 的灵敏检测。 该传感器的检测线低至7.6 fmol/L。
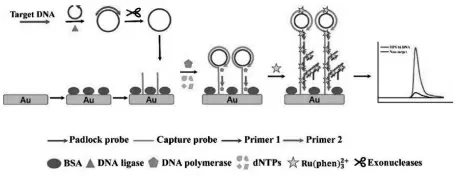
图1 检测HPV16 DNA 的ECL 生物传感器示意图[17]Fig.1 Mechanism of the ECL biosensor for detecting HPV16 DNA.Coptright 2021 ACS
近年来,随着DNA 纳米技术的发展,DNA 步行器(walker)因其可自主运行、方向性强、可编程性等特点成为了信号放大技术的宠儿。 Nie 等[18]以DNA walker 作为信号放大技术实现了目标物的高效转换和检测。 如图2 所示,首先将封锁的DNA walker 固定在电极表面, 当目标DNA 存在时,目标物与封锁链互补杂交,此时,目标DNA转化成了DNA walker, 随后DNA walker 在电极表面行走促使ECL 指示剂离开电极表面。检测过程中,ECL 信号与目标物的量呈负相关, 以此实现目标物的转换和检测。 另外,Lv 等[19]使用目标DNA 与两条DNA 链(WD1 和WD2)杂交将目标物转换成双足DNA walker,随后双足DNA walker行走在规则的DNA 轨道上, 它可以有效地提高DNA walker 的行走效率,从而快速取代猝灭探针点亮ECL 信号,实现目标物的信号放大。 该传感器检测限低至0.18 fmol/L(图3)。

图2 基于DNA walker 检测HPV16 DNA 的ECL 生物传感器示意图[18]Fig.2 Schematic diagram of DNA walker-based ECL biosensor for HPV16 DNA detection.Coptright 2020 Elsevier

图3 基于双足DNA walkerBCR/ABL 融合基因的ECL 生物传感器示意图[19]Fig.3 Schematic diagram of bipedal DNA walker-based ECL biosensor for BCR/ABL fusion gene detection.Coptright 2020 ACS
Micro RNA(miRNA)是一类在多种真核生物中调控基因表达的小型非编码RNA[20]。 研究表明,miRNA 参与多种生命活动过程, 包括癌细胞的生长、分化、凋亡等[21-22],是现代分子生物学用于鉴定多种生物学和病理学过程的重要标志物之一。 Jiang 等[23]设计了一种新型的DNA 纳米机器用于高效的靶标转换并将其用于构建miRNA-21 超灵敏检测的ECL 生物传感器。 如图4 所示,在miRNA-21 存在下,由于局域效应,它引发了定位DNA 级联反应(LDCR)并转换成大量模拟目标物(二茂铁标记的DNA,Fc-DNA)。基于ECL材料与Fc 之间的能量和电子转移,Fc 可以有效地猝灭发光体的ECL 强度,从而实现对miRNA-21 的灵敏检测。该生物传感器表现出宽的检测范围 (100 amol/L~1 nmol/L) 和低的检测限(10.7 amol/L)。

图4 (A)DNA 纳米机器的组装及目标物的转换,(B)ECL 传感器的制备[23]Fig.4 (A)the assembly of DNA nanomachine and target conversion,(B)the preparation of ECL biosensor.Copyright 2019 ACS
Liu 等[24]以红荧烯纳米棒为发光试剂,以溶解氧为共反应试剂构建了microRNA-141 生物传感器,具体过程如图5 所示。 值得一提的是,该体系以少量的目标物驱动酶辅DNA 循环放大,输出大量的铂纳米粒子修饰的DNA 短链(S1/PtNPs)作为模拟目标物,构建了“on-off-super on”的信号转换模式,为ECL 生物传感平台开辟了新的研究方向。

图5 生物传感器制备过程示意图[24]Fig.5 Schematic illustration of fabrication of the biosensor
除此之外,Liao 等[25]设计了外切酶III(Exo III)辅助的级联放大策略实现了目标物的双重转换。 在EXO Ⅲ的辅助下,少量的靶miRNA-21 触发级联信号放大并被转换成大量的次级靶目标物(T2)。 然后T2 能够打开修饰在电极表面的发夹DNA1 链。 随后, 引入DNA2 和DNA3 触发HCR 过程,形成大量富含AT 的dsDNA。 最后,将Cu2+与富含AT 的dsDNA 孵育后,由于A-Cu2+-T键的作用, 在dsDNA 上原位生成了dsDNA 固定的Cu NCs, 从而获得强的ECL 信号, 实现miRNA-21 的灵敏检测 (图6, 检测限为19.05 amol/L)。

图6 Exo III 辅助的目标物双重转换[25]Fig.6 Exo III-assisted double conversion of target.Copyright 2018 Elsvier
4 非核酸目标物转换策略及其分析应用
不同于核酸标志物,蛋白质、离子和小分子等非核酸标志物无法通过碱基互补配对原则进行识别,进而不能实现目标物的转换便无法达到灵敏检测的目的。 但研究者们通过不断的探索,开发了适用于非核酸标志物的转换策略以实现其灵敏检测。 目前,主要通过特异性的生物识别(抗原抗体反应和核酸适配体结合) 或物质之间的化学反应构建非核酸目标物的转换策略。
Lei 等[26]设计了一种智能的环形肽-DNA 纳米机器实现了抗体的转换和信号放大。 首先,将特异性抗原肽核酸序列与DNA 链交联形成捕获探针(CP),在靶巨细胞病毒pp65 抗体(anti-CMV pp65) 存在时,CP 特异性识别抗体并通过DNA邻位触及作用形成一个智能的环形肽-DNA 纳米机器。 然后,在聚合酶和剪切酶的辅助下,环形肽-DNA 纳米机器可以引发后续的级联放大,从而输出大量的模拟目标物。 最后,模拟目标物与电极表面的猝灭探针杂交, 使体系的ECL 恢复。该传感器的灵敏度低至0.33 fmol/L(图7)。

图7 巨细胞病毒pp65 抗体的转换及检测原理示意图[26]Fig.7 Schematic of the conversion and detection principle of anti-CMV pp65.Copyright 2018 ACS
Jiang 等[27]通过核酸适体结合将靶蛋白MUC1转换成MUC1-适体复合物 (MUC1-A), 随后MUC1-A 触发催化发夹自组装(CHA)反应,使得标记有发光体ABEI 的DNA 链固定在CoFe2O4材料表面。 最后,电极表面的S1 链捕获S2 修饰的CoFe2O4产生强的ECL 信号。 该传感器的检测范围为1 fg/mL~1 ng/mL, 检测限低至0.62 fg/mL(图8)。
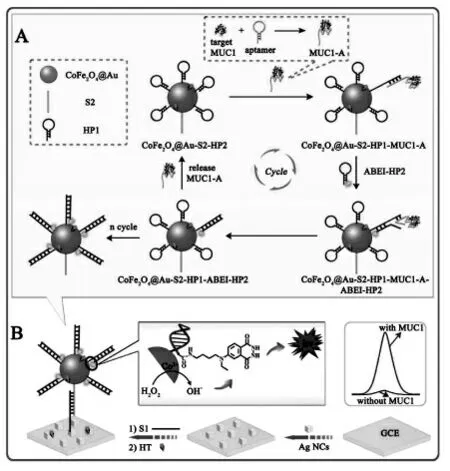
图8 (A)目标物MUC1 的转换策略,(B)ECL 生物传感的构建[27]Fig.8 (A)Target MUC1 conversion by protein-aptamer binding complex,(B)the construction of the ECL biosensor.Copyright 2017 ACS
Zhao 等[28]利用核酸适配体识别内毒素(LPS)引起二级结构的变化, 然后触发滚环扩增(RCA), 随着RCA 的进行,LPS 又被释放出来触发下一循环, 从而实现目标物循环同步RCA 信号放大策略。利用RCA 产生的富G 碱基DNA 序列与卟啉铁, 形成卟啉铁/G-四链体核脱氧核糖核酸酶(hemin/G-quadruplex DNAzymes)可以有效地猝灭MoS2量子点/TPrA 体系的ECL 信号,从而实现了对LPS 的高灵敏检测(如图9 所示)。由于目标物循环与RCA 同步进行, 简化了检测操作的同时,还有效地提高了信号放大效率。 该ECL 适体传感器展现出宽的检测范围0.1 fg/mL~50 ng/mL,检测限低至0.07 fg/mL。

图9 基于目标物循环同步滚环扩增的ECL 适体传感器用于LPS 检测的原理示意图[28]Fig.9 (A)Schematic illustration of the ultrasensitive “onoff”ECL aptasensor for LPS Detection based on aptamer recognition-driven target-cycling synchronized RCA:(A)Preparation process of MoS2@Pd-Au.Copyright 2017 ACS
同样,利用核酸适体结合,Lei 等[29]实现了Hg2+的特异性检测。 目标Hg2+的引入能够使富含胸腺嘧啶(T 碱基)的柔性单链通过特异性的THg2+-T 作用折叠形成“duplicator-like”的DNA 机器, 随后在酶的辅助下引发链置换扩增反应将Hg2+转换成大量的模拟目标物。 产生的模拟目标物进一步在电极表面上引发杂交链式反应得到富鸟嘌呤(C 碱基)的长的DNA 片段,该片段能够通过C-Ag+-C 作用富集Ag+。Ag+作为共反应促进剂能够增强PTCA/S2O82-体系的ECL 信号强度,从而实现对Hg2+的灵敏检测(图10,检测限低至0.33 fmol/L)。
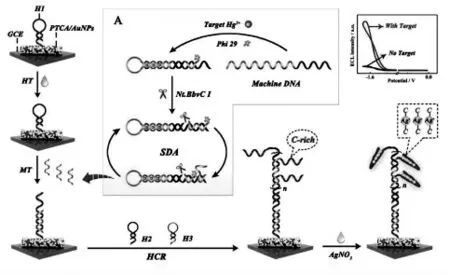
图10 Hg2+的转换策略和ECL 传感器的构建[29]Fig.10 Target Hg2+conversion by SDA and the construction of the ECL biosensor.Copyright 2018 ACS
除了T-Hg2+-T、C-Ag+-C 这一类固定碱基与金属离子的特异性结合之外,一些特定核酸序列在存在相匹配的金属离子时, 能够激活酶活性,即所谓的核酶(ribozyme)/脱氧核酶(DNzyme)。利用这些酶的活性,可以将金属离子的浓度信息转化为核酸信号,并通过DNA 信号放大策略,实现金属离子的高灵敏检测。 Lei 等[30]利用Cu2+激活的DNzyme 剪切DNA 的活性, 构建了ECL 生物传感器实现Cu2+的超灵敏检测。具体原理如图11所示, 脱氧核酶DNA 与标记有猝灭探针的底物DNA 的复合物通过自组装修饰在电极界面,Cu2+的存在能够激活DNA 剪切,将底物DNA 剪切为两段DNA 片段,从而使猝灭探针离开电极界面,而Cu2+能够进入下一循环继续剪切其它底物DNA 并释放猝灭探针,从而实现对Cu2+的信号放大。 最终, 大量的ECL 猝灭探针离开电极界面,ECL 信号完成off-on 的转换, 由于DNA 信号放大的作用,该ECL 生物传感器对Cu2+检测的灵敏度显著提高,检测限低至0.34 pmol/L。

图11 PTCA-S2O82-体系应用于ECL 生物传感器用于Cu2+的原理示意图[30]Fig.11 Schematic illustration of the preparation procedure of the Cu2+-specific DNAzyme‐based ECL biosensor for Cu2+detection
尽管核酸适配体展现了广泛的应用前景,但它的筛选过程复杂,人力、财力和时间耗费大,筛选的成功率不尽如人意。 因此,目前有效可用的核酸适配体还非常有限,远远不能满足临床及市场上的需要。 最近,研究者们提出了将特异识别位点标记到核酸分子,基于此实现抗体蛋白的目标物转换与灵敏检测。 如图12 所示,Yang 等[31]报道了一个将抗地高辛球蛋白(anti-Dig)通过抗体驱动的三联DNA 纳米机器转换为DNA 链,从而进一步参与酶驱动的链置换循环反应,以获得传感器的ECL 信号放大,成功地实现了目标蛋白anti-Dig 的检测,其检测限为6.7 pmol/L。

图12 anti-Dig 检测过程的示意图[31]Fig.12 Schematic illustration of production process for sensitive detection of anti-Dig
如图13 所示,Ge 等[32]基于谷胱甘肽(GSH)与MnO2之间的氧化还原反应将GSH 转换为Mn2+。 然后,Mn2+作为模拟目标物触发DNAzyme辅助的循环扩增。 之后, 扩增产物S3 激活DNA分子机器并在剪切酶的辅助下使H1 发生构象转变形成了大量的链霉亲和素(SA)适配体。 最后,SA 适配体与标记有SA 的发光体特异性识别输出强的ECL 信号。该生物传感器表现出优异的检测性能 (检测范围为1~200 μmol/L, 检测限为0.44 μmol/L)。

图13 (A)GSH 的转换策略,(B)模拟目标物Mn2+触发DNAzyme 辅助的循环扩增,(C)传感器的检测原理[32]Fig.13 (A)The conversion of GSH,(B)Mn2+-Induced DNAzyme Recycling Amplification,(C)the work principle of biosensor.Copyright 2019 ACS
5 展望
ECL 生物传感器在生物分子检测领域展现出独特的优越性和广阔的应用前景,受到研究人员的广泛关注,已逐渐成为当前生命分析领域的研究热点。 随着更多核酸扩增的目标物转换策略的提出和纳米技术的发展,高灵敏和高特异性生物传感器被逐渐开发和应用。 虽然核酸扩增技术推动了ECL 生物传感的发展和革新,但在大多数情况下,ECL 传感检测的对象仅限于体外样品,无法灵敏准确获取细胞内一些生物分子的信息。 今后,性能更稳定、功能更多样、普适性更高的核酸扩增技术的设计以及微型化、 多通量的ECL 生物传感器的开发将会是传感领域的研究发展方向。
