小儿完全植入式静脉输液港导管相关性血流感染的诊治
——附4例报道
2020-11-03黄一敏徐伟珏吴一波盛庆丰刘江斌吕志宝
黄一敏 徐伟珏 吴一波 盛庆丰 刘江斌 吕志宝
完全植入式静脉输液港(totally implantable venous access ports,TIVAPs)是一种植入人体皮下,可长期留置在人体内的静脉输液装置。主要用于化疗药物、抗生素、静脉营养和血制品的长期输注以及反复的静脉采血[1]。尽管该输液装置改善了需要多次化疗或长期静脉营养等患儿的生活质量,但也可能发生感染、药物外渗、局部感染、导管断裂和移位及导管内栓子形成等并发症。其中导管相关性血流感染(catheter-related bloodstream infection,CRBSI)是一种较严重的并发症,可导致TIVAPs无法正常使用,影响疾病的治疗效果,严重感染可致患儿死亡。2014年3月至2017年12月上海市儿童医院99例患儿接受了TIVAPs植入术,其中4例出现CRBSI。现将4例患儿的临床表现及治疗经验总结如下。
材料与方法
一、临床资料
2014年3月至2017年12月上海市儿童医院共为99例患儿实施了TIVAPs植入手术。手术均由同一名主刀医生经右侧颈内静脉穿刺完成置管。99例患儿中男童58例,女童41例,年龄4~61个月,平均(18.96±16.85)个月。其中实体恶性肿瘤58例(58/99,58.6%)、血液恶性肿瘤38例(38/99,38.3%)、短肠综合征3例(3/99,3.1%)。出现CRBSI者共4例(4/99,4.0%),其临床资料如下:
病例1:男,3个月。患儿出生后因“先天性肠旋转不良、肠扭转、肠坏死”出现短肠综合征。因需进行全胃肠外营养(total parenteral nutrition,TPN)行TIVAPs植入术,使用4个月后出现CRBSI。
病例2:男,10个月。诊断为“急性髓性白血病”,化疗2次后行TIVAPs植入术,完成9个疗程化疗后(术后7个月)出现CRBSI。
病例3:男,10个月。因“急性淋巴细胞白血病”,化疗1次后行TIVAPs植入术,使用TIVAPs完成8个疗程化疗后(术后3个月)出现CRBSI。
病例4:男,23个月。诊断为“朗格汉斯细胞增多症”,化疗4次后行TIVAPs植入,使用TIVAPs完成后续4个疗程化疗,在进行TIVAPs维护期间(术后9个月)出现CRBSI。
所有患儿发病时体温>38℃,从导管及外周静脉抽血培养出同一种类及药敏结果的致病菌。在出现感染时,未发现TIVAPs局部软组织感染,亦未发现其他系统(如呼吸系统、泌尿系统等)感染症状。4例患儿的基本临床资料见表1。
二、治疗方法
4例患儿均先给予经验性抗生素治疗,待经导管和外周静脉抽血培养发现同一种细菌后,按药敏试验调整抗生素使用种类。同时选取敏感抗生素,按“抗菌锁”的药物浓度要求配制抗生素溶液:如万古霉素按1.0 mg/mL浓度配制,或泰能按1.5 mg/mL浓度配制,选取一种敏感的抗生素溶液2~3 mL,正压缓缓推入TIVAPs,使之充满港体及导管内。抗生素溶液封管后,不再使用TIVAPs输注任何药物及补液,改由外周静脉完成计划用药。“抗菌锁”治疗5~7 d后,如患儿体温正常,可再次经导管及外周静脉抽血行血培养检查。如血培养为阴性,可以停用所有抗生素,并重新启用TIVAPs。整个抗感染治疗周期约8~10 d。
三、TIVAPs材料
采用美国巴德公司生产TIVAPs(Bard Port 6.0Fr 5510型、7530型和6100C型)。
结 果
3例患儿在出现CRBSI时,予全身抗生素静滴 “抗菌锁”治疗,如体温正常,血培养转为阴性,TIVAPs继续留用。
1例出现CRBSI时,予上述抗感染治疗方案控制感染,继续使用TIVAPs后再次出现CRBSI,再次抗感染治疗效果不佳,被迫拔除TIVAPs。TIVAPs拔除后,患儿未再出现发热等感染症状,血培养转为阴性。4例患儿的治疗方式和疗效见表2。
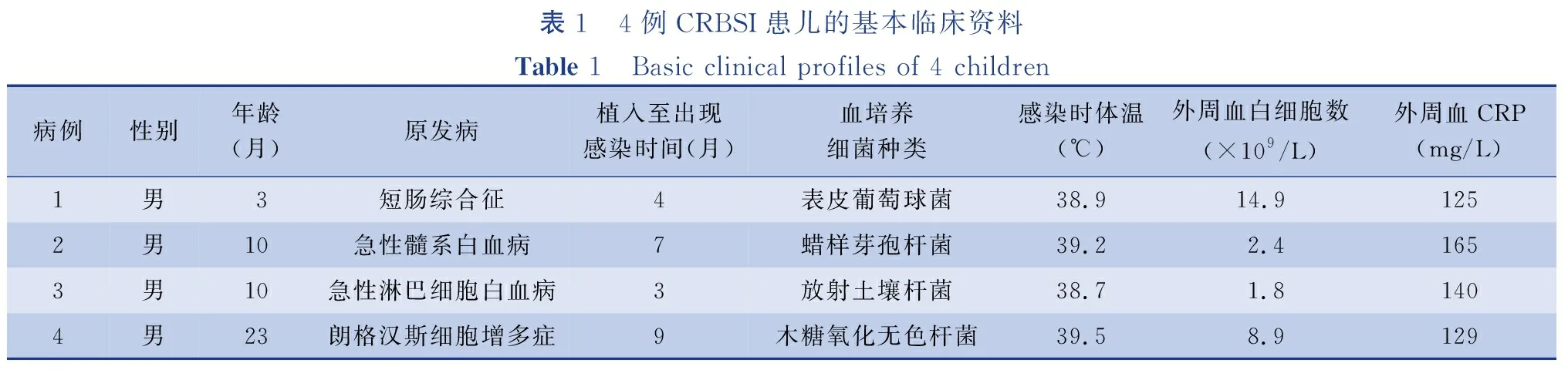
表1 4例CRBSI患儿的基本临床资料Table 1 Basic clinical profiles of 4 children 病例性别年龄(月)原发病植入至出现感染时间(月)血培养细菌种类感染时体温(℃)外周血白细胞数(×109/L)外周血CRP(mg/L)1男3短肠综合征4表皮葡萄球菌38.914.91252男10急性髓系白血病7蜡样芽孢杆菌39.22.41653男10急性淋巴细胞白血病3放射土壤杆菌38.71.81404男23朗格汉斯细胞增多症9木糖氧化无色杆菌39.58.9129

表2 4例CRBS患儿的治疗方式和疗效Table 2 Treatment modalities and efficacies of 4 children病例原发病全身抗生素剂量(mg/kg)频次应用时间(d)ALT抗生素浓度(mg/mL)ALT应用时间(d)治疗效果1短肠综合征 美罗培南 20每8 h一次8万古霉素(1.0) 5 感染未控制,拔管2急性髓系白血病 泰能 15每6 h一次 10泰能(1.5) 7感染控制3急性淋巴细胞白血病泰能 15每6 h一次 10万古霉素(1.0)7感染控制4朗格汉斯细胞增多症舒普深75每12 h一次8泰能(1.5) 5感染控制
讨 论
TIVAPs是一种植入人体皮下,可长期留置在人体内的静脉输液装置。主要用于化疗药物、抗生素、静脉营养和血制品的长期输注,以及反复的静脉采血[1]。TIVAPs的应用,极大地改善了肿瘤患者及一些需要长期进行静脉输液治疗患者的生活质量[2]。该技术在成人中已应用多年,随着临床需求扩大和TIVAPs技术的改进,越来越多的儿童在面临多次化疗或静脉营养等需要长期输液治疗时,也选择应用TIVAPs。
有文献报道,与经外周静脉置入中心静脉导管相比,TIVAPs没有外露导管装置,具有导管感染发生率较低,患者日常生活不受限制等优势[3]。但在TIVAPs应用中,难以避免并发症的发生,如术中穿刺导致的血气胸、空气栓塞、心律失常、神经损伤、药物外渗、局部感染、导管断裂和移位、导管内栓子形成等;其中CRBSI是一种较为严重的并发症。CRBSI是指带有血管内导管患者出现菌血症或真菌血症,并伴有发热(>38℃)、寒颤或低血压等感染症状,同时排除其他明确的感染源。如果从导管和外周血培养出同一种类及药敏结果的致病菌,即可确诊为CRBSI[4]。有文献报道应用TIVAPs的患者中CRBSI的发生率为3%~10%,如果感染控制无效,可导致TIVAPs被迫提早拔除,影响原发疾病治疗计划[5]。
本研究共有99例血液及实体恶性肿瘤、短肠综合征患儿接受了TIVAPs植入术,其中4例出现CRBSI,感染率约为4.0%,与文献报道的3%~10%的发生率相近。4例病例中,血液恶性肿瘤3例、短肠综合征1例。上述患儿均表现为使用TIVAPs期间无明显诱因出现反复发热,体温>38℃,且经导管和外周静脉血培养,发现同一种类及药敏结果的致病菌,因此可诊断为CRBSI。
据文献报道CRBSI产生的原因主要是TIVAPs更换蝶翼插针时导致体表的条件致病菌进入港体及导管内并成功定植,在使用TIVAPs时,细菌释放进入血液循环,从而产生菌血症[6]。而TIVAPs局部软组织感染或其他系统的感染很少经血液循环进入导管内引起感染[7]。本研究中,4例患儿分别于植入TIVAPs术后4个月、7个月、3个月和9个月后发生CRBSI,距TIVAPs植入术时间较久,且TIVAPs使用期间一切正常,因此推测CRBSI与植入手术可能无关。同时,4例患儿出现CRBSI时,亦未发现TIVAPs局部软组织感染及其他系统(如呼吸系统、泌尿系统等)的感染症状,且血培养检出的条件致病菌分别是:表皮葡萄球菌、放射土壤杆菌、蜡样芽孢杆菌和木糖氧化无色杆菌。综上所述,本研究认为产生CRBSI的原因可能是患儿进行了长时间的化疗及静脉营养,体表的条件致病菌经插针进入导管内并成功定植。该结果与文献报道产生CRBSI的原因是相符的。
在CRBSI的产生机理中,细菌生物膜的产生是一个重要环节。细菌生物膜是由细菌分泌产生的胞外多糖聚合物相互粘连形成细菌群落的膜状物,其主要成分包括多糖、纤维蛋白、纤连蛋白以及层黏连蛋白。它以较强的黏附力,黏附于活体表面或者医用材料,如各种人工瓣膜、人工关节、起搏器等物体表面和导管内壁。导管中细菌生物膜形成后,可以介导病原菌黏附和定植,使定植后的细菌迁移、扩散,随血液进入血液循环,引起菌血症等相关感染症状[8]。
形成了生物膜的细菌对抗生素的抵抗力比游离的未形成生物膜的细菌高100~1 000倍[9]。常规静脉使用抗生素能在一定程度上杀灭生物膜表面的细菌,却很难杀灭生物膜内部的细菌,导致感染持续存在。即使通过导管给药,常规的静脉滴注方式也无法有效消灭管道内定植的细菌。有文献介绍使用“抗菌锁”技术(antibiotic lock technique,ALT),由Messing等[10]在1988年率先提出,是一种将高于抗生素最低抑菌浓度的药物溶液灌注到导管腔内,保留一定时间,达到破坏细菌生物膜结构,治疗CRBSI的方法。类似用抗生素溶液将导管锁定,故称为“LOCK”技术[11,12]。目的是利用高浓度抗生素溶液与导管内细菌生物膜直接、持续接触,使药物有机会渗入到生物膜实质中,直至破坏其有效结构,从而有效清除生物膜内外的细菌[13]。同时配合外周静脉滴注敏感抗生素,可以显著提高CRBSI的治愈率。
本研究对4例CRBSI患儿采用了ALT治疗。根据血培养检出的细菌药敏结果,选取敏感抗生素,配制“抗菌锁”需要的浓度:如万古霉素按1 mg/mL配置、泰能按1.5 mg/mL配置,使用时选择一种敏感的抗生素溶液2~3 mL,缓慢正压注入TIVAPs内,每天注入1次,连续使用5~7 d。治疗期间停止经TIVAPs输注任何药物及液体,原发疾病计划用药改由外周静脉完成,同时配合全身抗生素治疗。ALT治疗5~7 d后,如患儿体温平稳3 d以上,再次经导管及外周静脉复查血培养,如结果均为阴性,提示感染控制,可暂停ALT治疗,重新启用TIVAPs。本组病例中3例经上述方法治疗,体温平稳,复查血培养转为阴性,感染得到控制。继续使用TIVAPs,未再出现感染症状。1例短肠综合征患儿出现CRBSI时,因肠道营养能量未达到需求,对TPN依赖而不得不继续使用TIVAPs。使用上述方式治疗7 d,感染症状缓解,重新启用TIVAPs进行TPN。但在使用数日后,再次出现发热等症状,在确诊CRBSI后,被迫拔除TIVAPs。使用外周静脉完成后续TPN,直至肠内营养的能量达到需求。TIVAPs拔除后,患儿未再出现发热等感染症状,复查血培养转为阴性,感染得到完全控制。
据统计,容易形成导管内生物膜的微生物前5位分别是表皮葡萄球菌、金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌和白假丝酵母菌(白色念珠菌)[14]。本组病例中,短肠综合征患儿的血培养结果检出表皮葡萄球菌,属于易形成细菌生物膜的菌种,且该患儿使用TIVAPs以输注脂肪乳剂等静脉营养物质为主,是产生CRBSI的高危因素之一。出现CRBSI后,尽管在治疗中应用了全身抗生素+“抗菌锁”来控制感染,但因患儿对静脉营养的依赖,未能给予足够的时间进行“抗菌锁”治疗并停用输液港。这些因素最终导致该病例治疗不彻底,再次出现CRBSI,被迫拔除TIVAPs。因此,经全身抗生素静滴+“抗菌锁”治疗,血培养结果仍为阳性,应考虑及时拔除TIVAPs,特别是当患儿检出较易形成生物膜的细菌种类时。
CRBSI的产生原因主要与TIVAPs使用阶段更换蝶翼插针有关,故应对TIVAPs使用及维护的护理人员进行规范化培训[15]。在TIVAPs使用和维护中严格遵守无菌操作原则,是预防CRBSI发生的关键[16]。在更换蝶翼插针时,应严格实施无菌消毒隔离措施,如使用消毒铺巾、局部使用洗必泰消毒液,擦拭插针部位及皮肤并停留30 s以上、操作人员需洗手、佩戴口罩帽子、戴无菌手套等。这些措施可以降低TIVAPs局部体表有条件致病菌定植的风险。使用肝素液冲管维护时,应使用正压脉冲式推注,以减少导管头端血液回流和积聚。
综上所述,使用TIVAPs出现CRBSI时,在全身使用抗生素静滴的同时,结合“抗菌锁”技术,是控制感染的有效方法。控制感染的疗效与感染细菌种类有关,细菌生物膜的形成是感染控制不佳的重要因素。如经全身抗生素静滴+“抗菌锁”治疗,血培养结果仍为阳性,应考虑及时拔除TIVAPs。TIVAPs使用和维护时需严格遵守无菌操作原则,这是预防CRBSI产生的关键。
