脊尾白虾低盐转录组信息挖掘
2020-11-02沈晔王兴强曹梅
沈晔 王兴强 曹梅


摘要 通过前期对自然海水组(盐度31.0)和淡水组(盐度0.2)脊尾白虾(Exopalaemon carinicauda)转录组的测序及分析,筛选出低盐胁迫下差异表达显著的基因并进行实时定量验证,同时进行KEGG通路富集分析,挖掘低盐胁迫相关信号通路,以期阐明脊尾白虾在低盐环境下的生理调控机制。转录组数据分析发现,脊尾白虾机体可能通过磺基转移酶活性的变化来调控类固醇、激素水平。表皮蛋白AMP5样的表达量的变化表明低盐胁迫可能影响脊尾白虾节间膜的形成。低盐胁迫试验实时定量结果显示,基因在鳃、肝胰腺和肌肉中的表達情况各有不同,并随时间的变化,基因的表达量也会有所波动。Hedgehog信号通路分析发现,低盐度胁迫条件下脊尾白虾C型凝集素和低密度脂蛋白受体相关蛋白表达上调,推测机体通过调控C型凝集素和低密度脂蛋白受体相关蛋白,促进低密度脂蛋白的代谢,水解得到的胆固醇与Smo结合,激活Hedgehog信号通路,以响应低盐胁迫。该研究挖掘了差异表达基因相关信号通路,推测低盐胁迫可能通过调控代谢相关酶的活性来促进脊尾白虾的生长代谢,并且低盐胁迫可能影响神经递质的调控过程。
关键词 脊尾白虾;低盐胁迫;转录组
中图分类号 Q786 文献标识码 A 文章编号 0517-6611(2020)19-0089-08
doi:10.3969/j.issn.0517-6611.2020.19.024
Abstract By sequencing and analyzing the transcriptome of Exopalaemon carinicauda in natural seawater (salinity 31.0) and fresh water (salinity 0.2) in the early stage, we screened out the genes with significant differential expression under low salt stress and carried out realtime quantitative verification. At the same time, the enrichment analysis of KEGG pathway was carried out to explore the signal pathway related to low salt stress, in order to clarify the physiological regulation mechanism of E. carinicauda in low salt environment. The results of transcriptome analysis showed that E. carinicauda might regulate steroid and hormone levels by increasing the activity of sulfotransferase. The downregulation of amp5like expression of epidermal protein suggests that low salt stress might affect the formation of internode membrane. The realtime quantitative results of low salt stress test showed that the expression of genes in gill, hepatopancreas and muscle were different, and with the change of time, the expression of genes would fluctuate. The analysis of hedgehog signaling pathway showed that the Ctype lectin and LDL receptor related proteins were upregulated under low salinity stress. It was speculated that the body could promote the metabolism of LDL by regulating the Ctype lectin and LDL receptor related proteins, and the hydrolyzed cholesterol binds to Smo, thus activating hedgehog signaling pathway in response to low salt stress. In this study, we explored the differentially expressed gene related signal pathways, and speculated that low salt stress might promote the growth and metabolism by regulating the activity of metabolism related enzymes, and low salt stress might affect the regulation process of neurotransmitters.
Key words Exopalaemon carinicauda;Low salinity stress;Transcriptome
基金项目 江苏省研究生科研与实践创新计划项目(SJCX18_0927);江苏省海洋生物技术重点实验室开放基金项目(HS16005);连云港市“海燕计划”科研项目。
作者简介 沈晔(1994—),女,江苏泰州人,硕士研究生,研究方向:水产动物增养殖。*通信作者,教授,博士,从事养殖生态学研究。
收稿日期 2020-02-22;修回日期 2020-03-20
盐度是影响甲壳类生长与存活的重要环境因素,对其耗氧率和抗氧化酶活力等產生显著影响,通过调节渗透压使其生理活动发生变化[1]。一些甲壳动物盐度适应范围广,如中国对虾(Fenneropenaeus chinensis)和脊尾白虾(Exopalaemon carinicauda)等[2-3]。盐度胁迫下,脊尾白虾孵化率和幼体成活率降低,三磷酸腺苷酶和超氧化物歧化酶活性均受到不同程度的影响[4-5]。丝氨酸蛋白酶抑制剂和蜕皮抑制激素等参与盐度胁迫的应激反应[6-7]。转录组测序可以对物种在各种环境条件下进行高通量测序,有助于了解该条件下某些生命过程中相关基因的表达情况,揭示其代谢网络及其调控机理[8-9]。张晓钗等[10]进行杜氏盐藻转录组测序,探讨不同浓度盐胁迫对其生长发育以及相关信号通路的影响。郝庆玲等[11]运用Illumina 2000测序筛选牛卵泡发育调控基因。水产动物的生长与其生存环境的状况有着密不可分的关系。转录组测序技术在大菱鲆(Scophthalmus maximus)、牙鲆(Paralichthys olivaceus)、青海湖裸鲤(Gymnocypris przewalskii)、大黄鱼(Larimichthys crocea)、尼罗罗非鱼(Tilapia nilotica)等水产动物在外界胁迫下的基因表达分析已有应用[12-16]。笔者基于以前通过第二代Illumina测序技术获得的脊尾白虾高通量转录组数据,对低盐胁迫下的差异表达基因进行筛选,并设计引物对其进行验证,同时挖掘代谢通路中差异基因表达情况,以期阐明脊尾白虾在低盐环境下的生理调控机制。
1 材料与方法
1.1 试验材料
试验在江苏海洋大学海水养殖动物病害实验室进行。试验用虾来自连云港南极路水产市场,均为规格整齐、体质健壮的个体,暂养7 d,以适应实验室环境,暂养期间海水温度24~26 ℃、盐度31.0、pH 8.25,溶解氧含量7.6~8.1 mg/L。
1.2 低盐胁迫试验
随机挑选120只脊尾白虾,湿重(4.12±0.56)g,自然海水组(盐度31.0)和淡水组(盐度0.2)每组设3个重复,每个水族箱中放养20只白虾,加入水体约30 L。待到淡水组脊尾白虾低盐胁迫致侧卧后,再过5 min左右整体取样,与海水组同时取样后将样品速冻于液氮中备用。
1.3 转录组测序
用液氮将脊尾白虾研磨均匀进行总RNA提取后,检测样品纯度、浓度和完整性合格后,合成得到片段大小合适的双链cDNA,最终通过PCR富集构建文库。检测文库的浓度和插入片段大小,并通过Q-PCR准确定量有效浓度,然后用Illumina HiSeq2500进行高通量测序。测序共得到13.92 Gb高质量数据,海水组(盐度31.0)与淡水组(盐度0.2)样品Q30碱基百分比不小于87.93%,质量较高。
1.4 差异表达基因筛选与验证
使用EBSeq进行差异表达分析,将错误发现率FDR(false discovery rate)<0.01且差异倍数FC(fold change)≥2作为筛选标准,最终得到自然海水组和淡水组样品间差异表达基因。筛选出显著上调和下调的前50个unigenes列表,再进一步筛选出感兴趣的差异表达基因,通过实时定量PCR的方法进行检验。实时定量验证试验将盐度骤降至0,盐度胁迫0、0.5、1.0、2.0、4.0和6.0 h后,每个时间段分别设3个重复,分别取脊尾白虾的鳃、肌肉、肝胰腺,液氮速冻保存。设计引物后,进行实时定量验证。
1.5 GO富集分析
利用topGO软件对自然海水组和淡水组样品间差异表达基因进行GO富集分析,挖掘显著富集节点中的差异表达基因,分析差异表达基因可能信使的分子功能。
1.6 KEGG通路富集分析
KEGG数据库是关于Pathway的主要公共数据库。通过GDP-L-岩藻糖合成酶样蛋白、甘氨酸受体亚α-2样、犬尿氨酸/α-氨基己二酸转氨酶、C型凝集素、α-微管蛋白等差异表达基因比对到相应的通路,分析KEGG通路注释示意图。
2 结果与分析
2.1 差异表达基因的筛选与验证
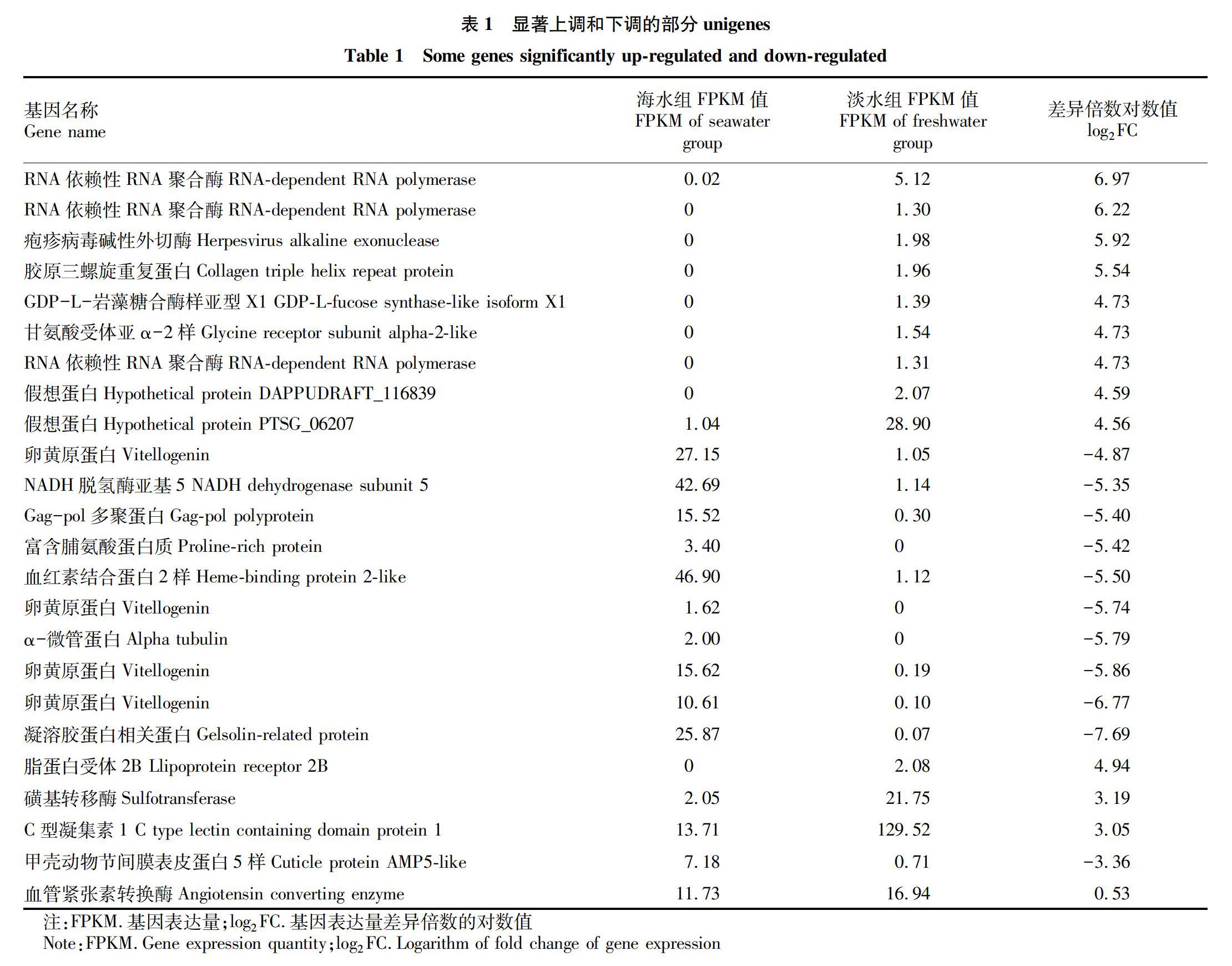
表1列出了显著上调和下调的部分unigenes的信息,差异表达最显著的基因分别是RNA依赖性RNA聚合酶和凝溶胶蛋白相关蛋白,log2FC分别为6.97和-7.69。从显著上调和下调的前50个unigenes中随机挑选脂蛋白受体2B、磺基转移酶、C型凝集素1、甲壳动物节间膜表皮蛋白5样和血管紧张素转换酶5个基因进行引物设计,表2为验证引物序列。
运用实时定量PCR测得差异表达基因在脊尾白虾不同部位(鳃、肝胰腺、肌肉)中的表达量,并得到差异倍数对数值(log2FC)随时间的变化。通过转录组测序得到该基因表达量差异倍数的对数值,作为参考值。如表3~5所示,LPR2B基因在鳃和肌肉中表达下调,在肌肉中差异不显著,在肝胰腺中不表达。Sulf和CTLDcp基因表达量在肝胰腺中呈波动变化,在鳃和肌肉中不表达。AMP5基因表达量在鳃中呈波动变化,在肝胰腺和肌肉中不表达。ACE基因在鳃中表达上调,呈先上升再下降的趋势,2.0 h时log2FC为1.96;在肌肉中呈波动变化,在肝胰腺中不表达。
2.2 GO富集分析
对海水组和淡水组的组间差异表达基因进行功能富集,主要富集到催化活性(catalytic activity)、表皮结构成分(structural constituent of cuticle)、水解酶活性(hydrolase activity)、跨膜转运蛋白活性(transmembrane transporter activity)、脂质转运蛋白活性(lipid transporter activity)等,其中催化活性富集显著性最高。表6为該节点中差异表达较显著的27个unigenes,其中表达量上调幅度最大的是犬尿氨酸/α-氨基己二酸转氨酶,log2FC为3.73;下调幅度最大的是脂肪酶,log2FC为-2.73。
2.3 KEGG通路富集分析
GDP-L-岩藻糖合成酶样基因比对到果糖及甘露糖代谢、氨基酸和核苷酸糖代谢等信号通路上。对果糖和甘露糖代谢通路进行展示(图1),结果显示低盐度胁迫条件下,脊尾白虾GDP-L-岩藻糖合成酶样蛋白和木糖异构酶样蛋白表达上调,而磷酸丙糖异构酶表达下调,以上基因的详细信息见表7。
甘氨酸受体亚α-2样基因比对到神经活性配体-受体相互作用信号通路上。对该通路进行展示(图2),结果显示低盐度胁迫条件下脊尾白虾甘氨酸受体亚α-2样基因表达量显著上调,而γ-氨基丁酸受体表达量显著下调,以上基因的详细信息见表8。
犬尿氨酸/α-氨基己二酸转氨酶基因比对到赖氨酸生物合成、色氨酸代谢、赖氨酸降解信号通路上,对赖氨酸降解信号通路进行展示(图3),结果显示低盐度胁迫条件下脊尾白虾犬尿氨酸/α-氨基己二酸转氨酶表达显著上调,乙醛脱氢酶1表达下调,γ-丁基甜菜碱双加氧酶表达有上调也有下调,以上基因的详细信息见表9。
C型凝集素比对到Hedgehog信号通路上,对该信号通路进行展示(图4),结果显示低盐度胁迫条件下脊尾白虾含C α-微管蛋白比对到吞噬体信号通路上。对该通路进行展示(图5),结果显示低盐度胁迫条件下脊尾白虾α-微管蛋白、C型凝集素2表达下调,心肌肌动蛋白(cardiac muscle actin)表达下调,以上基因的详细信息见表11。
3 讨论
表皮蛋白属于CPR(cuticular proteins with the Rebers and Riddiford Consensus)家族,参与蜕皮前后新表皮的形成,分为RR-1和RR-2两个亚家族,其中RR-1主要存在于甲壳动物节间膜(arthrodial membranes)部分[17-18]。磺基转移酶催化多种内源性和外源性复合物的硫化代谢过程,如类固醇、激素和生物胺类等,调节体内脂质稳态和激素水平[19]。该研究转录组数据分析发现,低盐胁迫显著提高磺基转移酶的表达,而表皮蛋白AMP5样表达显著降低;据此推测,脊尾白虾机体可能通过磺基转移酶活性的变化来调控类固醇、激素水平,表皮蛋白AMP5样的表达量变化表明低盐胁迫可能影响脊尾白虾节间膜的形成。低盐胁迫试验实时定量结果显示,基因表达量的上调和下调随时间的延长有所变化,且基因在不同组织中表达情况也有不同。这可能是由于实时定量验证所用模板为白虾的不同组织,且测量了0、0.5、1.0、2.0、4.0和6.0 h几个时间点,而转录组测序是低盐胁迫后单一时间点的全虾整体混合测序。
通过差异表达基因比对到低盐胁迫相关的信号通路有果糖及甘露糖代谢通路、神经活性配体-受体相互作用信号通路和赖氨酸降解信号通路等。GDP-L-岩藻糖是L-岩藻糖的活性核糖形式,参与岩藻糖基化反应,是糖类代谢中间体。赖氨酸为机体必需氨基酸,其中动物可吸收利用的赖氨酸为L-型赖氨酸,是水产饲料中重要的添加剂之一,在通路中被犬尿氨酸转氨酶Ⅲ/L-谷氨酰胺转氨酶转变为α-酮-ε-氨基己酸,通路的中间物哌啶酸与γ-氨基丁酸受体结合并参与神经递质的调控过程[20]。甘氨酸和γ-氨基丁酸都是主要的抑制性神经递质,通过其受体介导发挥作用,研究显示γ-氨基丁酸A受体能抑制甘氨酸受体[21]。该研究挖掘了上述通路中差异表达基因的表达情况,推测低盐胁迫可能通过提高GDP-L-岩藻糖合成酶、犬尿氨酸/α-氨基己酸转氨酶的表达,调节脊尾白虾机体的生长代谢,并且低盐胁迫可能影响神经递质的调控过程。
Hedgehog信号通路在多种生理调控中起着关键作用,参与细胞生长、分化以及组织器官的损伤修复和免疫调节[22]。Hedgehog通路中的关键因素包括信号配体(Hedgehog,Hh)、受体Patched(Ptch)和Smoothened(Smo)。胆固醇是Smo的内源性配体,通过与Smo结合和共价连接起作用[23]。巨蛋白(Megalin)属低密度脂蛋白受体家族,其配体主要有维生素结合蛋白、脂蛋白、低分子量蛋白及激素和受体相关蛋白等[24-25]。低密度脂蛋白受体是一种细胞表面糖蛋白,与低密度脂蛋白结合后经胞吞作用使胆固醇酯水解,对调节体内胆固醇平衡起重要作用[26-27]。甲壳动物不具有抗体介导的免疫反应,凝集素作为先天性免疫中一种的模式识别受体在其机体内发挥重要作用,其中C型凝集素是首次被发现的动物凝集素[28]。C型凝集素通常有至少1个C型凝集素结构域,具有识别糖类的作用。其中,含有非Ca2+依赖的C型凝集素结构域的常称之为非经典C型凝集素,可识别蛋白质和脂类等非碳水化合物配体,如氧化低密度脂蛋白等[29]。该研究通过对Hedgehog信号通路的分析发现,低盐度胁迫条件下脊尾白虾C型凝集素和低密度脂蛋白受体相关蛋白均上调,推测机体通过调控低密度脂蛋白受体相关蛋白和C型凝集素,促进低密度脂蛋白的代谢,水解得到的胆固醇与Smo结合,激活Hedgehog信号通路以响应低盐胁迫。
该研究挖掘了脊尾白虾低盐胁迫相关信号通路以及差异表达基因数据,获取了脊尾白虾低盐胁迫相关的基因资源,丰富了脊尾白虾转录组数据库,可为今后进行脊尾白虾低盐胁迫生理机制的探讨和关键基因的克隆等提供技术支撑。
参考文献
[1] CHOI C Y,AN K W,AN M I.Molecular characterization and mRNA expression of glutathione peroxidase and glutathione Stransferase during osmotic stress in olive flounder(Paralichthys olivaceus)[J].Comparative biochemistry and physiology:Part A,2008,149(3):330-337.
[2] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004:1-371.
[3] LI J T,MA P,LIU P,et al.The roles of Na+/K+ -ATPase αsubunit gene from the ridgetail white prawn Exopalaemon carinicauda in response to salinity stresses[J].Fish and shellfish immunology,2015,42(2):264-271.
[4] 李国峰,张振华,严玉洲.脊尾白虾在低盐度水体中的人工繁育试验[J].水产养殖,2000(1):6-7.
[5] 李玉全,李永生,赵法箴.盐度渐变与骤变对脊尾白虾渗透、代谢及免疫相关酶活力的影响[J].生态学报,2015,35(21):7229-7235.
[6] 李洋,刘萍,李健,等.脊尾白虾丝氨酸蛋白酶抑制剂基因克隆及表达分析[J].中国水产科学,2013,20(6):1166-1174.
[7] 张美.脊尾白虾高血糖激素家族基因的克隆、表达及功能研究[D].大连:大連海洋大学,2015.
[8] VAN DIJK E L,AUGER H,JASZCZYSZYN Y,et al.Ten years of nextgeneration sequencing technology[J].Trends in genetics,2014,30(9):418-426.
[9] KLEPPE L,EDVARDSEN R B,FURMANEK T,et al.Global transcriptome analysis identifies regulated transcripts and pathways activated during oogenesis and early embryogenesis in atlantic cod[J].Molecular reproduction and development,2014,81(7):619-635.
[10] 张晓钗,李亮,何宁芳,等.不同盐度胁迫下杜氏盐藻全转录组测序及注释[J].微生物学报,2019,59(7):1342-1353.
[11] 郝庆玲,景炅婕,朱芷葳,等.基于Illumina平台转录组测序筛选牛卵泡发育调控基因[J].湖南农业大学学报(自然科学版),2019,45(1):60-67.
[12] 杨凯,黄智慧,马爱军,等.高温胁迫条件下大菱鲆肾脏转录组研究[J].渔业科学进展,2020,41(1):86-95.
[13] 聂苗苗.大菱鲆与牙鲆耐低温机制初探及连锁SNP标记筛选[D].青岛:中国科学院大学(中国科学院海洋研究所),2019.
[14] 周秉正,赵凯.盐度胁迫下青海湖裸鲤组织学和转录组分析[C]//第八届中国西部动物学学术研讨会会议摘要汇编.成都:四川省动物学会,2019:99.
[15] 韩兆方.大黄鱼转录组数据分析及密集胁迫前后皮肤转录组变化[D].厦门:集美大学,2016.
[16] 张旭,周毅,罗永巨,等.光周期影响罗非鱼脑组织转录组基因表达分析[J].西南农业学报,2019,32(11):2704-2711.
[17] 苗泽龙,吕艳杰,张俊芳,等.日本沼虾表皮蛋白基因的克隆及表皮组织差异性表达分析[J].河南师范大学学报(自然科学版),2018,46(2):79-83.
[18] 张宇.日本沼虾表皮蛋白基因的克隆及分析[D].新乡:河南师范大学,2017.
[19] 梁健,王欢,付常振,等.磺基转移酶SULT在疾病中的作用[J].生理科学进展,2019,50(5):381-386.
[20] HALLEN A,JAMIE J F,COOPER A J L.Lysine metabolism in mammalian brain:An update on the importance of recent discoveries[J].Amino acids,2013,45(6):1249-1272.
[21] FODOR L,BOROS A,DEZSO P,et al.Expression of heteromeric glycine receptorchannels in rat spinal cultures and inhibition by neuroactive steroids[J].Neurochemistry international,2006,49(6):577-583.
[22] 闵明,王婷婷,张继东.Hedgehog信号传导通路及其生物学功能[J].中国免疫学杂志,2019,35(15):1903-1906,1912.
[23] HU A,SONG B L.The interplay of Patched,Smoothened and cholesterol in Hedgehog signaling[J].Current opinion in cell biology,2019,61:31-38.
[24] KUKIDA M,SAWADA H,DAUGHERTY A,et al.Megalin:A bridge connecting kidney,the reninangiotensin system,and atherosclerosis[J].Pharmacological research,2020,151:1-7.
[25] 黄爱霞.巨蛋白的研究进展[J].国外医学(泌尿系统分册),2002,22(4):251-254.
[26] 杨洪雁,苏双良,付晶,等.低密度脂蛋白受体基因研究进展[J].东北农业大学学报,2013,44(3):141-146.
[27] YANG H X,ZHANG M,LONG S M,et al.Cholesterol in LDL receptor recycling and degradation[J].Clinica chimica acta,2020,500:81-86.
[28] 王英慧.日本沼虾C型凝集素及其配体螺原体糖基化蛋白的功能研究[D].南京:南京师范大学,2017:14-17.
[29] 谢建辉,顾建新.C型凝集素[J].生命科学,2011,23(6):555-562.
