绿豆子叶节离体再生体系优化
2020-11-02张勤雪闫强袁星星
张勤雪 闫强 袁星星


摘要 以绿豆(Vigna radiata (L.) Wilczek)幼嫩健康的子叶节为外植体,对影响其再生的2个关键因素——绿豆基因型和培养基植物生长调节剂配比开展筛选试验,建立绿豆子叶节离体再生体系。在筛选的100份种质资源中,8份材料再生效果好,同時发现适宜不定芽分化的培养基配方为B5+1.0 mg/L 6-BA +1.0 mg/L KT+0.1 mg/L IBA,适宜不定根诱导的培养基配方为1/2MS+1 mg/L IBA。通过此次试验,初步建立起了适合国内应用的绿豆子叶节外植体离体再生体系。
关键词 绿豆;子叶节;离体;再生体系;优化
中图分类号 S522 文献标识码 A
文章编号 0517-6611(2020)19-0034-04
doi:10.3969/j.issn.0517-6611.2020.19.009
Abstract Using the young and healthy cotyledon nodes of Vigna radiataas explants,a screening experiment was conducted to establish two key factors (Vigna radiata genotype and medium plant growth regulator ratio) affecting its regeneration,and an in vitro regeneration system of Vigna radiata cotyledon nodes was established.Among the 100 germplasm resources screened,8 materials had good regeneration capacity,and found that the medium suitable for adventitious bud differentiation was B5+1.0 mg/L 6-BA+1.0 mg/L KT+0.1 mg/L IBA;the optimal adventitious rootinducing medium formula was 1/2MS+1 mg/L IBA.Through this experiment,an in vitro regeneration system of Vigna radiata cotyledonary explants suitable for domestic production and application was initially established.
Key words Vigna radiata (L.) Wilczek; Cotyledonary node;In vitro;Regeneration system;Optimization
基金项目 国家重点研发项目(2016YFE0203800);国家自然科学基金项目(31871696);国家食用豆产业技术体系生物防治与综合防控岗位科学家项目(CARS-08-G15);江苏特粮特经产业技术体系集成创新中心项目(JATS〔2018〕255)。
作者简介 张勤雪(1991—),女,河北邯郸人,博士研究生,研究方向:绿豆遗传育种。*通讯作者,薛晨晨,副研究员,博士,从事绿豆遗传育种研究;陈新,研究员,博士,博士生导师,从事绿豆遗传育种研究。
收稿日期 2020-01-17;修回日期 2020-03-16
绿豆(Vigna radiata(L.)Wilczek)是重要的谷类豆类作物和膳食蛋白质的良好来源,在东南亚、南美洲和澳大利亚都有广泛种植[1]。绿豆因为含有比其他豆类更高水平的叶酸和铁而受到青睐[2]。世界上对绿豆植株再生的研究较少,现有的报道中绿豆的体外再生方法包括从子叶[3]、芽尖[4-5]、嫩叶[6]都能成功地再生成完整植株,目前来说,研究和应用比较多的是子叶节再生体系[7-8]。子叶节是在多种豆类作物中公认的利于再生的外植体,在大豆[9-12]、豇豆[13]和绿豆[8]中都有报道,但不同的作物间使用子叶节外植体的体系方法不同。尽管以子叶节为外植体可能会存在不定芽的相互抑制,再生困难以及转化时会出现嵌合体等问题,但仍然被认为是用于豆类作物再生的比较理想的外植体。
植物生长调节剂的合理组合搭配使用,这对于豆类再生率的影响极大,1.1 mg/L 6-BA处理可以使大豆“合丰35”子叶节再生率达98%,平均芽数为3.56个[12];Sonia等[7]研究发现1.0 mg/L 6-BA可以使绿豆PUSA-105子叶节不定芽分化率高达100%,平均芽数为5.3;Bakshi等[13]认为1.0 mg/L 6-BA+0.1 mg/L KT可以使豇豆品种Pusa Komal子叶节再生率达87%,平均芽数为6.72。植株再生是大多数遗传转化工作的基础,而豆类作物的再生对基因型有一定的依赖。绿豆再生体系在国内鲜见报道,为促进国内绿豆遗传转化体系的建立,该试验以绿豆子叶节为外植体,研究不同的植物激素和不同基因型对子叶节愈伤组织和不定芽诱导的影响,找出最适的基因型和相匹配的植物生长调节剂浓度,为国内绿豆的再生体系建立以及后期遗传转化工作奠定基础。
1 材料与方法
1.1 试验材料 供试材料来自亚蔬中心、中国、泰国和日本的绿豆材料100份。
1.2 试验方法
1.2.1 培养基及培养条件。
萌发培养基为MS培养基+1.0 mg/L 噻苯隆(TDZ)+0.5%琼脂+3%蔗糖。不定芽诱导培养基分以下3种配方,均以B5培养基为基础,配方1添加1.0 mg/L苄氨基腺嘌呤(6-BA)、1.0 mg/L 激动素(KT)和0.1 mg/L吲哚丁酸(IBA);配方2添加1.0 mg/L 6-BA和0.1 mg/L IBA;配方3添加1.0 mg/L 6-BA。不定芽伸长培养基用B5基本培养基加0.1 mg/L IBA和0.2 mg/L 6-BA。生根培养基为MS基本培养基加1.0 mg/L IBA。以上所有培养基pH均为5.8。培养温度为(25±2)℃。光照度3 000~5 000 lx,光/暗周期为16 h/8 h。
1.2.2 外植体制备。灭菌消毒后的种子接种于萌发培养基光照培养4 d,切除上胚轴和子叶,并在子叶节处轻轻划伤,以带有4~5 mm下胚轴为外植体。
1.2.3 外植体愈伤组织诱导效率计算。
将子叶节分别接种于3种不同的培养基上进行愈伤组织诱导。每14 d继代1 次,30 d后统计外植体表现。愈伤组织诱导率=有愈伤组织的外植体数/接种的外植体总数×100%。
1.2.4 不同基因型对子叶节外植体愈伤组织形成的影响及不定芽分化情况。
将100份不同基因型的子叶节接种于不定芽诱导培养基上进行愈伤组织诱导。28 d后统计不同基因型愈伤组织诱导率,56 d后统计不定芽分化情况。
1.2.5 不定芽的伸长。将不定芽连同部分愈伤组织分别转接到不定芽伸长培养基上,同时观察不同基因型材料的伸长情况。
1.2.6 不定根的诱导。待芽苗伸长至3~4 cm后,转接到生根培养基上,比较不同浓度的激素对不定根生长诱导的影响;14 d后统计芽苗的生根率:生根率=形成不定根的苗数/总转接的苗数×100%。
1.2.7 炼苗与移栽。待绿豆苗长出5根以上,长度超过2 cm的不定根后,打开瓶盖,补充少量的灭菌水,放置于恒温条件下进行炼苗,3~4 d后取出绿豆苗并清洗去掉根部的培养基,移栽至装有蛭石的花盆中,置于温室进行生长。
2 结果与分析
2.1 不同激素组成对外植体愈伤组织形成的影响
绿豆外植体的愈伤形成能力与培养基内添加的激素有很大关系,该试验随机选择8份绿豆材料(124、137、149、174、175、179、180、184)的外植体,分别接种在3种不同浓度激素的不定芽诱导培养基上,第15天开始统计子叶节外植体愈伤组织的形成情况。由图1可见,同一种材料在不同配方上表现的愈伤形成能力不同,综合8份材料的整体表现,可以发现在配方1(培养基B5+1.0 mg/L 6-BA +1.0 mg/L KT+0.1 mg/L IBA)上子叶节外植体愈伤组织形成率最高,该现象在多个材料中表现一致。因此推断配方1培养基适合绿豆子叶节愈伤组织的形成。
2.2 不同基因型对子叶节外植体愈伤组织形成的影响
由图1可见,同一种配方培养基下,不同的基因型材料表现的愈伤形成能力各有不同,证明绿豆子叶节愈伤的形成与材料的基因型也有很大关系。
将100份不同基因型的子叶节接种于配方1培养基上进行愈伤组织诱导。将愈伤组织诱导率分为5个等级:1级,愈伤组织诱导率为0;2级,愈伤组织诱导率为0.01%~30.00%;3级,愈伤组织诱导率为30.01%~70.00%;4级愈伤组织诱导率为70.01%~99.00%;5级愈伤组织诱导率为99.01%~100%。从图2可以看出,不同基因型子叶节外植体愈伤组织形成率各不相同,其中愈伤组织诱导率为70%以上的基因型有44个,这些基因型的子叶节愈伤组织诱导率较高,比较适宜作为绿豆再生体系建立的材料。
2.3 不同基因型对子叶节外植体不定芽形成的影响
将100份基因型的外植体继续观察,结果发现(图3),并非形成了愈伤就能形成不定芽,全部材料中有8份材料能很好地形成不定芽,整体生长状况很好,但这8份材料并非全是愈伤形成率最高的,可见愈伤组织形成率与不定芽生成率并无直接关系。其中66%材料没有不定芽生成,可见大部分的绿豆基因型不太容易长不定芽。
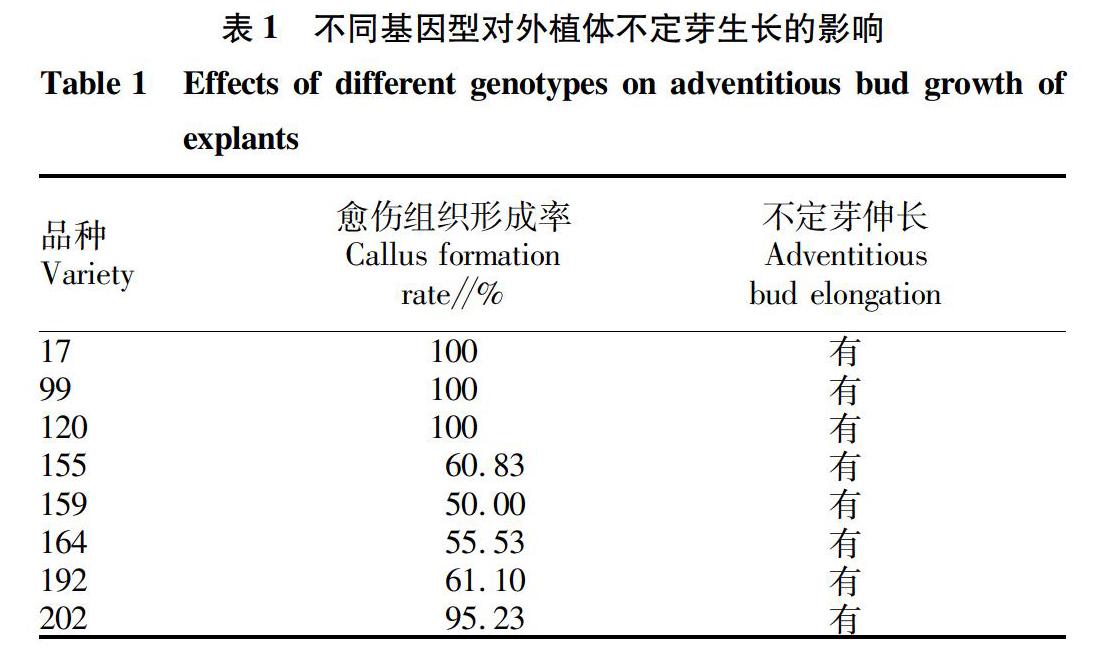
2.4 不同基因型对外植体不定芽生长的影响
选取8份不定芽生长较好的材料,将不定芽连同部分愈伤组织分别转接到不定芽伸长培养基上,观察8份基因型材料的不定芽伸长情况,结果发现(表1),在芽伸长培养基中,全部的试验材料都有不定芽伸长,因此推测绿豆的不同基因型仅对子叶节愈伤组织的形成有影响,对后期不定芽的伸长影响不大。
2.5 IBA浓度对不定根诱导的影响
外植体在不定芽伸长培养基上持续生长,待芽苗伸长至 3~4 cm后,分别转接到1/2MS+0.1 mg/L IBA、1/2MS+0.5 mg/L IBA和1/2MS+1.0 mg/L IBA培养基上,比较不同激素浓度对不定根诱导的影响,14 d 后统计芽苗的生根率。从表2可以看出,使用浓度为0.1和0.5 mg/L 的IBA不促進绿豆无菌苗生根,而1.0 mg/L IBA的平均根数2.35。
2.6 绿豆再生体系优化
总结试验结果,初步优化了绿豆再生体系。将灭菌后绿豆种子(优选192品种)在萌发培养基(MS培养基 +1.0 mg/L TDZ+0.5%琼脂+3%蔗糖)生长4 d(图4a),切除上胚轴,部分下胚轴和子叶的外植体(图4b)分别接种在不定芽诱导培养基(B5+1.0 mg/L 6-BA +1.0 mg/L KT+0.1 mg/L IBA)上生长(图4c)。每隔14 d进行继代一次,等外植体长出不定芽后,移植到不定芽伸长培养基(B5+0.1 mg/L IBA+0.2 mg/L 6-BA)进行不定芽促伸长过程(图4d)。待芽苗伸长至 3~4 cm后,转接到生根培养基(MS+1.0 mg/L IBA)上,待绿豆苗长出5根以上、长度超过2 cm的不定根(图4e)后,去掉瓶盖,在培养瓶中加入少量的蒸馏水,放置于培养室进行炼苗,3 d后取出绿豆苗并清洗去掉根部的培养基,移栽至装有蛭石的花盆中,置于温室进行生长(图4f)。
3 討论与结论
外植体再生过程中会受到外植体的取材部位、切割方法以及外植体的年龄等因素影响[14],不同的材料情况各异;虽然Sonia等[7]认为16 h苗龄最佳,但是绿豆的种子16 h后的外植体较小,不利于试验操作和外植体存活。尽管不同苗龄外植体都会产生丛生芽,但是随着外植体的年龄增加,芽的频率和数量都会减少。早期研究表明,6 d苗龄的子叶节外植体再生频率及不定芽数量会降低[15-16]。因此该试验所用的外植体是苗龄为4 d的去除子叶的绿豆子叶节,该选择既能便于操作,又尽可能减少对再生频率的影响。
植物生长调节剂是植物离体再生的重要因素[17]。由于在豆类作物中6-BA被发现是最有效且广泛使用的细胞分裂素,在绿豆外植体诱导不定芽试验中此前已有报道[3,15]。在一定范围内6-BA 的浓度可与外植体不定芽的数量成正比,4.0 mg/L 6-BA和0.05 mg/L IBA的组合可以使大豆不定芽分化率达到最大值[18]。但激素浓度过大也同时会影响不定芽的生长,大豆和绿豆虽然同属于豆科,但仍有较大差异,其使用浓度有待验证。另外有研究表明,1 mg/L的6-BA条件下,绿豆的子叶节外植体再生率最高[8];Mendoza等[19]研究表明再生过程中添加1 mg/L或2 mg/L KT有利于绿豆外植体的再生。因此,该试验借鉴其他豆类的研究结果,以不同浓度的6-BA、KT和IBA为主要细胞分裂素(或生长素类物质)分别进行外植体再生研究,3种不同激素配比的培养基诱导愈伤组织形成,结果表明,在配方1(培养基B5+1.0 mg/L 6-BA+1.0 mg/L KT+0.1 mg/L IBA)上不同品种绿豆子叶节外植体愈伤组织形成率最高(除了175品种显示持平);在配方2(培养基B5+1.0 mg/L 6-BA+0.1 mg/L IBA)和配方3(培养基B5+1.0 mg/L 6-BA)上愈伤组织诱导率变幅在0~80%,相比于配方1,愈伤组织诱导率略低,甚至品种137、149、184的愈伤组织诱导率为0。因此考虑试验结果的广适性,以配方1较适合绿豆不定芽诱导。
筛选再生能力较强的基因型是高频率诱导绿豆再生植株的关键,也是绿豆高效再生体系建立的前提。Sonia等[7]研究表明不同基因型绿豆子叶节的不定芽率在45%~100%,Bakshi等[13]研究表明不同基因型绿豆子叶节的不定芽率在16%~87%。但国内外绿豆资源不全相同,大部分国外试验材料不适宜国内研究和应用,筛选出适合国内研究应用的绿豆材料,对国内绿豆研究意义重大。该试验对绿豆100个基因型的再生能力进行研究,发现不同基因型之间的愈伤组织诱导率有很大差异,愈伤组织诱导率在0~100%,其中愈伤组织诱导率为30.01%~70.00%的基因型最多。继续试验发现66%的品种再生能力较低,子叶节外植体所产生的愈伤组织全部褐化,无不定芽产生,因此并非能长出愈伤就能很好地开展再生,或者该类型基因型需要特殊的激素条件进行生长。8份材料不定芽再生能力最强,虽然愈伤形成率并非都最高,但都能很好地形成不定芽,其后完成不定芽伸长和生根的过程,证明绿豆的再生体系最关键的一步仍然是不定芽诱导。该试验以8份材料为试验对象,优化了绿豆的再生体系,为绿豆的无性繁殖技术以及遗传转化体系建立奠定了一定的基础。
参考文献
[1] VIJAYAN S,BEENA M R,KIRTI P B.Simple and effective regeneration of mungbean (Vigna radiata (L) Wilczek) using cotyledonary node explants[J].Journal of plant biochemistry and biotechnology,2006,15(2):131-134.
[2] KEATINGE J D H,EASDOWN W J,YANG R Y,et al.Overcoming chronic malnutrition in a future warming world:The key importance of mungbean and vegetable soybean[J].Euphytica,2011,180(1):129-141.
[3] GULATI A,JAIWAL P K.Culture conditions effecting plant regeneration from cotyledons of Vigna radiata (L.) Wilczek[J].Plant cell,tissue and organ culture,1990,23(1):1-7.
[4] BAJAJ Y P S,DHANJU M S.Regeneration of plants from apical meristem tips of some legumes[J].Current science,1979,48:906-907.
[5] GULATI A,JAIWAL P K.In vitro induction of multiple shoots and plant regeneration from shoot tips of mung bean (Vigna radiata (L.) Wilczek)[J].Plant cell,tissue and organ culture,1992,29(3):199-205.
[6] PETAL M B,BHARDWAJ R,JOSHI A.Organogenesis in Vigna radiata (L.) Wilczek[J].Indian journal of experimental biology,1991,29:619-622.
[7] SONIA,SAINI R,SINGH R P,et al.Agrobacterium tumefaciens mediated transfer of Phaseolus vulgaris αamylase inhibitor1 gene into mungbean Vigna radiata (L.) Wilczek using bar as selectable marker[J].Plant cell reports,2007,26(2):187-198.
[8] SAHOO D P,KUMAR S,MISHRA S,et al.Enhanced salinity tolerance in transgenic mungbean overexpressing Arabidopsis antiporter (NHX1) gene[J].Molecular breeding,2016,36(10):144.
[9] 王萍,王軍军,商德虎,等.影响大豆子叶节丛生芽形成的诱导因子研究[J].吉林农业科学,2001,26(6):20-23.
[10] 孙昕.吉育 47 大豆子叶节遗传转化体系的建立与优化[D].长春:吉林大学,2013.
[11] WRIGHT M S,GARNES M G,HINCHEE M A,et al.Plant regeneration from tissue cultures of soybean by organogenesis[J].Plant regeneration and genetic variability,1986,3:111-119.
[12] 林树柱,曹越平,卫志明,等.6-BA 诱导大豆子叶节和茎尖出芽的研究[J].上海交通大学学报 (农业科学版),2005,23(2):138-142.
[13] BAKSHI S,ROY N K,SAHOO L.Seedling preconditioning in thidiazuron enhances axillary shoot proliferation and recovery of transgenic cowpea plants[J].Plant cell,tissue and organ culture,2012,110(1):77-91.
[14] COLLADO R,VEITA N,BERMU′DEZCARABALLOSO I,et al.Efficient in vitro plant regeneration via indirect organogenesis for different common bean cultivars[J].Scientia horticulturae,2013,153:109-116.
[15] GULATI A,JAIWAL P K.Plant regeneration from cotyledonary node explants of mungbean (Vigna radiata (L.) Wilczek)[J].Plant cell reports,1994,13(9):523-527.
[16] JAIWAL P K,KUMARI R,IGNACIMUTHU S,et al.Agrobacterium tumefaciensmediated genetic transformation of mungbean (Vigna radiata L.Wilczek)A recalcitrant grain legume[J].Plant science,2001,161(2):239-247.
[17] 陈海军,刘嘉伟,李佳,等.黑果枸杞 (Lycium ruthenicum) 组织培养与再生体系的建立[J].内蒙古农业大学学报(自然科学版),2018,39(4):14-23.
[18] 赖冰冰,韩阳,李春风,等.大豆子叶节植株再生体系的研究[J].大豆科学,2011,30(2):303-305.
[19] MENDOZA A B,FUTSUHARA Y.Varietal differences on plant regeneration by tissue culture in mungbean Vigna radiata (L.) Wilczek[J].Japanese journal of breeding 1990,40(4):457-467.
