败酱草总黄酮部位体外抗病毒活性成分研究
2020-11-02王文琪李媛媛王双朱彦军孙梦佳蔡馥洁孙晓慧柳晴周洪雷
王文琪,李媛媛,王双,朱彦军,孙梦佳,蔡馥洁,孙晓慧,柳晴,周洪雷
(山东中医药大学 药学院,山东 济南 250355)
败酱草(Patrinia Herb)是败酱科植物白花败酱、黄花败酱的全草,黄花败酱为主要品种,又名龙芽败酱、黄花龙牙、苦菜、鹿肠等,始载于《神农本草经》,中医认为败酱草味辛、苦,性凉,入胃、大肠、肝经,有清热解毒,消痈排脓,活血行瘀和抗病毒的功效,用于治疗肺痈、肠痈、痈肿疮毒以及赤白带下,产后瘀阻腹痛等[1]。
目前,已证实败酱草水提液对呼吸道合胞病毒(RSV)具有显著抑制作用[2]。现在治疗病毒性疾病的大多为干扰素及核苷类药物,存在副作用大、易反复、耐药性显著、价格昂贵且疗程长等不足。而中药对病毒具有多重作用,毒副作用小,很少产生耐药性,能增强机体免疫功能,具有较为显著的优势。
败酱草为我国传统中药,在国内南北各地均有分布,其有效成分主要为黄酮、三萜皂苷、环烯醚萜、挥发油、甾醇、香豆素、木脂素等[3],近年来研究发现该药具有广泛的药理作用和很高的临床药用价值[4]。
谭超等[5]发现黄花败酱草的蒸馏液部位在体外对大肠杆菌、链球菌、金黄色葡萄球菌的抑菌活性较强,而醇提部位的抑菌活性不高。Xu等[6]发现败酱草水提部位有明显的抗HIV病毒活性。但败酱草总黄酮部位的具体抗病毒活性成分的报道并不多见。本文采用细胞病变法对败酱草总黄酮部位进行体外抗病毒活性筛选,并通过LC-MS对其活性成分进行定性分析,为败酱草抗病毒活性的深入研究奠定基础。
1 仪器与试药
1.1 仪器
CO2恒温培养箱(日本SANYO);生物安全柜(济南鑫贝西公司);酶标仪,四级杆-静电场轨道阱超高分辨质谱仪,UltiMate3000 超高相液相色谱仪(Thermo Fisher Scientific)。
1.2 材料
细胞株:非洲绿猴肾细胞(vero)(RSV、HSV-1敏感细胞)、横纹肌瘤细胞(RD)(EV-71敏感细胞)来自山东省医学科学院基础医学院研究所微生物室。
病毒株:呼吸道合胞病毒(RSV)、肠道 EV-71 病毒(EV-71)、单纯疱疹 I 型病毒(HSV-1)来自中国疾病预防控制中心病毒病研究所流感病毒研究室。
对照品:绿原酸(批号:161146-160831)、咖啡酸(批号:161181-161020)、木犀草苷(批号:161165-160918)(江苏永健医药科技有限公司);山奈素(批号:S24N7D25625)、槲皮素(批号:C20J6Y1722)、山奈酚(批号:C26J8Y38642)(上海源叶科技有限公司);芦丁(批号:BCY-000507,江西佰草源生物科技有限公司)。

2 方法与结果
2.1 样品的制备
取败酱草50 g粉碎,6倍量石油醚(沸程60~90 ℃)回流脱脂(2次,每次1 h),12倍量水85 ℃条件下温浸(3次,每次2 h),合并药液,过滤浓缩。水提液中加入1/4倍量的Sevag试剂,剧烈振摇30 min,3000 r/min离心10 min,弃下层有机相。上清液浓缩至50 mL,加入体积分数95%乙醇,边加边搅拌,至醇含量达80%,冷藏静置12 h后抽滤。将醇沉上清液部位以水溶解至0.5 g/mL,用0.1 mol/L的HCL调pH至4.2,抽滤,滤液上D101大孔吸附树脂柱,静置吸附12 h,然后依次用蒸馏水,10%、30%、50%的乙醇梯度洗脱,每个梯度洗脱4 BV,流速为4 BV/h,洗脱液浓缩干燥,得各梯度洗脱部位。
2.2 体外抗病毒活性部位的筛选
2.2.1 细胞复苏与传代
2.2.2 药物体外抗病毒实验
将样品用细胞维持液以2倍比做系列稀释(2-11~20),共12个浓度,依次加入96孔板内的单层宿主细胞上(100 μL/孔),并加100TCID50的病毒(100 μL/孔),同时设病毒对照组、正常细胞对照组。于35 ℃、体积分数5% CO2中培养,待病毒对照组细胞病变效应(CPE)达90%时所有实验组终止培养。将96孔板里的细胞培养液拍出,加中性红染液(100 μL/孔),35 ℃、5% CO2培养1 h后倒出染液,小水流冲洗3~5次后甩干,加脱色液(100 μL/孔),37 ℃、5% CO2培养15 min,用酶标仪在540 nm处测定其吸光度值(OD值),结合Reed-Muench 公式[7]:细胞比距=(高于50% 病变率-50%)/(高于50% 病变率-低于50% 病变率)×100%,计算治疗指数(TI)值(TI=TC50/EC50),同时用电子显微镜观察。结果见表 1。
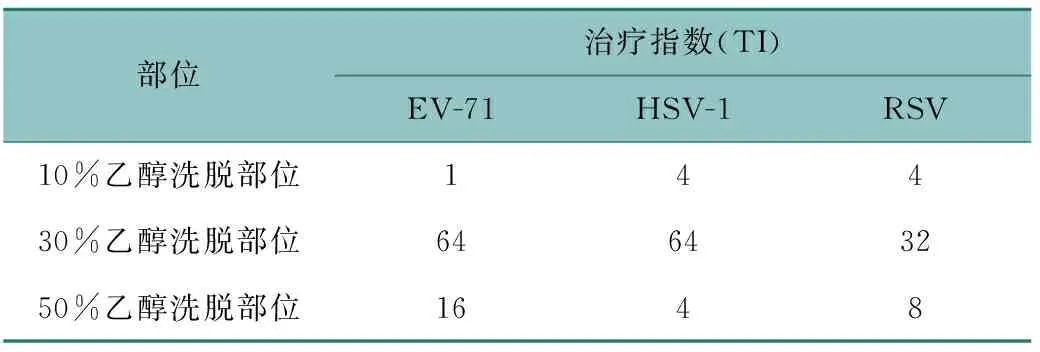
表1 败酱草各部位抗病毒筛选结果Table 1 Antiviral screening results of various parts of Patrinia Herb
2.3 抗病毒有效部位的LC-MS分析
2.3.1 测定条件
2.3.1.1 液相条件
色谱柱:Thermo Hypersil Gold C18柱(100 mm×2.1 mm,1.9 μm);流速:0.3 mL/min;柱温:45 ℃;进样温度:15 ℃;进样量5 μL;梯度洗脱,流动相A为水(含0.05%甲酸),流动相B为乙腈,梯度洗脱:0~10 min,5%~23% B;10~12 min,23%~45% B;12~25 min,45%~46% B;25~28 min,46%~100% B。
2.3.1.2 质谱条件
采用负离子模式检测;采集范围100~1000m/z;分辨率70 000 HESI;离子源;毛细管温度300 ℃,电压3500 V;源内温度350 ℃;鞘气45,辅气10;S-Lens RF Level:55。
2.3.2 样品溶液的制备
精密称取30%乙醇洗脱部位20 mg,置25 mL容量瓶中,以80%甲醇溶解后定容,而后以0.22 μm微孔滤膜过滤,得样品溶液。
2.3.3 LC-MS分析
按2.3.2项下方法制备样品溶液,在2.3.1项下LC-MS条件进样分析,得到总离子流图(图1),同时进行高分辨二级扫描,得到负离子模式下不同化合物的高分辨二级质谱信息(图2)。对图1提供的保留时间和图2提供的典型碎片离子峰进行分析,并通过与对照品对比鉴定,共鉴定出14个化合物(表2)。
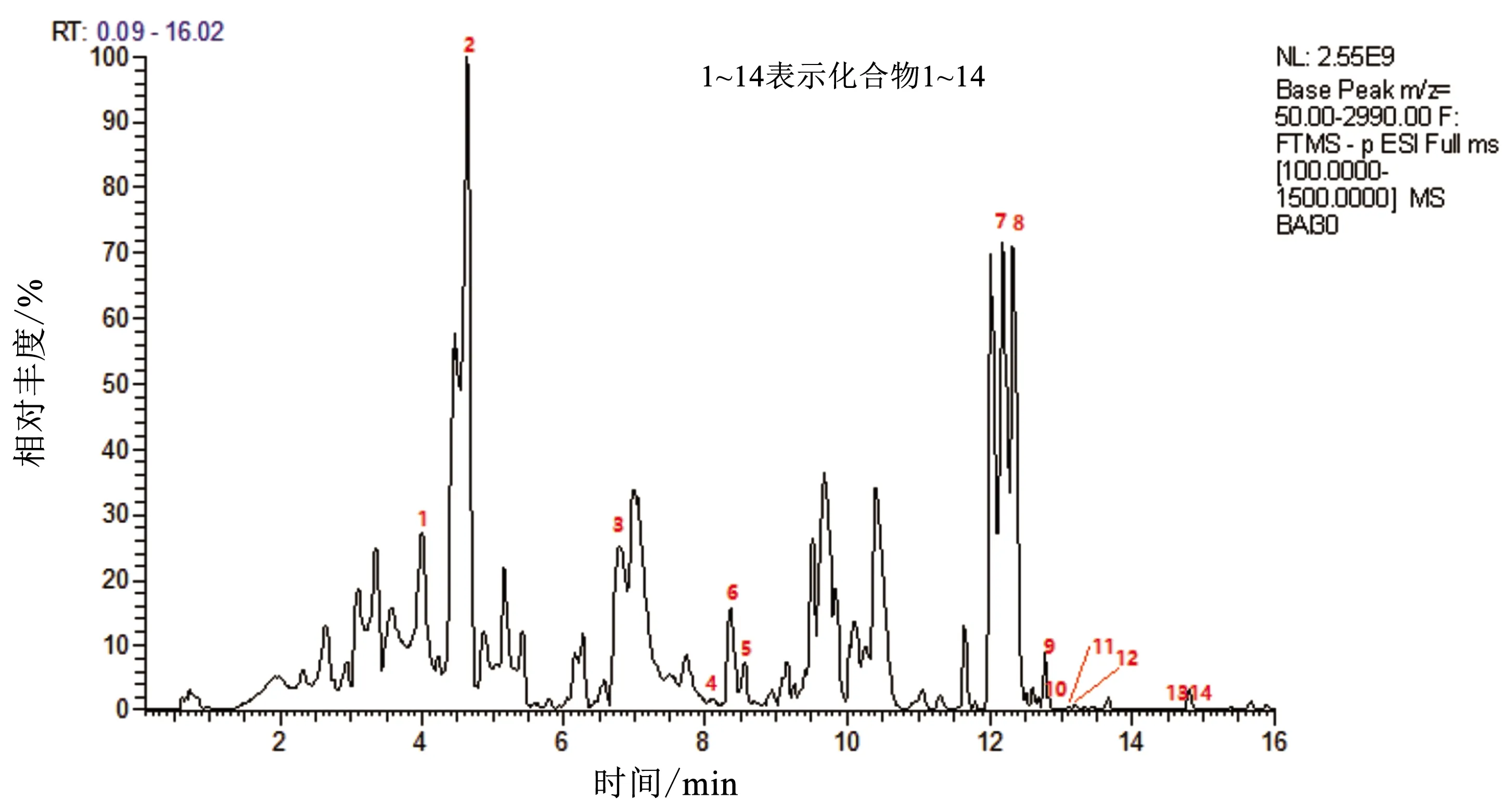
图1 败酱草总黄酮部位的总离子流图Fig.1 Total ion current diagram of total flavonoids in Patrinia Herb

表2 败酱草总黄酮30%乙醇洗脱部位中14种成分鉴别分析结果Table 2 Results of the identification and analysis of 14 components of total flavonoids eluted by 30% ethanol of Patrinia Herb
2.3.3.1 化合物1
tR=4.02 min,m/z353.087 86 [M-H]-,根据m/z191.055 08,152.038 74等绿原酸典型碎片离子峰,经与对照品对比鉴定为绿原酸(图2)。
2.3.3.2 化合物2
tR=4.65 min,m/z179.033 97 [M-H]-,根据m/z135.043 75,112.984 06等咖啡酸的典型碎片离子峰,经与对照品对比鉴定为咖啡酸(图2)。
2.3.3.3 化合物3
tR=6.81 min,m/z563.140 99 [M-H]-,在二级质谱图中发现m/z545.132 93,503.121 55,473.109 25,443.098 42,383.077 45,353.067 05等碎片离子峰,m/z563.140 99脱水得到m/z545.132 93,m/z563.140 99糖链裂解丢失C2H4O2得到m/z503.121 55,m/z563.140 99糖链裂解丢失C3H6O3得到m/z473.109 25,m/z563.140 99糖链裂解丢失C4H8O4得到m/z443.098 42,m/z563.140 99糖链裂解连续丢失C2H4O2和C4H8O4得到m/z 383.077 45,m/z563.140 99糖链裂解连续丢失C3H6O3和C4H8O4得到m/z353.067 05,因此推测为夏佛塔苷(图2)。
2.3.3.4 化合物4
tR=8.03 min,m/z609.146 30 [M-H]-,另外二级质谱图中存在300.035 52,179.033 81,151.038 83等碎片离子峰,m/z300.999 18为苷元离子峰,m/z179.033 81、151.038 83为苷元离子发生逆-狄尔斯-阿尔德反应得到,经与对照品对比鉴定为芦丁(图2)。
2.3.3.5 化合物5
tR=8.53 min,m/z447.093 48 [M-H]-,另外二级质谱图中存在327.050 84,285.040 50,133.028 11等碎片离子峰,[M-H]-峰发生糖链裂解失去C4H8O4得到m/z327.050 84,m/z285.040 50为苷元离子峰,苷元离子发生逆-狄尔斯-阿尔德反应得到m/z133.028 11,因此推测为木犀草素-6-C-葡萄糖苷(图2)。
2.3.3.6 化合物6
tR=8.42 min,m/z447.093 51 [M-H]-,另外二级质谱图中存在285.040 50,257.044 49等碎片离子峰,其中m/z285.040 50为苷元离子峰,而后失去一分子CO得到m/z257.044 49,经与对照品对比鉴定为木犀草苷(图2)。
2.3.3.7 化合物7
tR=12.18 min,m/z285.040 47 [M-H]-,另外二级质谱图中存在257.044 65,151.002 32,133.027 98,107.012 25等典型碎片离子峰,其中m/z257.044 65由苷元离子失去一个H和CO得到,m/z151.002 32,133.027 98,107.012 25为苷元发生逆-狄尔斯-阿尔德反应产生,因此推测为木犀草素(图2)。
2.3.3.8 化合物8
tR=12.25 min,m/z301.035 46 [M-H]-,另外二级质谱图中存在273.040 71,178.997 53,151.002 35,107.012 25等典型碎片离子峰,m/z273.040 71为[M-H]-峰失去CO得到,m/z178.997 53,151.002 35,107.012 25为苷元发生逆-狄尔斯-阿尔德反应产生,经与对照品对比鉴定为槲皮素(图2)。
2.3.3.9 化合物9
tR=12.83 min,m/z269.045 53 [M-H]-,二级质谱图中发现227.034 01,225.055 13,201.054 93,183.044 04,151.002 40,117.033 01,107.012 27等碎片离子峰,[M-H]-峰发生C环裂解生成m/z151.002 40,117.033 01,107.012 27,m/z227.034 01,225.055 13,201.054 93分别由[M-H]-峰失去一分子C2H2O,CO2以及C3O2得到,[M-H]-峰连续失去C2H2O和CO2得到m/z183.044 04,因此推测为芹菜素(图2)。
2.3.3.10 化合物10
tR=12.97 min,m/z285.040 68 [M-H]-,二级质谱图中发现267.160 37,255.160 31,227.128 27,211.133 36,133.012 91等碎片离子峰,[M-H]-峰发生C环裂解生成m/z133.012 91,m/z267.160 37,255.160 31分别由m/z285.040 68失去一分子H2O和OCH2得到,m/z255.160 31失去CO得到m/z227.128 27,m/z255.160 31失去CO2得到m/z211.133 36,经与对照品对比鉴定为山奈酚(图2)。
2.3.3.11 化合物11
tR=13.05 min,m/z315.050 93 [M-H]-,另外二级质谱图中存在300.027 50,283.025 27,271.024 78,255.029 74,227.034 38,216.042 53,164.010 21,151.002 40,148.015 29,107.012 23等碎片离子峰,[M-H]-峰失去一分子CH3得到m/z300.027 50,m/z300.027 50失去一分子COH得到m/z271.024 78,m/z300.02750失去一分子CO2H得到m/z255.029 74,m/z255.029 74失去一分子CO得到m/z227.034 38,m/z300.027 50发生C环裂解生成m/z164.010 21,151.002 40,148.015 29,107.012 23,因此推测为异鼠李素(图2)。
2.3.3.12 化合物12
tR=13.35 min,m/z255.102 49 [M-H]-,另外二级质谱图中存在135.043 72,118.997 07等碎片离子峰,为发生逆-狄尔斯-阿尔德反应产生的甘草素的典型碎片离子峰,因此推测为甘草素(图2)。
2.3.3.13 化合物13
tR=14.76 min,m/z299.056 12 [M-H]-,另外二级质谱图中存在284.032 65,256.031 45,227.034 23,151.002 41,107.012 28等碎片离子峰,[M-H]-峰失去一分子CH3得到m/z284.032 65,m/z284.032 65失去一分子CO得到m/z256.031 45,m/z256.031 45失去一分子COH得到m/z227.034 23,m/z284.032 65发生C环裂解生成m/z151.002 41,107.012 28,因此推测为香叶木素(图2)。
2.3.3.14 化合物14
tR=14.89 min,m/z299.056 15[M-H]-,另外二级质谱图中存在m/z599.107 06,这是[2M-H]-的信号峰,经与对照品对比鉴定为山奈素(图2)。

图2 化合物1~14的二级质谱图Fig.2 Secondary mass spectrum of compound 1~14
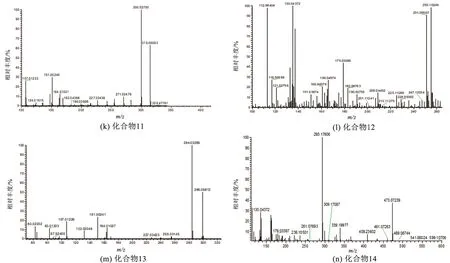
续图2
3 讨论
本研究选择了EV-71,HSV-1,RSV三种病毒株来检测败酱草总黄酮部位抗病毒活性。其中EV-71感染会导致手足口病、脑炎、脑膜炎、口腔炎、咽炎、出疹性疾病、肌病等,严重者可造成死亡,已经成为我国儿童常见的感染疾病,但目前尚无有效治疗EV71感染的药物上市[8];HSV-1感染能引起口腔及生殖器黏膜产生疱疹和溃疡,严重者可引发脑炎[9];RSV是婴幼儿、老年人和免疫功能低下者诱发下呼吸道感染的主要原因[10]。另外这三种病毒的发病症状均为温病症状,温病多为急性外感疾病,发病急,变化快,变证多,研究温病对病毒研究有十分重要的作用[11]。
本研究结果显示败酱草总黄酮30%乙醇洗脱部位对EV-71以及HSV-1病毒都具有显著的抑制作用,对其活性成分进行LC-MS定性分析鉴定出14个化合物,即为绿原酸、咖啡酸、夏佛塔苷、芦丁、木犀草素-6-C-葡萄糖苷、木犀草苷、木犀草素、槲皮素、芹菜素、山奈酚、异鼠李素、甘草素、香叶木素、山奈素,这些活性成分的进一步抗病毒活性评价有待后续研究。
