单切口腋静脉入路技术在完全植入式静脉输液港植入中的应用
2020-11-02孙飞虎王维涛王卫东
丁 伟,周 奇,孙飞虎,孙 磊,王维涛,徐 平,范 晨,王卫东
完全植入式静脉输液港(totally implantable venous access port,TIVAP)作为一种新型长期静脉通路装置,已广泛应用于输注化疗药物、全肠外营养、输血及采血等反复性治疗操作[1]。临床上通常采用经皮穿刺颈内静脉(internal jugular vein,IJV)、经皮穿刺锁骨下静脉(subclavian vein,SCV)、外科切开穿刺头静脉(cephalic vein,CV)等途径植入TIVAP,但各有优缺点[2]。 目前 IJV 入路应用最为广泛[3]。 传统IJV 入路双切口方式需要2 个皮肤切口并建立皮下隧道,存在皮下组织牵拉不适及美观问题。 近来有学者报道采用腋静脉(axillary vein,AV)入路单切口技术植入TIVAP 的成功经验,无需建立皮下隧道,弥补了传统方式诸多不足[4]。南京医科大学附属无锡人民医院自2018 年起采用单切口技术AV 入路植入TIVAP,现将临床应用结果报道如下。
1 材料与方法
1.1 一般资料
回顾性分析2018 年1 月至6 月南京医科大学附属无锡人民医院采用单切口AV 入路技术植入TIVAP 的179 例患者临床资料。其中男90 例,女89例;年龄 23~77 岁,平均(46.8±12.5)岁。 原发疾病均为恶性肿瘤,包括肺癌(53 例)、乳腺癌(39 例)、结直肠癌(31 例)、胃癌(15 例)、食管癌(8 例)、卵巢癌(7 例)、胰腺癌(5 例)、血液系统肿瘤(8 例)和其他肿瘤(13 例)。植入TIVAP 目的为全身化疗或肠外营养支持治疗。 所有患者术前均签署知情同意书。
1.2 手术方法
DSA 透视下解剖定位并规划囊袋位置和穿刺路径,以过第1 肋中点平行于3、4 后肋方向作一直线(记为L),以第1、2 肋外侧缘并垂直于 L 各作一直线(分别记为 W1、W2),按照长约 2 cm 横行切口将囊袋布置于第2 前肋外侧缘,沿3、4 后肋方向布置进针路线,穿刺入路走行于第1 肋间隙AV(图1)。手术在局部麻醉下进行,患者仰卧位,常规消毒铺巾,1%利多卡因麻醉切口皮肤、 港体囊袋及穿刺通道,按计划作长约2 cm 横行切口,制作囊袋,大小以恰好可埋入6.5 F Celsite®Standard TIVAP(德国B.Braun 公司)港体为宜;切口下方与水平面成15°~45°角(消瘦者为 15°~30°,肥胖者为 30°~45°)负压抽吸进针,成功抽到回血后送入导丝,透视下证实导丝位置,交换入可撕脱鞘,经鞘送入导管;去除可撕脱鞘,透视下调整导管头端位置于上腔静脉与右心房交界处[5],剪去多余导管并与港体连接;在港体上插入无损伤针,用肝素水作抽吸测试,保证通畅且无渗漏;将港体埋入囊袋内,常规缝合切口,无菌辅料覆盖包扎。最后留存影像资料(图2)。对于乳腺癌或既往经外周穿刺中心静脉置管(peripherally inserted central catheter,PICC)患者,采用对侧胸壁植入TIVAP。 若影像解剖定位下穿刺AV 困难(穿刺次数达3 次)或误穿刺腋动脉,立即采用超声导引下穿刺AV;若超声提示AV 狭窄或闭塞,即改为同侧IJV 入路植入TIVAP。
1.3 观察指标
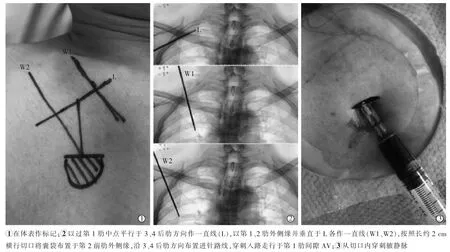
图1 DSA 透视下解剖定位规划囊袋位置及穿刺路径

图2 单切口AV 入路植入TIVAP 影像
观察记录手术相关信息,如技术成功率、入路血管、透视时间、操作时间及术中操作相关问题(误穿刺动脉、导丝误入非目标静脉、可撕脱鞘弯折、导管-港体连接处扭结等)。 入路血管以透视下针尖位置定义:锁骨外侧缘以外为AV,以内为SCV。 手术操作时间定义:影像解剖定位开始至缝合皮肤切口所需时间。 早期并发症(TIVAP 植入 30 d 以内):气胸、血胸、心律失常、局部血肿、伤口裂开等;晚期并发症:导管相关血流感染、囊袋局部感染、纤维蛋白鞘形成、静脉血栓形成、导管功能障碍、导管断裂/移位、夹闭综合征等。 随访截止日期为2019 年3 月31 日。
2 结果
179 例患者中177 例通过单切口AV 入路技术成功地植入TIVAP,其中105 例1 次穿刺成功,47例 2 次穿刺成功,9 例 3 次穿刺成功,16 例超声导引下穿刺成功,2 例术中超声提示AV 狭窄改为同侧IJV 入路完成手术,技术成功率为98.9%(177/179)。 经右胸壁植入 124 例(AV 113 例,SCV 9 例,IJV 2 例),经左胸壁植入 55 例(AV 51 例,SCV 4 例)。透视时间 0.3~1.5 min,平均(0.8±0.2) min。 手术操作时间 17~45 min,平均(21.5±10.3) min。 术中操作相关问题发生率为8.9%(16/179),其中误穿刺腋动脉6 例,导丝误入同侧IJV 5 例,可撕脱鞘折弯3例,导管-港体连接处扭曲2 例。
TIVAP 留置相关并发症发生率为3.4%(6/179),其中术后早期发生局部血肿形成1 例,术侧AV 血栓形成1 例,未见血胸、伤口裂开等并发症;晚期发生左头臂静脉血栓狭窄-闭塞伴左IJV-SCV 近心端血栓形成1 例,囊袋局部感染2 例,纤维蛋白鞘形成1 例,未见导管相关血流感染、导管断裂/移位、夹闭综合征、药物外渗等严重并发症。
TIVAP 留 置 时 间 252 ~442 d,平 均 (362.5±65.2) d。1 例患者因左头臂静脉狭窄-闭塞伴左IJVSCV 近心端血栓形成,2 例因囊袋局部感染,提前取出港体;15 例因化疗结束等原因取出港体;20 例随访期间原发疾病进展死亡;141 例港体目前仍留置并正常使用。
3 讨论
Niederhuber 等[6]1982 年 首 次报道 TIVAP 并 广泛应用以来,目前有多种方式植入TIVAP,常用入路包括经皮穿刺IJV 或SCV、 外科切开穿刺中心静脉等[2]。 现有循证医学证据表明,IJV 入路更为常用且较为理想,因其在解剖学上管径较大、位置表浅、走行较直,使得穿刺成功率高,并发症发生率低[3]。然而,传统IJV 入路双切口方式需要2 个皮肤切口及建立皮下隧道,存在皮下组织牵拉不适和颈部切口美观问题。 近年有研究报道采用单切口AV 入路置入TIVAP,先在囊袋部位作一皮肤切口,再从切口内穿刺 AV,技术成功率达 100%[3-4]。 该技术无需建皮下隧道,可缩短操作时间,降低主观不适,改善美观问题,同时避免夹闭综合征。 本组患者技术成功率为 98.9%(177/179),与既往文献报道相仿[3-4,7],其余2 例超声提示AV 狭窄,可能与误穿刺腋动脉后出血的局部占位、AV 损伤后局部血栓形成有关,术中转为同侧 IJV 入路完成手术。Garcia-Rinaldi 等[8]1978 年首次报道采用AV 入路植入心脏起搏器以来,同样有单切口内穿刺AV 植入心脏植入式电子装置(cardiac implantable electronic device,CIED)的报道,技术成功率为 94%~99.3%[9-10]。
越来越多研究支持 AV 入路植入 TIVAP[3-4,7]和CIED[10-12],同时聚焦于 AV 影像解剖学研究[13-14],以期最大程度降低气胸、血胸及乳糜胸风险[15]。 根据Gray 解剖学定义,AV 在第1 肋外侧缘以外续于SCV,然而并不适用于评估锁骨下特有的夹闭综合征,因此上述两大技术领域适合采用Jiang 等[16]提出的“AV 在锁骨外侧缘以外续于SCV”的定义(其中第1 肋外侧缘以内部分,可称为SCV-AV 移行段)。文献报道AV 穿刺成功率差异主要取决于体表标志、影像解剖、超声导引等定位方法[10]。 本组患者DSA 影像解剖定位下穿刺成功率为 89.9%(161/179),较低于既往文献报道(95%~98.1)[10],可能与早期学习曲线及本研究严格的操作规范有关。
理想的AV 入路段应符合以下解剖学特点:血管表浅,管径粗大,动静脉间距大,远离胸腔和臂丛神经,避免损伤静脉瓣等。早期有学者通过AV 超声解剖学研究发现,自第1 肋外侧缘往外,动静脉血管平均深度分别为1.9 cm 和3.1 cm,管腔平均直径分别为1.2 cm 和0.9 cm,动静脉平均间距分别为0.3 cm 和0.8 cm,血管胸腔平均间距分别为1.0 cm和 2.0 cm[15]。 近期 Vurgun 等[13]通过静脉造影研究AV 部位、 形态学特征及动静脉关系,发现90.7%SCV-AV 移行段位于锁骨下方第1 肋区,但22%患者在该区域存在静脉瓣。 然而 Sert 等[14]在冠状动脉造影术中同时对腋动静脉作造影,发现仅有60%患者AV 走行于通常所认为的肋锁交叉处,且此处腋动静脉交叉重叠率达24%。 因而认为,将SCV-AV移行段作为目标血管存在误穿动脉、损伤静脉瓣风险。综合判断提示,将走行于第1 肋间隙的AV 作为穿刺入路段最为合适。 本研究中大部分患者经穿刺此段AV 获成功,其中右侧占 82.1%(92/112),左侧占84.3%(43/51)。 术中操作相关问题发生率为8.9%(16/179),包括误穿刺腋动脉、 导丝误入同侧IJV、可撕脱鞘折弯、导管-港体连接处扭曲。 尽管发生率不低,但予相应处理后均得到纠正,并未增加操作难度及早期并发症。
关于TIVAP 留置相关并发症,本组患者均发生于术后1 年内,发生率为3.4%,与近年文献报道(1.4%~6.8%)一致[3-4,17]。 1 例女性患者术中锁骨下方局部明显血肿形成,考虑与腋动脉或其分支动脉损伤有关。 有研究表明多达77%患者腋动脉发出多个分支动脉跨越AV 走行区域上方,尤其是女性和体重指数(BMI)>25 患者[14]。 1 例患者术后 2 周发现左AV 血栓形成,经积极抗凝治疗后好转,考虑与胃癌伴远处转移、高凝状态有关。 有大样本调查研究发现多个与TIVAP 术后上肢深静脉血栓相关的独立危险因素,并建议针对这些高风险患者给予预防性抗凝治疗[18-19]。1 例右侧乳腺癌患者左 AV 入路术后5 个月因左颈部肿胀发现左头臂静脉血栓性狭窄/闭塞,考虑与后方解剖结构中主动脉弓比较靠前有关,术中造影提示侧支循环建立,未进一步开通闭塞静脉,提前取出装置并予抗凝治疗后好转。有研究报道,乳腺癌患者中左侧TIVAP 头臂静脉狭窄率明显高于右侧(13.7% 对1.1%),并发现胸骨与左头臂静脉间距是左头臂静脉狭窄的独立相关因素[20];后续研究进一步分析左头臂静脉狭窄/闭塞发生原因,发现解剖因素占85.4%,分为前方和后方解剖结构[21]。2 例囊袋局部感染患者中1 例局部脓肿形成,另1 例起初皮肤红肿热痛,6 个月后局部脓肿形成,均予提前取出装置并清创缝合。1 例患者纤维蛋白鞘形成,无法回抽血,予尿激酶封管2 次后好转。
本研究局限性:回顾性研究存在数据不全等固有缺陷;随访时间短,晚期并发症发生率可能低估;均先以DSA 影像解剖定位行AV 穿刺,有难度时再以超声辅助穿刺。 目前本中心已全部采用超声导引下穿刺,以最大程度提高穿刺成功率和安全性。
总之,单切口AV 入路技术植入TIVAP,技术成功率高,安全可行,手术时间短,并发症发生率低,可为TIVAP 植入方式提供另一种选择,值得临床进一步推广应用。
