Caspase-9、 XIAP与非小细胞肺癌的相关性
2020-11-02李云飞刘代顺刘振峰
李云飞 刘代顺 刘振峰
(1遵义市第一人民医院呼吸科,贵州 遵义 563000;2遵义医科大学第三附属医院)
凋亡逃逸在恶性肿瘤形成中起关键作用,其中XIAP属于凋亡抑制蛋白(AP)家族中的成员,被认为是家族凋亡抑制作用最强的蛋白之一。XIAP可有效抑制天冬氨酸特异性半胱氨酸蛋白酶(Caspase),包括Caspase-9和Caspase-3等,从而起到抑制肿瘤凋亡作用〔1〕。非小细胞肺癌(NSCLC)与XIAP和Caspase-9基因的关联性报道较少,本文使用免疫组化和转染技术分析两种基因在NSCLC中的表达情况,并观察正常组织中与NSCLC患者组织中两种基因的表达差异进行分析,研究XIAP和Caspase-9基因与NSCLC发展和发生的相关性。
1 资料与方法
1.1一般资料 选取2012年5月至2014年5月于遵义市第一人民医院行NSCLC手术切除患者标本56例,其中鳞癌12例、支气管肺泡癌23例及腺癌21例,上述患者均经病理确证;选取同期24例经手术切除距病灶>5 cm处肺组织者作为对照,组织取出后放入液氮进行冷冻,并放于-80℃冰箱中保存;24例对照患者男15例,女9例,年龄34~73岁,平均年龄(42.3±8.9)岁,上述纳入者术前均未行NSCLC相关治疗;患者或家属均已签署知情同意书。
1.2主要试剂 兔来源XIAP多克隆抗体购于美国thermo 公司(编号:PA126426);兔来源的多克隆抗体Caspase-9购于美国abcam公司(编号:Ab137392);羊抗兔IgG抗体-辣根过氧化物酶(HRP)多聚体的二抗购于中国碧云天;免疫组化检测试剂盒EnVisionTM Two-Step购于丹麦DAKO公司(批号:1701777A)。病毒DNA抽提试剂盒购于Invitrogen公司(批号:1681569A)。
1.3免疫组化 根据免疫组化试剂盒步骤进行组织石蜡切片,二甲苯脱蜡10 min×2次,无水乙醇3 min×2次、95%乙醇2 min×2次、70%和80%乙醇分化2 min,经自然水化后行蒸馏水洗。抗原修复使用pH6.0高温高压抗原修复;时间是在冒气后计时100 s,然后流水冲洗至室温,蒸馏水洗后行磷酸盐缓冲液(PBS)冲洗5 min×3次,内源性过氧化物经3%过氧化氢(H2O2)水溶液阻断10 min后给予PBS冲洗5 min×3次,滴加一抗,放于37℃下进行孵育60 min。对照使用PBS替代一抗并行PBS冲洗5 min×3次,滴加山羊抗兔IgG抗体-HRP多聚体二抗,放于37℃下进行孵育40 min,PBS冲洗5 min×3次,经二胺基联苯胺(DAB)显色1 min,并放于显微镜下观察反应状态,使用纯净水冲洗终止反应;Harris苏木素液对细胞进行复染1 min,并使用100%和95%的乙醇进行脱水,二甲苯透明,中性树胶封片。免疫组织化学阳性为黄色或黄棕色,细胞核衬染呈蓝色。Caspase-9和XIAP表达情况:两种基因均存在于肿瘤细胞核内或胞质中,Caspase-9坏死凋亡区阳性降低,而XIAP基因则表现为阳性增加;阳性判断:上述两种基因均使用图像分析系统进行测量,于显微镜下选取病死灶周边区域3~5个染色阳性并拍照记录,并应用积分光密度(IOD)测量阳性细胞的强弱。将纳入的鳞癌、腺癌和支气管肺泡患者切除的组织和正常组织通过上述试验方法检测Caspase-9的表达。
1.4构建慢病毒质粒 传代293T细胞:每个T75瓶加2 ml明胶,24孔板每个孔加3滴明胶,于37℃培养箱放置15 min以上。
将培养的细胞放入培养基中进行抽吸,吸净后加入0.25%乙二胺四乙酸(EDTA)液2 ml,均匀覆盖瓶底后放于37℃下保温箱中培养2 min后取出,加入3 ml 37℃水浴中预热的完全培养基终止,吹打6~8次。将瓶中细胞吸出并放于15 ml离心管中,同时取50 μl细胞液放于EP管中,并加入450 μl培养基进行10倍稀释。铺细胞。细胞数量为1 000万/T75瓶,350万/T25瓶,24孔板则30万/孔,最后加新鲜培养液至总体积为10 ml/T75瓶; 4 ml/T25瓶;0.5 ml/24孔板每孔。第2天转染前观察细胞密度,若细胞密度汇合>80%则可继续转染;预备37℃水将I减血清培养基(Opti-MEM)放入预热,脂类(Fugene)转染剂需再正常室温下才可有效。将预热后的Opti-MEM加入微量离心管中,并依次加入质粒,吹打5~6次后加入Fugen转染剂。Fugene转染试剂需加至Opti-MEM液面之下,立即充分混匀,瞬时离心后室温放置18 min,即可加入培养瓶中,晃匀后放入培养箱中培养,间隔2~4 h晃匀一次。转染后12~24 h(次日),观察荧光情况并更换培养基;T25和T75瓶中分别装入4 ml和12 ml;换液时间为48 h后,换液后T25和T75瓶中液分别为3 ml和8 ml;24孔板中每孔为0.5 ml。收集转染后48 h和72 h病毒,并进行离心5 min取出细胞碎片,放于4℃保温箱中保存(保存时间不超过1 w)。24孔板滴度使用悬浮转染进行测定,先用明胶包被24孔板15 min(每孔200 μl); 消化293T,24孔板每孔铺15万细胞。可将细胞混匀,体积扩大15万细胞/500 μl,加入1 000×的聚凝胺(终浓度10 μg/ml)混匀,每孔加入500 μl即可;设两个感染梯度,分别取2 μl和5 μl病毒液加入24孔板的一孔中,摇匀后放入培养箱,48 h后即可观察其荧光,计算滴度。48 h后15万细胞可达到完全汇合状态,同时计算病毒滴度。加入4%多聚甲醛(PFA)固定30 min,24孔板每孔200 μl; 用0.1%聚对苯二甲酸丁二醇酯(PBT)洗2次,每次5 min; 用PBS将4,6二脒基-2-苯吲哚盐酸(DAPI)稀释1 000倍,每孔加入200 μl,避光室温静置5 min。在荧光显微镜下计数。病毒滴度(IU/ml)=荧光细胞数占总细胞数的百分比÷加入的病毒上清体积(μl)×1.5×105×103。超速离心27 000 r/min,90 min,4℃。用PBS重新溶解病毒颗粒(需在4℃放置超过24 h才能溶解)。病毒浓缩: 收集48 h上清,4 ml/T25瓶,放置4度,收集72 h上清,4 ml/T25瓶。4 000 r/min,4℃离心5 min,去碎片。加入5×的病毒浓缩液,混匀,4℃放置>12 h。4℃离心,1 500g,30 min,上清再次离心,1 500 r/min,5 min。分别加200 μl慢病毒溶解液(MEM)溶解。将纳入的鳞癌、腺癌和支气管肺泡患者切除的组织和正常组织通过上述试验方法检测XIAP的表达。
1.5病毒转染293T细胞后显微镜下观察XIAP、Caspase-9染色 建立稳转XIAP、Caspase-9基因的肺癌细胞株 用293T细胞包装出EFRT慢病毒(LV-EFRT),浓缩后感染NCI-H460肺癌细胞株,用玻璃微管挑出有红荧光的克隆,克隆经单细胞传代,长出的克隆再次用玻璃微管挑出有红荧光的克隆进行纯化,纯化的细胞扩增得到稳定转染的细胞株。
1.6统计学方法 应用SPSS19.0软件进行t检验。
2 结 果
2.1XIAP基因在正常组织和NSCLC组织中的表达 NSCLC组织中XIPA表达明显高于正常组织,显示XIAP在胞质中呈黄棕色或黄色,蓝色为细胞核;NSCLC组织中的XIAP表达明显高于正常组织(P<0.05),且上述3种NSCLC切除组织中的XIAP基因表达情况均高于正常组织。见表1,图1。
2.2正常肺组织和NSCLC组织中Caspase-9的表达 正常肺组织中的Caspase-9的表达明显高于NSCLC组织,且此基因主要表达为细胞核和胞质中,呈黄棕色和黄色等;正常肺组织中Caspase-9表达显著高于NSCLC组织(P<0.05),且上述3种正常肺组织中的Caspase-9基因表达情况均高于NSCLC组织。见表1、图2。

表1 各组XIAP、Caspase-9表达比较
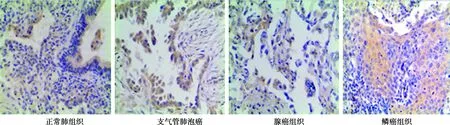
图1 正常肺组织XIAP表达低于NSCLC组织(×200)
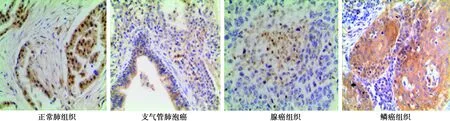
图2 正常肺组织中的Caspase-9表达明显高于NSCLC组织(×200)
2.3病毒转染293T细胞后显微镜下观察XIAP、Caspase-9染色 病毒转染293T细胞后显微镜下观察,用BamHI和SalI对质粒XIAP进行双酶切,回收片段中红色荧光代表转染成功。用BamHI和SalI对质粒Caspase-9进行双酶切,回收片段2,红色荧光代表转染成功。见图3。
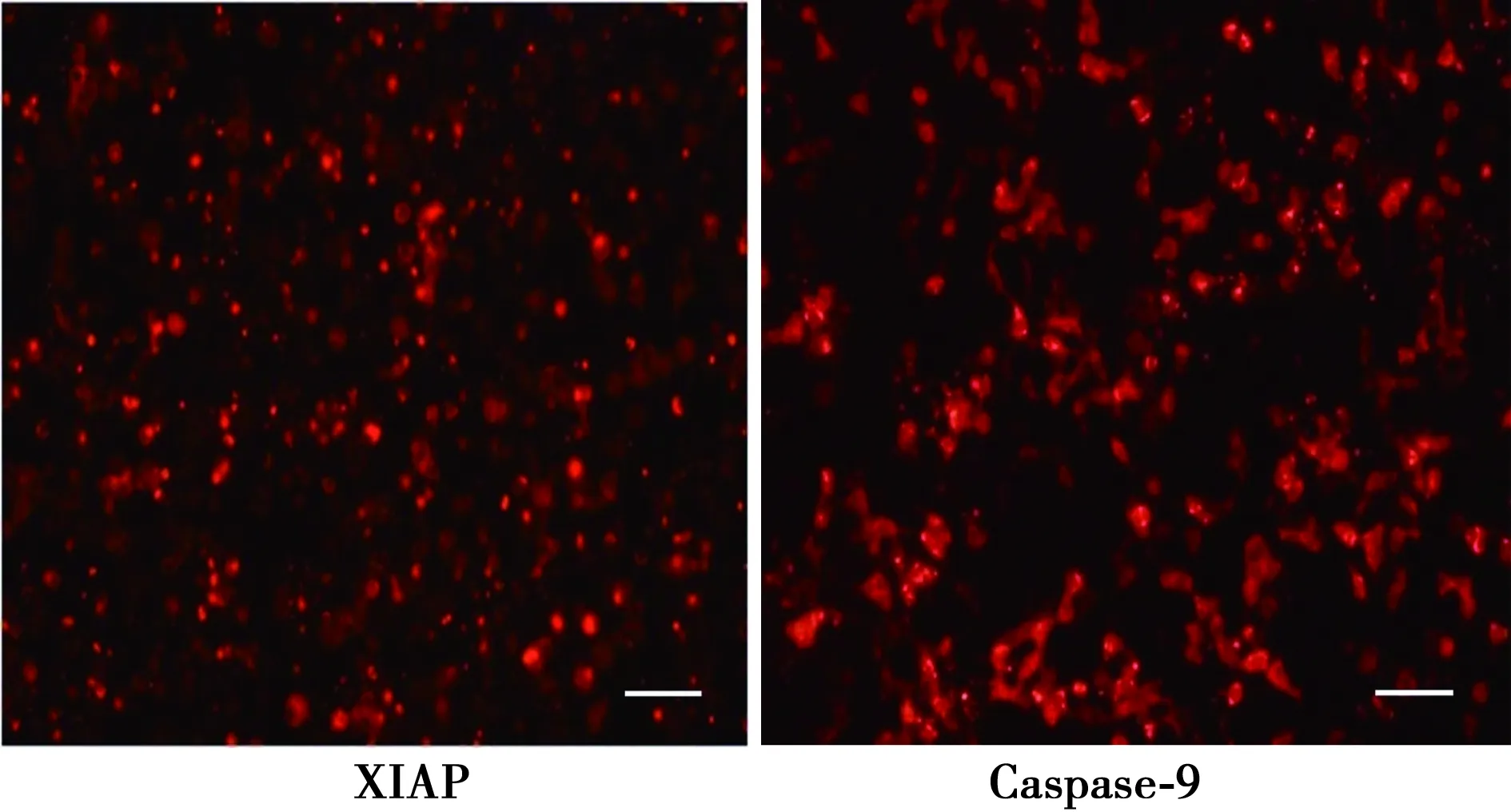
图3 病毒转染293T细胞后显微镜下观察XIAP、Caspase-9染色(×100)
3 讨 论
肺癌是如今在临床上常见的具有较高死亡率的恶性肿瘤疾病之一,而该类肿瘤患者中大约80%以上均属于NSCLC〔2,3〕。大量临床经验及研究表明,当NSCLC处于晚期阶段时其治愈的概率较小,而处于Ⅰ期的NSCLC通过彻底的手术根除治疗后生存时间超过5年的患者比例可达到60%~80%。因此对NSCLC的及早正确诊断是保证其治疗及预后效果的主要因素之一。肺癌发病率每年呈显著性升高,且我国肺癌人群5年生存率仅为19.7%。影像学在临床中诊断肺癌占据重要地位,但影像学诊断在发现病变和定性中存在局限性。据不完全统计〔4〕,全国近50年以来肺癌患者已逐渐超过胃癌与肝癌,肺癌已成为现今病发病死高峰时代,也逐渐变成肿瘤当中第一位。据相关数据〔5〕显示,恶性肿瘤男性发病率及死亡率超过女性发病率及死亡率。临床数据〔6,7〕显示,肺癌中,NSCLC占85%,患者生存率5年内仅为15%。小细胞肺癌患者2年内仅为1%的生存率。相关〔8〕显示,部分患者经医院确诊后肿瘤标志物已经开始逐渐转移及肿瘤局部晚期(Ⅲb/Ⅳ期),晚期患者与远处转移患者已失去最佳手术治疗时间。临床肺癌患者症状不明显及影像检查呈现阴性时,患者血清肿瘤标志物会逐渐升高,当肿瘤标志物升高时检测,将提高肺癌诊断率。有研究〔9〕发现XIPA基因表达与急性白血病患者的死亡存在明显关联,且证实XIAP基因表达水平高者存活率明显低于XIAP水平低者。肿瘤患者在化疗或治疗过程中XIAP均表现为不同程度升高。NSCLC中使用低剂量照射可造成XIAP表达升高,并可诱发放射凋亡抵抗。相关研究〔10〕用XIAP腺病毒感染卵巢上皮性细胞癌,证明XIAP在卵巢上皮性癌系中具有抑制细胞凋亡的作用。本实验发现正常肺组织中XIAP表达明显低于NSCLC组织,与具体那种类型NSCLC无关,可能与疾病早期诊断、治疗及预后的关系存在一定的关系。Caspase属于半胱氨酸天冬氨酸特异性蛋白酶家族的成员。有研究〔11〕发现Caspase参与了多种疾病的发生和发展,且在自身免疫性疾病和肿瘤中表现尤为显著。Caspase-9基因定位于1p36.3~p36.1,编码的蛋白产物分子量约为46 000 D,广泛表达于人类的正常组织,如神经组织、肌肉组织、肝脏、脾脏和肺等〔12〕,目前在肺癌国内较少研究其蛋白水平的表达研究〔13〕。本实验发现NSCLC组织中的Caspase-9蛋白表达较正常肺组织的明显下调与转染结果一致,提示凋亡基因Caspase-9蛋白减低与NSCLC的发生相关,证明了在NSCLC患者中XIAP在凋亡通路中通过抑制其核心蛋白Caspase的作用。有学者〔14〕提出Caspase-9可能与疾病早期诊断、治疗及预后存在一定的关系。而是否同时检测2种蛋白会增加特异性及敏感性仍需进一步研究。
综上所述,XIAP和Caspase-9与NSCLC的发生、发展密切相关;XIAP和Caspase-9在NSCLC组织之间有统计学意义,预示着可能与和NSCLC的早期诊断与预后可能有关,可能为NSCLC治疗提供新的治疗靶点。
