抗富亮氨酸胶质瘤失活1蛋白抗体脑炎7例临床特点分析
2020-11-02赵静韩柏林杨静
赵静,韩柏林,杨静
自身免疫性脑炎(autoimmune encephalitis,AE)是由自身免疫机制介导的中枢神经系统抗原抗体反应,是以产生针对神经元抗原的特异性自身抗体为特征、以认知功能下降、精神障碍和癫痫发作等症状为主的一类异质性疾病总称[1]。抗神经元表面抗原抗体相关的AE 包括自身免疫性边缘性脑炎、抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)脑炎及其他自身免疫性脑炎综合征[2,3]。近年来,电压门控钾离子通道复合物(voltage-gated potassium channel,VGKC)抗体脑炎逐渐被认识,与致病性VGKC 抗体结合的相关蛋白为富亮氨酸胶质瘤失活1 蛋白(leucine-rich glioma inactivated 1,LGI1)和接触蛋白相关蛋白(contactin-associated protein 2,Caspr2)[4,5]这2 个亚型,其中LGI1 抗体脑炎更为多见[6]。国内于2013 年首次报道,主要表现为边缘性脑炎,临床常见特征为精神异常、认知障碍和癫痫发作,部分伴有低钠血症,大多不伴肿瘤,对免疫治疗反应良好[7,8]。LGI1抗体脑炎在国内仍属少见病,且部分患者表现不典型,诊断困难,易造成误诊、漏诊从而延误诊治。本研究回顾性分析7 例LGI1 抗体脑炎患者的临床、辅助检查特征、治疗及预后,帮助临床医生提高对该病的认识。
1 资料与方法
1.1 一般资料
收集2016 年8 月至2018 年12 月我院神经科收治的LGI1 抗体脑炎患者7 例的相关临床资料。LGI1 抗体脑炎符合《中国自身免疫性脑炎诊治专家共识》的AE诊断标准[1],且血清和(或)脑脊液中的LGI1抗体阳性。
1.2 方法
对7 例患者的临床资料进行回顾性分析,包括一般情况、临床症状、实验室检查、影像学资料、脑电图、治疗及预后。
2 结果
2.1 一般情况
7 例患者中男5 例,女2 例;年龄61~75 岁,平均68 岁;均为急性或亚急性起病。病前均无感染及免疫等相关病史,既往无特殊病史。
2.2 临床表现
首发症状:精神行为异常4例;记忆力减退、认知功能下降1例;双上肢抖动的癫痫发作1例;面臂肌张力障碍样发作(faciobrachial dystonic seizures,FBDS)1 例。神经精神症状:近事记忆及智能下降6例,精神行为异常6例,伴有幻觉2例,饮食过度1例,FBDS 4例,睡眠障碍5例,均为睡眠增多,癫痫发作3例。见表1。
2.3 脑脊液及血清检查结果
7 例患者均行脑脊液(cerebrospinal fluid,CSF)检查,CSF 细胞数正常(正常值<5×106/L)6 例,白细胞略升高(8×106/L)1 例;CSF 蛋白正常(正常值0.15~0.45 g/L)4例,略升高(0.51~0.6 g/L)2例。7例患者血清抗LGI1 抗体均为阳性,血清及CSF 抗LGI1 抗体双阳性者5 例。其他抗体检测如结缔组织病相关抗体(抗核抗体、抗心磷脂抗体、抗中性粒细胞胞质抗体)、其他类型的神经元表面抗原抗体[NMDAR 抗体、CASPR2 抗体、α-氨基-3-羟基-5-甲基-4-异噁唑丙酸受体(AMPARs)抗体、γ-氨基丁酸受体(GABABR)抗体]、副肿瘤相关抗体(Hu、Yo、Ri、CV2、Ma2、Amphiphsin)等均为阴性。出现低钠血症(血钠<135 mmol/L)4例。
2.4 影像学检查结果
7 例患者行头颅MRI 检查,发现异常3 例,病灶主要累及颞叶、海马,底节区等部位,累及右侧颞叶、海马及底节区1 例,见图1A;双侧侧脑室前角病灶1 例,见图1B;双侧海马异常信号1 例,见图1C。其余病例头颅MRI未见明显异常。治疗后复查影像见图2。

图1 3例患者头部MRI影像(治疗前)
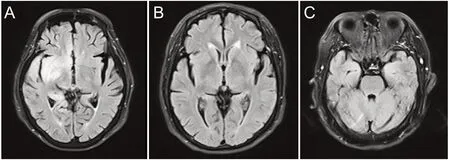
图2 3例患者头部MRI影像(治疗后)
2.5 脑电图检查结果
脑电图异常5例,单侧或双侧额颞部多见,多为弥漫性慢波,部分伴有尖波、尖慢波等痫样放电。
2.6 肿瘤筛查
所有病例均行血清肿瘤标记物筛查、胸腹部CT或超声筛查肿瘤,未发现明显异常。
2.7 治疗及预后
患者从出现症状至确诊时间为20~360 d,中位数时间45 d;所有患者均采用免疫治疗及对症治疗。免疫治疗包括激素、静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)及硫唑嘌呤;激素为甲基强的松龙500~1000 mg/d,静脉应用3 d 后改为口服泼尼松1 mg/kg·d,每周递减5 mg。IVIG为0.4 mg/kg·d,3~5 d为1 疗程。4 例予以激素+IVIG 治疗,其中1 例复发加用硫唑嘌呤。2 例加用卡马西平抗癫痫治疗。2 例加用喹硫平或奥氮平控制精神症状。4例低钠血症者予以口服补钠治疗。7例患者出院后随访,1例复发。其余6例预后良好,见表2。

表1 7例LGI 1抗体脑炎患者临床特征
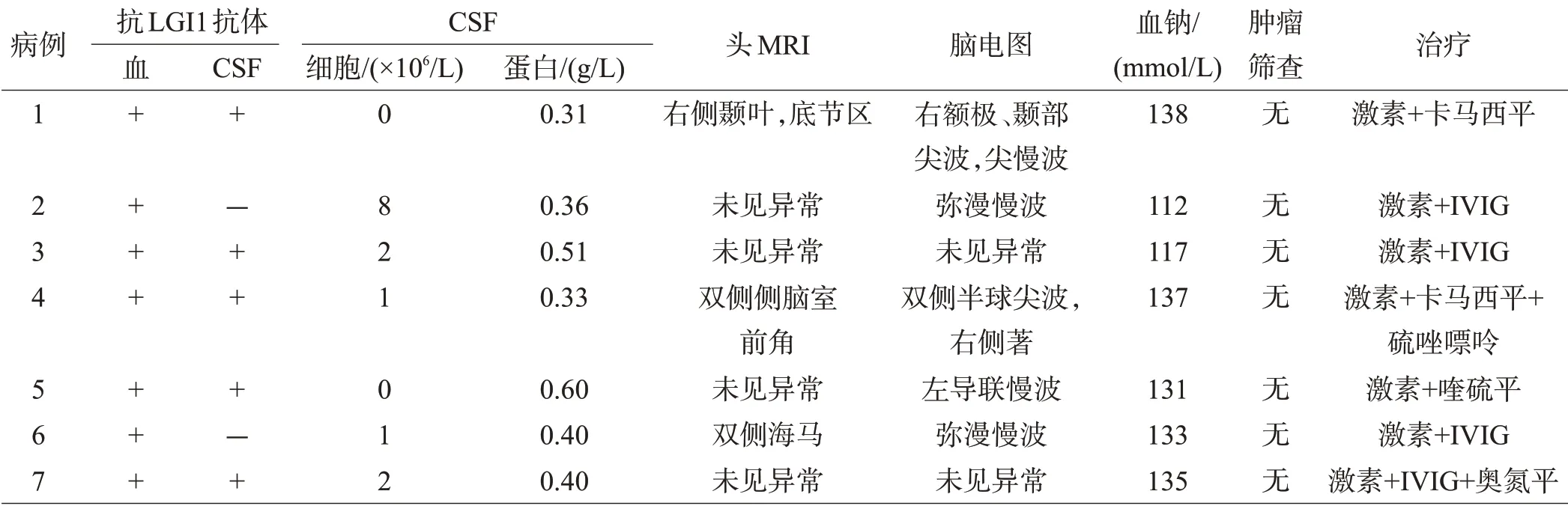
表2 7例LGI 1抗体脑炎患者部分临床资料
3 讨论
LGI1蛋白于2010年首次被报道,主要在海马和颞叶皮质表达,是VGKC 的一部分,LGI1 抗体脑炎被归类为抗神经元表面抗原或抗突触蛋白相关的自身免疫性脑炎[6],是继抗NMDAR脑炎外第2常见的AE,且是边缘性脑炎最常见的原因[9,10]。
研究报道LGI1抗体脑炎好发于中老年人,中位年龄62岁,男性多见,男女比例约2∶1,起病到确诊的中位时间为168 d[11],国内报道平均55.9~65.5 d[12,13]。本组患者平均68 岁,男女比例为2.5∶1,起病到确诊的中位时间为45 d(20~360 d)。本组确诊间隔时间缩短,可能与国内越来越多的临床医生关注LGI1抗体脑炎、对该病的认识增加有关。
LGI1抗体脑炎临床上呈急性或亚急性起病,主要表现为短暂记忆障碍、FBDS、癫痫发作、精神障碍为主要症状的边缘性脑炎综合征。常以癫痫发作或认知障碍为首发症状,也可以表现为精神异常、性格改变[14]。本组研究与上述报道一致,仅1 例以FBDS 为首发症状,表现为反复频繁的右侧面部及上肢抽动,每天发作超过100 次,予以免疫治疗后有所缓解。FBDS 是LGI1 抗体脑炎的特征性表现,26%~71%的患者可出现,常早于其他临床症状。表现为一侧面部、上肢及肩部,也可伴随下肢短暂(<3 s)频繁(10~100 次/d)的肌张力障碍样抽动,发作时患者意识清楚,抗癫痫药物效果不佳[15]。FBDS通常于疾病初期出现,早于认知障碍数周,而全面性强直-阵挛发作常与认知障碍同时或紧随其后出现[16]。因此,FBDS 可作为早期诊断线索[17]。但FBDS 是由于自身免疫导致的癫痫发作还是肌张力障碍目前仍存在争议。有报道FBDS期间记录到痫样放电,头颅MRI 出现基底节病变,从而认为FBDS 本质是癫痫发作,起源于皮质下基底节[18,19]。本组4例出现FBDS,其中1例MRI存在底节区及颞叶病变,后期出现GTCS,而其余3例未发现底节区病变,因此,FBDS发病机制仍需进一步研究。
本组病例还表明,记忆障碍和精神异常是LGI1抗体脑炎患者常见和突出表现,主要影响定向力和记忆,尤其以近记忆力下降最为突出,这与既往研究结果类似。研究表明,40%患者以认知功能障碍起病,10%~15%患者可仅表现为认知障碍,而不伴任何类型癫痫发作[20]。有学者发现LGI1-金属蛋白酶蛋白22(ADAM22)-AMPAR相互作用对长时程增强和长时程抑制的影响可能在记忆障碍的形成过程中起重要作用[21]。本组病例精神行为异常表现为冷漠、亢奋等性格改变,此外还出现饮食过度、强迫行为、幻觉及睡眠障碍等,以此类症状起病者并不在少数。因此,对于中老年以突然出现情绪异常及性格改变就诊时,应警惕LGI1抗体脑炎的可能。低钠血症也是本病的常见症状,据报道60%~80%患者在发病早期出现低钠血症[14,22],其与LGI1在下丘脑和肾脏同时表达,导致抗利尿激素分泌异常相关[23]。本组4例出现低钠血症,单纯补钠治疗效果欠佳,经免疫治疗后低钠血症得到纠正。因此,不明原因的低钠血症也可作为早期诊断LGI1 抗体脑炎的线索之一。
LGI1抗体脑炎患者CSF常规检查结果无特异性,少数患者细胞数或蛋白可轻度增加[24]。本组1 例细胞数略升高,2 例蛋白升高,其余CSF 常规、生化均无异常。血清及CSF LGI1 抗体检测对于诊断该病至关重要。研究表明,与其他抗体(抗NMDAR 抗体、抗GABABR抗体、抗AMPAR抗体)不同,LGI1抗体血清阳性率更高[25],CSF 中LGI1 抗体水平仅为血清中的1%~10%[26],因此同时检测血清和CSF 抗体十分必要。本组7例患者血清抗LGI1抗体均为阳性,血清及CSF 抗LGI1 抗体双阳性者5 例,CSF 抗体水平均低于血清,与上述研究结果一致。
70%LGI1 抗体脑炎患者头颅MRI 表现为单侧或双侧海马、颞叶Flair高信号,部分患者累及杏仁核、岛叶及纹状体[10]。有学者发现,42%伴有FBDS的患者可在底节区出现T1高信号,此征象对仅表现为FBDS 的LGI1抗体脑炎患者的诊断具有重要意义[17]。随访发现41%~95%患者病程后期出现内侧颞叶萎缩,是遗留持续性记忆损害的重要原因[27]。本组3 例头MRI 异常,病灶主要累及一侧或双侧颞叶、海马,基底节等部位,与既往研究一致,提示颞叶内侧、底节区是LGI1抗体脑炎最常见的受累部位。研究表明75%患者脑电图异常,表现为局灶性或弥漫性慢波,也可出现颞叶或其他部位的痫样放电[28]。本组5例脑电图异常,多为弥漫性慢波,3例出现痫样放电,对本病诊断无特异性。该病较少伴有肿瘤,曾有合并胸腺瘤和乳腺癌的报道[10,11],也有病例报道存在抗Yo抗体阳性[7]。本组7例筛查均未发现肿瘤,支持LGI1抗体脑炎为非肿瘤性边缘性脑炎,但仍需长期随访排查肿瘤。
LGI1 抗体脑炎是一种可治性的自身免疫性疾病,以免疫治疗为主,及早治疗可降低认知功能损害程度[29],改善预后。一线免疫治疗包括糖皮质激素、静脉注射IVIG 及血浆置换。Shin 等[9]指出激素联合IVIG较单药治疗能够防止复发、改善认知功能。也有研究表明[30]大剂量激素联合IVIG 能够保护海马和颞叶的结构和功能,避免发展成为海马硬化。80%患者经一线免疫治疗后症状缓解,但2年复发率高达35%,病死率19%[10]。LGI1 抗体脑炎可能更易复发,遗留持续记忆损害及难治性癫痫,因此,在一线免疫治疗基础上增加免疫抑制剂显得十分必要。关鸿志等[31]报道了15例LGI1抗体脑炎患者应用吗替麦考酚酯联合一线免疫治疗效果良好,有效改善预后。最近研究表明[32]卡马西平治疗LGI1抗体脑炎患者的癫痫发作较左乙拉西坦效果更好,而对伴有FBDS 的患者效果甚微,与既往研究[17]结论相似。本组病例经免疫治疗均有效,例4 因诊疗时间迁延,出院后复发,加用硫唑嘌呤治疗。其余病例出院后随访6个月,后遗症主要是记忆力下降和睡眠增多,生活均可自理。本组2 例反复癫痫发作患者应用卡马西平治疗后发作终止,出院后仍口服维持剂量。
综上所述,出现急性或亚急性精神行为异常、记忆障碍及癫痫发作等符合边缘性脑炎症状时,应密切观察患者临床特征,若出现FBDS、低钠血症伴随头MRI边缘叶病变,需考虑LGI1 抗体脑炎的可能,确诊依赖于抗体检测,一线药物联合治疗能有效改善预后,使患者受益。
