载人航天器环境微生物免培养法检测技术研究进展
2020-10-31辛冰牧
辛冰牧,王 珩,徐 冲,赵 爽,张 红,谢 琼*
(1. 中国航天员科研训练中心,北京100094; 2. 深圳绿航星际太空科技研究院,深圳518172)
1 引言
美俄载人航天的经验证明,随着飞行时间的延长,载人航天器座舱内微生物的危害会越来越严重[1-3]。 对人体而言,太空中的微生物危害主要是影响乘组健康,作为病原体引起感染、过敏,同时微生物能释放有害气体,成为间接的致病源[4-5];对飞船系统而言,一些生物降解类微生物能够降解飞船材料、腐蚀仪器仪表,可能影响航天器硬件设备稳定性,致使仪器及系统失灵等[5-6]。随着各国深空探测计划的实施,航天器飞行距离越来越远,飞行时间越来越长,传统以在轨培养为基础的微生物检测技术凸显出不足之处,而新的检测技术还不成熟,使得航天器环境微生物监测已成为载人航天领域关注和急需解决的问题。
2 载人航天器环境微生物监测发展过程
早在20 世纪60 年代,美俄研究者就意识到微生物对载人航天的影响[7]。 微生物作为重要的生物医学问题,对其监测始于乘组健康的考虑。从阿波罗计划开始,微生物的监测就纳入了飞行任务,其目的是:①月球污染评估;②通过检测潜在病原微生物,以早期确认相关医学问题,采取预防措施;③从患病乘员身上分离临床重要微生物,辅助诊断和治疗;④收集微生物数据,阐明微生物种群对太空环境的反应性及评估其对乘组的影响。 在阿波罗计划历次飞行任务中,微生物监测仅限于飞行前和飞行后采样及地面分析[8-9]。
与阿波罗任务不同,空间实验室任务实现了在轨采样,包括飞行前、中、后乘组自身微生物和座舱环境微生物采样,采集样品在地面检测。 即,空间实验室阶段还未实现真正意义上的在轨微生物监测[10]。
和平号空间站进行了较细致的微生物检测,包括空气(12 个位置)、再生水、空气冷凝物、表面(内饰、仪器等)。 空气微生物采样基本每月1次,至少不超过两月1 次;采样所需耗材由货运飞船运送;由乘员在轨采集、培养、计数,并将结果在通话时间下传地面;表面微生物样本在每次飞行任务结束前采样,样本带回地面分析[1]。
国际空间站是迄今为止最大的空间国际试验平台,微生物监控涉及的场景越来越多,已成为乘员健康保障系统的重要组成部分。 微生物监测与控制从飞行任务上主要包括空间站(长期驻留)、载人运输飞船、货运飞船的微生物监控;从范围上主要包括环境(空气、仪器表面和水)和人体;从项目上包括细菌、真菌、主要致病菌和原生生物;从时间上包括飞行前、中、后。 国际空间站微生物监控,飞行前、中在轨实时监测主要进行菌落计数;飞行前、中留样还将进行地面深度检测,包括细菌及真菌分类鉴定[11]。
从阿波罗计划到国际空间站,在轨微生物检测项目逐渐增加,在检测方法上主要采用培养法进行座舱内微生物水平计数评估,深度的微生物种类鉴定则是通过把样本送回地面得以实现。 为实现在轨实时鉴定,越来越多的非培养技术逐步在国际空间站这一实验平台开展验证。
3 载人航天器环境微生物监测技术
3.1 基于培养法的微生物检测
培养法是国际和国内疾控及环境质量监测采用的标准方法,载人航天器进行微生物检测伊始就采用了此方法,至今仍是国际空间站进行环境微生物监测的常规方法。
微生物的监测依赖于可靠的采样设备, 能够准确定量微生物负荷(细菌、霉菌、酵母和真菌孢子)的测试方法及相应的评价标准。 由于受到太空失重及座舱资源的限制,样本的采集方式和样本的物理性状是设计者不得不考虑的问题,培养法无疑是一种可靠的微生物定量方法。 该方法利用物理方式将样本采集在固体营养介质上,在适宜的温湿度条件下培养一定时间后,进行计数和后期的微生物鉴定。
1)空气微生物采样。 国际空间站空气微生物采样基于撞击原理,从空气流中分离气溶胶粒子并撞击在固体采样琼脂表面,达到捕获微生物粒子的目的。 采样器结构简单、体积小、重量轻,噪音低,操作简单,能够满足在轨采样的需求。 捕获的微生物粒子附着在固体营养琼脂平板上,可直接放入培养箱进行培养。
2)表面微生物采样。 国际空间站采用了接触式营养平板,采样时将采样面直接覆盖于采样平面,就能够达到捕获微生物粒子的目的。 国际空间站也采用无菌棉拭子进行表面采样,但棉拭子采集的样本需要经过含水试剂溶解处理后方能进行培养,因此这种样品只能带回地面检测。 除棉拭子采样外,日本舱开展了用粘附纸片法进行表面微生物样本采集的研究[12]。
3)水的微生物采样。 国际空间站使用了采样袋、微生物俘获滤膜、废水袋等组成的分体式密闭装置,将微生物粒子捕获在滤膜上,加注培养介质后进行培养计数。
“无产阶级的运动是绝大多数人的,为绝大多数人谋利益的独立的运动”[3](P411)。中国共产党自成立之日起,奋斗目标就是为了维护和实现大多数人的利益。以毛泽东为代表的早期共产党人,为了中国人民的解放事业,把自己的毕生精力都献给了革命事业,始终与人民保持着密切的联系,形成了群众路线,并在争取到最大多数人民群众支持和拥护的基础上取得了新民主主义革命的胜利,建立了中华人民共和国,使广大人民群众实现了解放。
同时,NASA 对于国际空间站乘员舱内以上3类微生物规定了相应的限值标准[13],为乘员舱环境微生物控制,保障乘员健康提供依据。
3.2 基于非培养法的微生物监测技术
依据国际空间探索协调组织(ISECG)发布的全球探索路线图[14],到2030 年,人类将进入火星轨道。 这就意味着人类将飞得更远,飞得更久。无论是近地轨道飞行,还是深空探测,航天员均有医学问题发生的风险,同时会发生适应太空环境的生理改变,乘组医生需要与地面医疗相同的、依赖于分子水平的、准确实时的临床数据进行诊断。
近年来,科学家们在微机电系统(MEMS)、纳米技术和分子生物学领域取得了无可争议的进步和突破,使复杂医学检测设备小型化、简单化成为可能,以微流控技术、微机电技术、纳米技术与分子生物学相结合为原理的医学检测设备纷纷登陆太空,为人类实施疾病诊断、寻找新基因、药物筛选等提供操作平台,为在轨实时检测技术的发展提供理论基础和技术支持。
3.2.1 基于磷脂多糖(lipopolysaccharide,LPS)的微生物检测
2006 年11 月,基于鲎试剂的芯片实验室(Lab-On-a-Chip Application Development Portable Test System,LOCAD-PTS)由STS-116 送入国际空间站,在2006 ~2009 年间进行评价试用,开展了对国际空间站表面微生物快速检测的研究项目,使用仪器为便携式发光检测仪,原理是通过革兰氏阳性菌、革兰氏阴性菌、真菌细胞壁存在的特异组份磷脂多糖(内毒素)、脂磷壁酸(lipoteichoic acid)、β-1,3-葡聚糖进行定量检测(图1)[15]。 该系统分为采样(Swabbing Unit)、样品预处理(Swabbing Kits)、加样板(Cartridges)和检测仪(Reader)4 部分组成,采样器具有采样、预处理和加样功能; 预处理部分为预充无内毒素水的柱状模块,可与采样器连接,通过采样器按钮将样本混合,后连接加样吸头将样本加注在加样板上,进行检测(图2)[15]。 该系统为手持便携仪器,优点是体积小,重量轻,同时检测快速,15 min 出结果。但由于生物活性分子在不同类型微生物中分布差异较大,与培养法在结果上不对应;目前针对该法及国际空间站现行环境微生物控制要求,项目组已提出了相应判断标准[16]。 在定性方面,该方法无法鉴定到某一属、种。 目前该方法为试验项目,由于采样方法的局限,仅用于表面微生物检测。
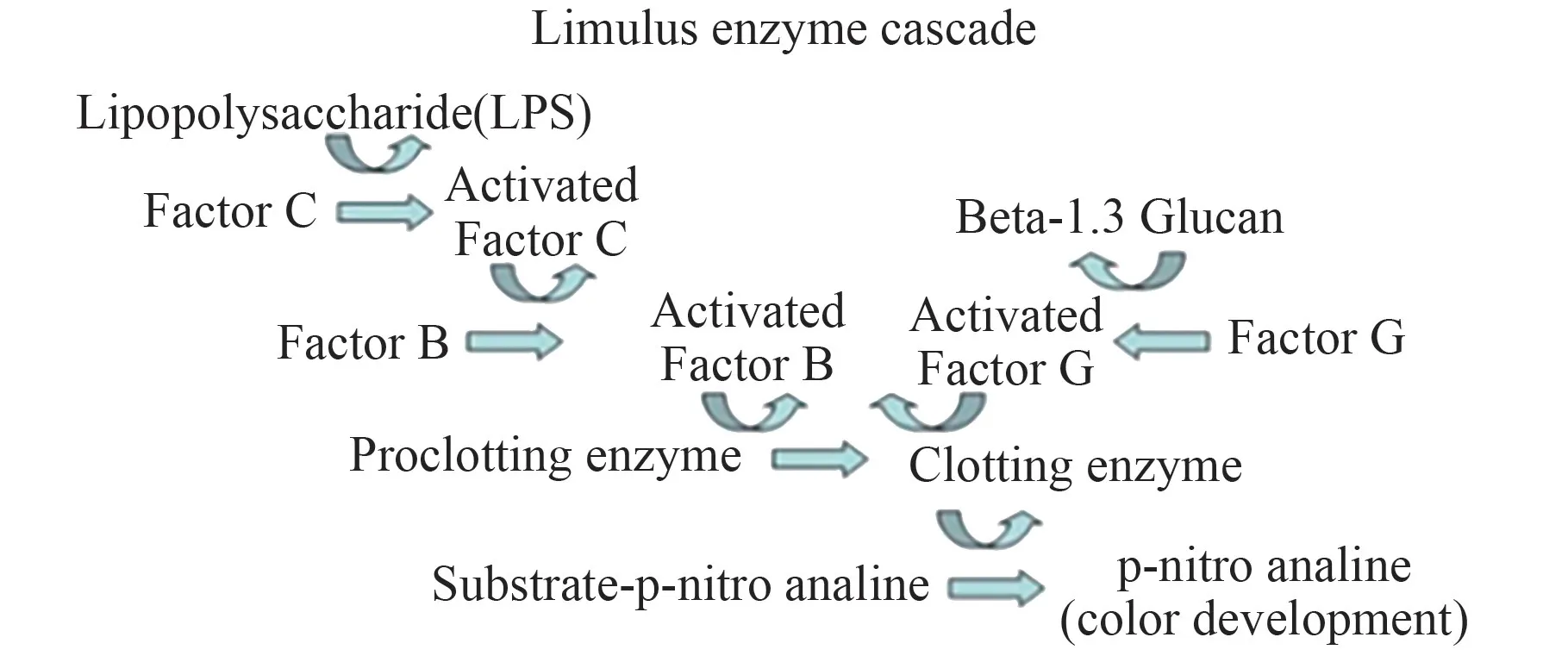
图1 LOCAD-PTS 检测原理图[15]Fig.1 Schematic diagram of LOCAD-PTS test[15]

图2 LOCAD-PTS 检测设备及备件[15]Fig.2 Equipment and accessories of LOCAD-PTS test[15]
3.2.2 基于核酸的微生物检测
2006 年欧洲航天局微重力应用计划(European Space Agency Microgravity Applications Programme,ESA-MAP)资助SAMPLE 实验项目,该项目使用定量实时PCR 法(Quantitative real time PCR, Q-PCR)与荧光原位杂交(Fluorescence in Situ Hybridization, FISH)法相结合,对国际空间站样本进行检测,建立了适于空间应用的采样、DNA 分离技术;并设计包括人致病菌-金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌、嗜肺军团菌等在内的多个细菌的特异Q-PCR 引物探针[17]。 此外, Vesper 等[18]也使用了Q-PCR 方法对国际空间站样本进行了产毒青霉菌等真菌的检测,并指出Q-PCR 技术的在轨应用前景。
2016 年7 月20 日,由英国牛津纳米孔技术公司研制的手持式DNA 测序以MinION 由SpaceX 公司天龙号太空补给飞船运至国际空间站,NASA 航天员Kathleen Rubins 成为第一个进行在轨DNA 测序的人,她对小鼠、大肠杆菌和噬菌体病毒DNA 进行了测序。 目的是证实在太空进行DNA 测序是可行的,进而实现在轨微生物鉴定、检测太空飞行对微生物和人体的影响及寻找和发现地外生命的目的。 此次实验使用地面事先准备好的的DNA 样本[19]。 与其他非培养法实现在轨检测的困难相同,核酸法在轨检测前需要进行DNA 提取、扩增等操作,由于受到失重条件的限制,地面核酸样本的处理方法无法在太空中直接应用。 NASA 开放了一套新型的分子生物学实验系统Wetlab-2, 专门设计用于微重力条件下处理生物样本,在轨进行实时基因表达分析。 这套系统包括液体RNA 样本制备模块、流体传输装置、一体式冻干PCR 分析仪、离心机和实时PCR热循环仪(图3)。 该系统2016 由SpaceX CRS-8货运飞船送至国籍空间站,在4 ~5 月间开展相应研究[20]。 国际空间站开展的基因-3 项目,将样本处理与MinION 检测连接,首次完成在轨从样本到微生物鉴定全过程操作。 但该项目样本仍来源于平板培养后的菌体样本[21]。 NASA 项目主管微生物学家Wallace 博士表示“下一步将在太空完成整个测序过程,不再带样本到太空,而是由航天员在太空取样、预处理,然后进行基因测序”。

图3 Wetlab-2 系统操作流程图[20]Fig. 3 Operational flowchart of Wetlab-2 system[20]
2011 年,由北京理工大学团队研制的微流控芯片基因扩增装置,在神舟八号成功搭载并圆满完成空间生物实验研究,实现了中国微流控芯片技术在太空领域的应用。
测序仪不但可以成为快速准确的诊断设备,同时也是科研的重要研究工具,如直接检测绕轨飞行中遗传物质表达的变异,而不是返回地面分析后才知道结果,这将对未来长时间飞行的深空探测发挥重要作用。
3.2.3 基于ATP 的微生物检测
早在20 世纪60 年代,ATP 法已用于评估工业环境卫生质量,其原理是使用化学发光检测仪特异检测微生物细胞内的ATP,从而确定微生物总数。 目前已有市售商品,这类产品体积小、重量轻、操作简便、检测快速。 用于表面微生物检测时,只需用专用棉拭子擦拭采样区域,再与含细胞裂解成分的试剂混合数分钟即可检测,整个过程不超过5 min。 在20 世纪80 年代,ATP 法被认为是最便捷、可靠的评估多数环境微生物总数的方法[22]。 La Duc 等[23]使用培养法、ATP 法、Lps 法及DNA 法检测空间站样本的比较研究中指出,ATP 法灵敏度高,以ATP 法检测国际空间站表面微生物样本,检测的微生物总数至少高于培养法2~3 个数量级;但这也是其缺点所在,因无法增殖的死亡细菌也含有ATP,因此该方法无法区分死亡和有增殖能力的微生物,这也是其检测在数值上明显高于培养法的原因之一;此外ATP 法只能评估环境样本的微生物总数,无法作分类鉴定。
ATP 法在NASA 目前主要用于行星保护计划,该方法也列入了MARs 计划,用于快速检测外太空的生命体。
3.2.4 基于微流控技术的微生物检测
流式细胞仪其灵敏、快速检测的特性,被认为在某种程度上可以代替荧光显微镜。 但地面上所使用的流式细胞仪操作复杂,有时需要具有专业技术的人员完成检测。
2012 年9 月至2013 年9 月,由加拿大太空局(CSA)资助、来自于加拿大INO 公司基于微流技术的小型流式细胞仪(Miniaturized flow cytometer)在ISS 开展实验;该项目旨在评估微流技术在太空环境的可应用性;该技术对于进行生理和生物学研究,实施在轨医学监测具有重要价值[24]。
小型流式细胞仪在太空的应用前景包括:可以使用少量血液或其他体液样本,通过快速病毒和细菌鉴定,血球计数实时检测诊断感染性疾病;通过检测血中类胰蛋白酶水平诊断过敏性疾病;通过检测酶,胆红素和血细胞计数评价肝脏功能,判断肝脏损伤;通过检测血中辐射相关生物标记物和染色体变异(核型)判断辐射暴露损伤;通过尿中血细胞检测诊断肾结石;通过快速检测血中肌钙蛋白对心肌梗塞进行诊断等。 同时,人体对于太空环境的生理适应性反应也可以通过这种具有实时分析能力的设备得到跟踪研究。 流式细胞仪支持以下人体生理功能检测:生理改变包括骨丢失、肌肉萎缩、心血管适应性改变及贫血;应激水平包括血液中激素水平;免疫功能包括免疫细胞数量及活化状态等。
4 讨论
一种既有效又可靠的载人航天器在轨微生物检测方法,应具备以下特点:①满足失重环境下使用;②自动化程度高,对航天员的操作需求小;③一次操作能正确定量和区分多种微生物;④完成检测依赖的资源少,能耗小。
目前载人航天器所使用的环境微生物检测方法主要为培养法。 培养法有准确性高、较直观、判读标准较成熟等优点,但也有明显的缺点:①在轨培养有一定的生物学危险性。 ②需要采样和培养设备,占用资源较多。 ③培养需时间较长,判读结果有延迟性;依据国际空间站医学操作需求文件(ISS Medical Operation Requirement Document,MORD),空气和表面样本需在轨培养5 d后进行菌落计数。 ④只能作总数监测,无法进行分类鉴定;国际空间站在轨微生物检测中,只有水中肠菌通过将水采集在预装了鉴定培养基的分析袋中,经培养后颜色变化,鉴定肠菌是否超标,但也无法区分肠菌类别;俄罗斯SM 舱采用了通过肉眼观察,对平板培养的菌落进行形态学分类的鉴定方式,将细菌分为生孢菌、肠菌、革兰氏阴性菌等,将真菌分为亮色和暗色两种,这种方法比较粗略,且需一定背景知识;大量的样本还是需带回地面进行分析鉴定。 ⑤培养法可能会低估微生物种群的数量,因为某些微生物需非培养或特殊培养条件。研究显示,仅1%的微生物是可培养的。 使用培养法在国际空间站样本中检出杆菌属是主要存在的细菌,但非培养法检测显示国际空间站存在大量革兰氏阴性和阳性菌;同样,国际空间站未培养得到水中微生物,但DNA 检测发现国际空间站水样中存在大量条件致病菌的核酸序列。
近年来新的检测技术不断涌现,以满足空间站检测的实际需求,其中包括基于ATP 微生物检测方法、基于LPS 微生物检测方法、基于核酸的检测方法等,以内毒素、葡聚糖、表面抗原、大分子生物标志物等细菌和真菌活性分子为基础的、非培养、便携式微生物检测技术研究已成为微生物领域的热点。 这类检测方法的优点包括(表1):①检测快速,可在几小时、甚至几分钟内出结果,如ATP、LPS 法仅需数分钟即可完成检测,核酸检测可在数小时内完成检测;②避免了有活性的微生物增殖,生物危险性低;③自动化程度高。 但也存在以下问题:①样本的采集、预处理及检测过程的失重环境适应性,是其在轨应用需要解决的首要的、关键的问题;如基于核酸的检测技术虽被普遍看好,但由于其样本处理涉及液体操作界面,在前面提到的项目绝大多数尚处在地面研究或在轨验证阶段,未实现在轨应用。 ②以内毒素、葡聚糖、表面抗原、ATP 等生物标志物为靶点的检测方法,由于生物活性分子在不同类型微生物中分布差异较大,在定量上很难与实际菌落数形成一对一,或相应的比例关系,其判读标准的制定,即载人飞行器环境微生物卫生学标准的制定也是需要解决的关键问题,该问题解决最好的是基于LPS 检测的LOCAD-PTS 项目。 ③以ATP、DNA 等方法检测,无法区分死亡和有增殖能力的微生物,这会给座舱微生物的危害评估带来困难,在环境微生物数量评估方面还无法取代培养法。

表1 环境微生物检测方法比较Table 1 Comparison of detection methods for environmental microbes
5 结论
1)以非培养法为基础的检测技术和便携式微生物检测设备研究很具有发展前景,但目前技术上尚不成熟,实现在轨应用还有距离;在计数评价座舱环境微生物负荷方面,尚无法取代培养法,应用中可考虑与培养法的结合使用,以达到在轨检测微生物的准确性、全面性。
2)载人航天器微生物检测技术随着载人航天事业的发展不断进步,正在从对座舱环境微生物单纯在轨计数评价,逐步实现计数与微生物鉴定相结合的综合评价,这将为未来深空探测乘员感染性疾病诊断,对空间微生物生物学特性变化开展实时研究及地外原位生命发现与行星保护提供技术支持。
