人源脐带间充质干细胞对脑缺血再灌注小鼠神经功能及神经炎症的影响
2020-10-29石凯燕张春雪王艺静
石凯燕, 张春雪, 王艺静, 王 臻, 孙 毅,2
(1. 同济大学医学院,上海 200092; 2. 同济大学附属同济医院干细胞临床转化中心,上海 200065)
中风已跃居成为世界第2位、中国第1位的死亡因素,其中,缺血性脑卒中是主要的中风类型[1]。缺血性脑卒中可造成神经细胞永久性坏死和凋亡,进而导致患者神经功能受损。脑缺血可触发一系列以炎症为主要特点的级联反应。首先,缺血缺氧导致神经细胞坏死,产生活性氧类(ROS)等神经毒性物质,导致脑实质小胶质细胞激活并产生大量的炎症细胞因子;其次,趋化因子和黏附因子表达量的上调,导致血脑屏障破坏,进而导致血源性单核/巨噬细胞、中性粒细胞及淋巴细胞等外周免疫细胞趋化并浸润脑实质;此外,小胶质细胞/巨噬细胞进一步释放炎症细胞因子及一氧化氮、基质金属蛋白酶等多种细胞毒性物质,从而损伤神经细胞并引起脑水肿和出血性转化[2]。
早期临床治疗缺血性脑卒中常采用药物溶栓及机械取栓等以恢复血液灌流,然而该治疗手段受6h时间窗的限制,且容易导致神经二次损伤和出血性转化,因此缺血性脑卒中尚缺乏安全有效的治疗方法[3-4]。近年来,间充质干细胞治疗可有效延长时间窗,为脑卒中的治疗提供了新的策略。其中,人源脐带间充质干细胞(mesenchymal stem cells derived from Wharton’s jelly, WJ-MSC)来源广、取材方便、无伦理学争议,是理想的干细胞类型。MSCs在体内外均具有免疫调控特性。Ramasamy等[5]发现MSCs与成熟DC细胞共培养,可上调IL-10的表达,下调促炎细胞因子TNF-α和IFN-γ的表达。MSCs还可抑制NK细胞分泌IFN-γ等[6]。MSCs的这一特性为缺血性脑卒中的治疗提供了可能。Yoo等[7]的研究表明,MSCs通过分泌TGF-β而降低外周免疫细胞的浸润,进而改善脑缺血损伤大鼠的神经功能。此外,Wang等[8]发现MSCs通过抑制NF-κB的激活,从而抑制小胶质细胞/巨噬细胞表达iNOS和IL-1β,进而降低脑损伤。以上研究表明,WJ-MSCs治疗脑缺血疾病的机制可能与MSCs调控炎症因子表达及小胶质细胞/巨噬细胞活化有关。基于此,本研究旨在通过细胞移植探究WJ-MSCs对脑缺血再灌注损伤小鼠神经功能及神经炎症的影响,为脑卒中疾病的治疗提供理论依据。
1 材料与方法
1.1 实验动物及分组
8~9周龄清洁级野生型C57BL/6小鼠96只,均为雄性,体质量25~30g,购于北京维通利华实验动物有限公司。适应性饲养1周,随机将96只鼠分为假手术组、PBS处理组、WJ-MSCs细胞移植组,每组32只。
1.2 试剂和仪器
DMEM/F12培养基、血清替代物、肝素钠、Trypsin-EDTA(0.25%)、磷酸盐缓冲液购自Gibco公司;戊巴比妥钠(P11011)购自德国Merck公司;异氟烷(R510-22)购自深圳市瑞沃德生命科技有限公司;5-溴-2′-脱氧尿苷(B5002)购自Sigma公司;异丙醇(40049962)、无水乙醇(10009218)购自中国国药集团有限公司;Nuclease-Free水(AM9932)购自美国Ambion公司;4%多聚甲醛(P1110)、蔗糖(S8270)、Triton-100(T8200)购自北京索莱宝公司;Fluoromount-G荧光封片剂(0100-01)购自Sou-thern Biotechnology Associates公司;兔抗小鼠Iba1多克隆抗体(anti-Iba1,019-19741)购自日本WAKO和光纯药工业株式会社;大鼠抗小鼠Brdu单克隆抗体(ab6326)、兔抗小鼠NeuN单克隆抗体(anti-NeuN,ab177487)购自美国Abcam公司;TRIzol(15596018)购自美国Invitrogen公司;驴抗兔Alexa Fluor 488二抗(711-546-152)、驴抗兔Cyanine3二抗(711-166-152)、驴抗大鼠二抗Alexa Fluor 488(712-545-150)、驴血清(Y2-017-111-121-10)购自美国Jackson ImmunoResearch公司;Prime-Script-TMRTreagent Kit、TB Green®Premix Ex TaqTMⅡ购自日本TaKaRa公司。RT-qPCR引物由Thermo公司合成,引物序列见表1。

表1 RT-qPCR引物序列
黏附载玻片(80312-3161-16)购自江苏世泰实验器材有限公司、盖玻片(12-548-5M)购自Fisherfinest公司、桌面数显脑立体定位仪(68025)购自深圳市瑞沃德生命科技有限公司;微量注射泵(Harvard Pump 11 Elite)购自哈佛仪器有限公司;线栓(L1800-100)购自广州佳灵生物技术有限公司;小动物麻醉机(R540IP)购自深圳市瑞沃德生命科技有限公司;NikonSMZ800体式显微镜购自日本尼康;Hamilton微量注射器(7642-01)购自美国Hamilton公司;玻璃微电极(415-883-0128)购自Sutter instrument公司;手术剪、眼科镊、弯镊购自上海医疗器械股份有限公司;医用真丝编织线(F603)购自上海浦东金环医疗用品股份有限公司;动物术后恢复箱(5103型)购自上海玉研科学仪器有限公司;冰冻切片机(CM1905)购自德国莱卡公司;激光共聚焦显微镜成像系统(Zeiss LSM 800)购自德国卡尔蔡司公司。
1.3 方法
1.3.1 小鼠大脑中动脉阻塞再灌注模型制备 参照文献[9]报道,采用颈总动脉直接插线栓法制备大脑中动脉阻塞再灌注(middle cerebral artery occlusion and reperfusion, MCAO/R)模型,手术操作均在SPF清洁级动物房进行,且遵循无菌原则,方法如下。随机取64只小鼠,腹腔注射1%戊巴比妥钠(10mL/kg)进行麻醉,将小鼠仰卧位固定于手术台上。对颈部剃毛并消毒,采用手术剪做颈部正中切口,钝性分离皮下各层组织,暴露左侧颈总动脉、颈外动脉和颈内动脉,用6-0手术线环绕颈总动脉以作提拉,阻断血流。在距颈动脉叉近端0.7~0.8cm处结扎颈总动脉,近端0.3~0.4cm处用显微手术剪剪一小切口,将硅胶头包被的线栓通过切口插入,经颈总动脉进入颈内动脉,阻断血流。60min后拔除线栓,缝合皮肤并消毒颈部。另取32只小鼠为假手术组,即只分离颈总、颈内和颈外动脉,不插栓。
1.3.2 WJ-MSCs的体外贴壁培养 人脐带来源的WJ-MSCs来自同济大学医学院转化研究中心,细胞培养采用无血清体系,WJ-MSCs培养于含5%血清替代物和0.032%肝素钠抗凝剂的DMEM/F12培养基中,待细胞汇合至85%,按1∶3进行传代。
1.3.3 细胞移植 采用胰酶法消化收集第3代WJ-MSCs,用1×PBS制成细胞密度为1.25×108个/mL的单细胞悬液。本实验采用脑立体定位移植法: 细胞移植组小鼠于造模后24h,使用异氟烷装置面罩进行麻醉维持,气体浓度为2%。对小鼠头部剃毛、消毒并暴露颅骨,以Bregma点为坐标零点,使用颅骨钻于AP=0mm,ML=2.3mm处钻一骨窗,玻璃微电极下针深度为2.3mm,使得注射针在脑内留针2min。设置微量注射泵输注速度为50nL/min,注射0.4μL(细胞数5×104)细胞悬液,注射完成后留针静置4min,随后缓缓抬起注射针;PBS组注入等量浓度0.01mol/L的PBS溶液;假手术组不作处理。术后缝合皮肤并于37℃动物术后恢复箱对小鼠进行保温。各组取6只小鼠于细胞移植后腹腔注射剂量为100mg/(kg·d)的BrdU溶液,持续5d。
1.3.4 小鼠神经功能评分 假手术组、PBS处理组以及细胞移植组各10只小鼠于术前及术后1、6、12、18、24d进行评分,参考国际公认的小鼠神经功能损伤评分量表(modified neurological severity scores, mNSS)[10]。评分内容包括运动测试(提尾及行走测试)、感觉测试(视觉/触觉及本体感觉测试)以及平衡能力测试(平衡木测试)等方面。1~6分为轻度梗死,7~12分为中度梗死,13~18分为重度梗死。将造模后第1天mNSS评分为7~12分的中度梗死小鼠纳为研究对象。实验采用双盲评分方法,每只动物重复评价3次。
1.3.5 RT-qPCR 术后6d时,对假手术组、PBS组以及细胞移植组各8只小鼠腹腔注射1%戊巴比妥钠(10mL/kg)进行麻醉,用1×PBS进行灌注,将小鼠断头取脑,使用解剖镊将小鼠大脑分为左右半脑,采用TRIzol法提取小鼠缺血侧大脑半球组织总RNA。采用PrimeScriptTMRTreagent Kit,首先去除DNA,去除DNA的PCR反应条件为42℃,2min;其次将mRNA反转录为cDNA,反应条件为: 37℃,15min;85℃,5s;4℃;使用试剂TB Green®Premix Ex TaqTMⅡ进行RT-qPCR,检测炎症因子基因的转录表达量,引物序列见表1。扩增程序为95℃ 30s;95℃ 5s,60℃ 34s,40个循环。扩增程序结束,分析熔解曲线,采用2-ΔΔCt法分析数据,用2-ΔΔCt表示炎症因子的mRNA相对表达量。
1.3.6 免疫组织荧光染色 术后6d时,对假手术组、PBS处理组以及细胞移植组各14只小鼠腹腔注射1%戊巴比妥钠(10mL/kg)进行麻醉,用1×PBS进行灌注,4%多聚甲醛灌注固定,断头取脑并在4%多聚甲醛中浸泡过夜,然后将大脑置于浓度15%、30%蔗糖溶液进行梯度脱水,OCT包埋并置于-80℃保存。冠状连续切片(厚度为10μm),保留纹状体部位;每隔6张切片取一张切片用PBS漂洗。BrdU染色组切片加2N盐酸溶液于37℃孵育30min,弃掉盐酸溶液,加0.1mol/L PH8.5的硼酸溶液孵育10min,PBS漂洗3次,每次10min。切片加染色封闭液,室温封闭1h,吸取兔抗小鼠Iba1多克隆抗体(1∶500)和大鼠抗小鼠Brdu单克隆抗体(1∶100)进行免疫荧光双标记染色,吸取兔抗NeuN单克隆抗体(1∶300)进行免疫荧光单标记染色。于4℃孵育24h后,弃掉一抗并用PBS漂洗,滴加对应二抗和DAPI(1∶1000)室温避光孵育2h,PBS漂洗,切片滴加Mount封闭液封片。室温避光晾干2d后,保存于4℃。
1.3.7 共聚焦显微镜图像采集与细胞计数 应用共聚焦显微镜对上述染色切片进行观察和拍摄。荧光信号DAPI、Alexa Fluor 488以及Cyanine3分别在激发波长353、493、548nm和发射波长465、517、561nm 下进行荧光成像。设置Z-stackstep size为0.6μm进行扫描。假手术组、PBS处理组以及细胞移植组的每只小鼠各取4张脑片,在20倍镜下拍摄梗死灶以及梗死灶周围区皮质相同位置的3个视野。应用Imaris×64 9.2.1软件进行统计分析: 计数每个视野的NeuN+细胞数量,由视野面积得出NeuN+细胞密度值并计算单只小鼠的细胞密度平均值;计数每个视野的Iba1+以及Iba1+Brdu+细胞数量,计算Iba1+Brdu+细胞数目百分比并得到单只小鼠的百分比平均值;计数每个视野的Iba1+荧光信号面积,并计算单只小鼠的Iba1+荧光面积平均值。
1.4 统计学方法
2 结 果
2.1 WJ-MSCs表面标志物鉴定及三系分化潜能检测结果
间充质干细胞的特性鉴定对于体内外研究及干细胞临床转化应用至关重要。参照2006年国际细胞治疗协会提出的鉴定标准,即MSCs表达: CD90、CD105、CD73和CD44,不表达: CD34、CD11b、CD19、CD45、HLA-DR,应用流式细胞术检测WJ-MSCs表面标志物的表达,阳性率达95%以上,见图1。当细胞汇合度达到85%时,消化传代,按照每孔1.2×104的细胞数接种在24孔板中。使用脐带间充质干细胞成骨、成脂、成软骨诱导分化完全培养基诱导WJ-MSCs向骨、脂肪和软骨方向分化。诱导培养2周或3周后,对贴壁细胞进行成骨、成脂和成软骨的染色鉴定,鉴定方法参照文献[11]。染色结果表明WJ-MSCs具有极强的三系分化能力,见图2。
2.2 WJ-MSCs显著改善脑缺血再灌注损伤小鼠的神经功能
参考mNSS神经功能损伤评分量表,对各组小鼠术前及术后1、6、12、18、24d进行神经功能损伤评分。假手术组无神经功能损伤。MCAO/R小鼠术后神经功能损伤严重,且随时间延长均有所恢复。与PBS处理组相比,术后6d时,细胞移植组小鼠的转圈行为得到改善,且mNSS评分低于PBS处理组,但无显著性差异。术后12d(P<0.01)、18d(P<0.0001)、24d(P<0.0001)时,细胞移植组小鼠的mNSS评分均低于PBS组,且差距逐渐增大,表明WJ-MSCs改善了脑缺血再灌注损伤小鼠的神经功能,见图3。
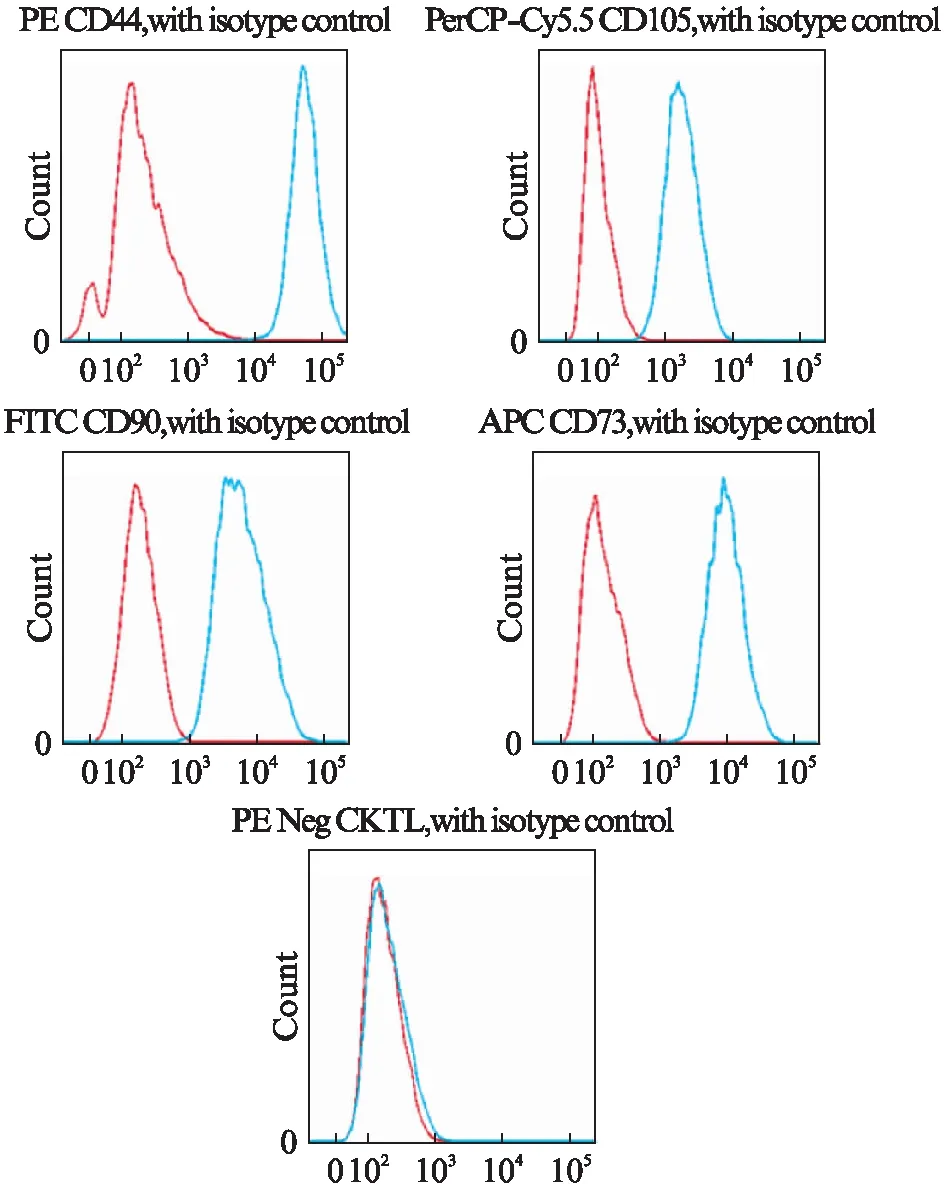
图1 流式细胞术检测WJ-MSCs表面标志物Fig.1 Flow cytometer analysis of WJ-MSCs
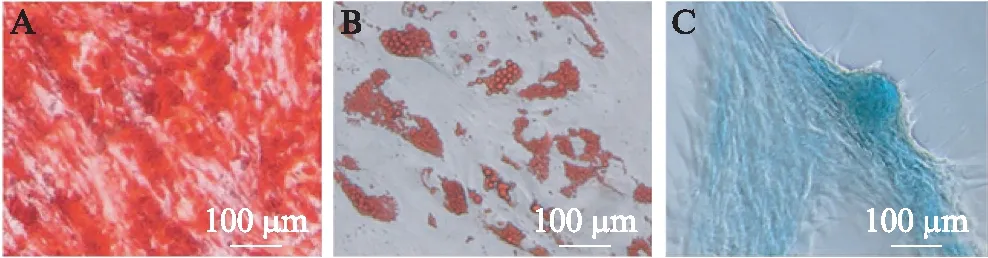
图2 WJ-MSCs三系分化潜能Fig.2 Multilineage differentiation of WJ-MSCsA: 成骨染色;B: 成脂染色;C: 成软骨染色
2.3 WJ-MSCs显著降低大脑梗死灶及梗死灶周围区皮质神经元变性丢失
NeuN免疫荧光染色及全脑共聚焦扫描结果显示,MCAO/R小鼠缺血侧大脑梗死灶及梗死灶周围区皮质的NeuN阳性神经元排列紊乱,细胞核皱缩,数目明显减少,且形成了明显的边界,见图4A、图4B。与PBS处理组小鼠相比,细胞移植组小鼠缺血侧大脑梗死灶[(374.5±24.94)vs(618.8±61.11) 个/mm2,P<0.01]及梗死灶周围区皮质[(444.9±78.79)vs(760.8±51.59) 个/mm2,P<0.01]的存活神经元数量分别增加了65%、71%,且差异有统计学意义,见图4C。
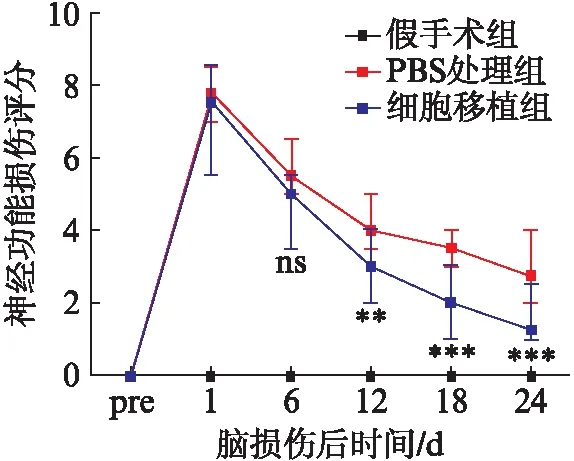
图3 脑缺血再灌注损伤后各时间点神经功能损伤评分Fig.3 Quantification of neurologic function scores at different time points after MCAO与PBS处理组相比,**P<0.01,***P<0.0001;ns: 无显著变化;n=10
2.4 神经炎症相关基因表达量的RT-qPCR检测结果
为探究WJ-MSCs对脑缺血再灌注损伤小鼠神经炎症因子mRNA表达量的影响,本研究对相关抗炎因子和促炎因子实施了RT-qPCR的检测。研究结果显示,MCAO/R小鼠缺血侧大脑神经炎症因子的mRNA表达量均明显上调;与PBS处理组小鼠相比,细胞移植组小鼠缺血侧大脑抗炎因子TGF-β1、IL-10的mRNA表达量明显升高,差异具有显著性意义(P<0.05)。同时,细胞移植组小鼠缺血侧大脑促炎因子IL-6、TNF-α、IL-1β mRNA表达量显著降低(P<0.05),IFN-γ则无显著性差异,见图5。
2.5 WJ-MSCs显著抑制大脑梗死灶及梗死灶周围区皮质小胶质细胞/巨噬细胞的活化和增殖
为探究WJ-MSCs移植对脑缺血再灌注损伤小鼠缺血侧小胶质细胞/巨噬细胞的影响,本实验使用小胶质细胞/巨噬细胞特异性标志物Iba1和增殖标记物BrdU进行了免疫荧光双标记染色。结果显示,与假手术组小鼠相比,MCAO/R小鼠缺血侧大脑梗死灶及梗死灶周围区皮质的小胶质细胞/巨噬细胞明显活化,其胞体变大,突起缩短,由细长分支状变为圆形或“阿米巴状”,且显著增殖;与PBS处理组小鼠相比,细胞移植组小鼠缺血侧大脑梗死灶及梗死灶周围区皮质的Iba1阳性细胞活化程度分别降低了31.5%、19.8%[(61.18±7.990)×103vs(41.92±1.942)×103μm2,(47.36±2.609)×103vs(37.98±2.415)×103μm2,均P<0.05],且增殖中的Iba1阳性细胞数量分别降低了23.4%、16.7%[(58.80±1.594)vs(45.04±5.448) 个/mm2,(58.28±2.539)vs(48.57±2.970) 个/mm2,均P<0.05],且差异有统计学意义,见图6。

图4 WJ-MSCs显著降低大脑梗死灶及梗死灶周围区皮质的神经元变性丢失Fig.4 WJ-MSCs significantly alleviated degeneration and damage of neurons in infarcts and marginal cortex after MCAO/RA: NeuN(绿色)免疫荧光染色;B: 缺血侧大脑梗死灶及梗死灶周围区皮质进行共聚焦扫描拍照的区域;C: NeuN阳性细胞密度统计比较,n=8,**P<0.01
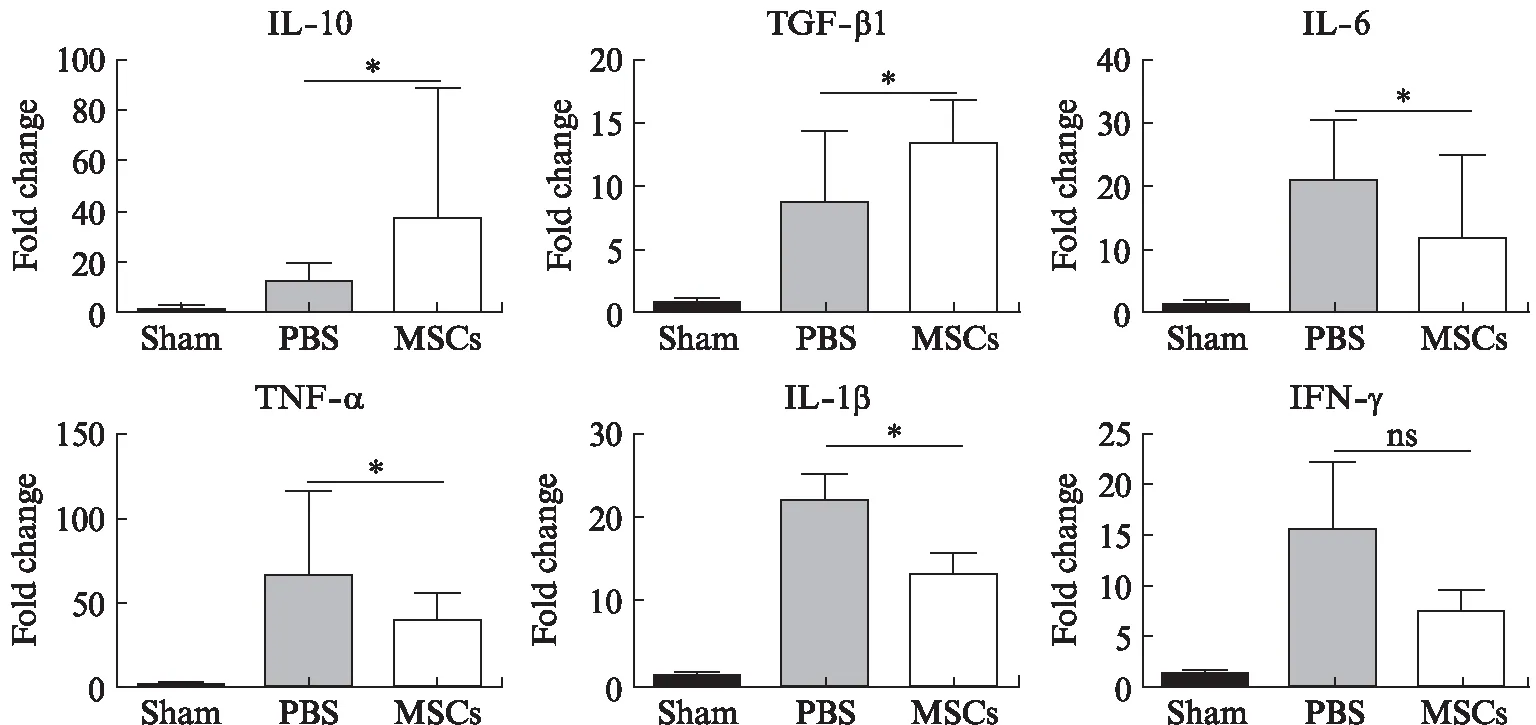
图5 脑缺血再灌注损伤小鼠缺血侧大脑半球炎症因子的mRNA表达量检测Fig.5 RT-qPCR shows the expression of inflammatory factors in ischemic hemisphere与PBS处理组相比,*P<0.05;ns: 无显著变化,n=8

图6 WJ-MSCs显著抑制脑缺血再灌注小鼠缺血侧大脑梗死灶及梗死灶周围区皮质小胶质细胞/巨噬细胞的活化和增殖Fig.6 WJ-MSCs significantly inhibit activation and proliferation of microglia/macrophage in infarcts and marginal cortex after MCAO/RA: Iba1(红色)/BrdU(绿色)免疫荧光染色;B: 白色方框b中的放大图像;C: 小胶质细胞/巨噬细胞活化情况统计;D: 小胶质细胞/巨噬细胞增殖情况统计;*P<0.05,n=6
3 讨 论
WJ-MSCs指分离自人脐带华氏胶组织的间充质干细胞。WJ-MSC来源广、取材方便、无伦理学争议,且易于分离培养,增殖能力旺盛。此外,WJ-MSCs不表达MHC Ⅱ 类分子,低表达或不表达MHC Ⅰ 类分子,因此免疫原性低[12]。不仅如此,WJ-MSCs可分泌神经营养因子,包括脑源性神经营养因子、肝细胞生长因子等,进而改善神经细胞的营养和代谢状况[13];研究还发现,WJ-MSCs具有抗炎的免疫调控特性[14]。基于以上特性,WJ-MSCs广泛应用于缺血性脑卒中疾病的研究中。大量动物实验研究表明,人源脐带间充质干细胞移植能够显著促进缺血损伤脑组织修复、降低脑梗死体积、改善血脑屏障损伤,进而促进神经功能的改善[15-16]。本实验在体内验证了WJ-MSCs对脑缺血再灌注损伤小鼠具有显著的治疗效果,这体现在WJ-MSCs增加了MCAO/R小鼠缺血侧大脑梗死灶及梗死灶周围区皮质的存活神经元数目并促进了行为学的改善。有研究表明MSCs移植可促进脑缺血小鼠大脑内源性神经发生,此外,MSCs可迁移至脑损伤区域并部分分化为神经元[17-18]。然而,大量研究认为MSCs通过免疫调控以及旁分泌作用进而调控炎症微环境、降低神经元变性丢失是促进缺血性脑卒中神经功能改善的主要机制[19]。
本研究选取炎症细胞因子TGF-β1、IL-10、TNF-α、IL-1β、IL-6、IFN-γ作为研究对象,以探究WJ-MSCs对脑缺血损伤小鼠神经炎症因子mRNA表达水平的影响。TGF-β1、IL-10是在脑缺血损伤中降低炎症反应的抗炎因子。TGF-β对体外培养的脂多糖激活的小胶质细胞具有持续的抗炎效果,并抑制小胶质细胞的活化,从而发挥免疫调控作用[20]。此外,TGF-β能够促进神经元抗凋亡因子基因表达,抑制神经元的凋亡[21]。IL-10可显著降低脑缺血后局部中性粒细胞的浸润,抑制TNF-α、IL-6以及IL-2等炎症因子的产生,减轻炎症反应,降低神经元的凋亡,进而减轻脑损伤[22]。TNF-α、IL-1β、IL-6、IFN-γ是在脑缺血损伤中促发炎症反应的促炎因子。TNF-α由巨噬细胞合成,其过度表达可导致中性粒细胞及淋巴细胞的激活并表达黏附因子,继而加重缺血脑组织损伤;IL-1β主要来源于胶质细胞、神经元和血管内皮细胞,其过度表达导致大量中性粒细胞进入中枢神经系统,释放有害炎性介质,进而加重脑损伤[23]。IL-6主要来源于活化的小胶质细胞,其可作为炎症生物标志物,对缺血性中风的临床诊断和预后监测具有重要意义[24]。IFN-γ由激活的胸腺来源的T细胞和NK细胞所分泌,其亦可加重炎症反应。本实验结果显示,抗炎细胞因子基因mRNA表达量显著提高(P<0.05),促炎细胞因子基因TNF-α、IL-1β、IL-6 mRNA表达量均受到明显抑制(P<0.05),IFN-γ的mRNA表达量有下降的趋势,但不显著,可能是出于样本量较少的原因。
小胶质细胞/巨噬细胞是防御脑缺血损伤的主要免疫细胞。脑缺血损伤后,激活的小胶质细胞和血源性单核细胞在病变区域中转变为巨噬细胞,发挥着免疫防御和免疫损伤的双重作用。小胶质细胞/巨噬细胞通常负责吞噬细胞碎片、清除死亡的神经细胞并释放营养因子,进而促进神经功能改善。然而,缺血性脑卒中触发的炎症级联反应使小胶质细胞/巨噬细胞激活、增殖,并产生TNF-α、IL-1β和IL-6等促炎细胞因子和ROS、iNOS、NO等神经毒性物质,进而损伤神经元,影响神经功能[25]。此外,2015年,Jolivel等[26]发现激活的小胶质细胞在脑缺血半暗带可通过吞噬作用直接吞噬内皮细胞,导致脑血管解体,血脑屏障破坏,从而进一步促使外周免疫细胞浸润,加重脑损伤。因此,小胶质细胞/巨噬细胞的过度活化在脑缺血损伤发生中起着重要的作用。既往的研究表明,间充质干细胞移植可调控小胶质细胞/巨噬细胞的激活并改善神经功能。Hocum-Stone等[27]的研究表明,人源脐带血干细胞治疗局灶性脑缺血模型可通过抑制小胶质细胞的激活并降低巨噬细胞浸润,从而降低脑梗死体积并改善神经功能。此外,Lin等[28]也证明了人源脐带间充质干细胞显著抑制了脑缺血损伤模型的小胶质细胞/巨噬细胞活化。与此相反的是,Yang等[29]发现,造模后1d静脉移植BMSC显著增加了梗死灶周围区的活化小胶质细胞数目。不同的细胞来源、不同的抗体标志物选择以及不同的研究手段可能是导致实验结果产生差异的原因。
综上所述,WJ-MSCs脑立体定位移植改善了MCAO/R小鼠神经功能并抑制了大脑神经炎症,然而潜在的免疫调控机制尚需深入研究。
