急性肺栓塞的诊疗策略
2020-10-29田红燕孟燕潘龙飞
田红燕,孟燕,潘龙飞
急性肺栓塞(acute pulmonary embolism,APE)是静脉血栓栓塞症(venous thromboembolism,VTE)最严重的临床表现,是仅次于心肌梗死和脑卒中的全球第三大急性心血管综合征,肺栓塞(pulmonary embolism,PE)的年发病率为39/10万~115/10万[1-2],是患者死亡、就医和住院的主要原因。但是目前APE缺乏统一、系统的诊疗规范,致使APE诊断率不高。本文通过对APE的诊断和治疗策略做一系统归纳和总结,旨在提高APE的诊断率和规范治疗率,以为广大读者和医务工作者提供诊断和治疗APE的具体思路。
1 APE概述
APE是VTE最严重的临床表现。而大部分PE可能无症状或者被偶然发现,甚至直接猝死,因此APE的流行病学资料准确性不高。但APE是患者死亡、就医和住院的主要原因。据2004年欧盟六国的统计资料显示,有317 000例患者因VTE死亡,其中,34%的患者突发致命性APE,而仅7%的患者在死亡前被确诊为APE[1-2]。
疑似APE患者早期危险分层是通过评估患者是否伴有休克或持续性低血压分为高危和非高危,对相关指南建议的诊断和治疗决策均有重要意义[2]。
APE常因临床表现无特异性而被漏诊,因此针对疑似APE者应尽快完善相关检查以确诊。而这些患者可能会表现为呼吸困难、胸痛、晕厥前兆或晕厥和/或咯血[3]。临床常用的APE量表包括Wells评分和修正的Geneva评分(见表1),其评估简便,并且已证实可以用来评估APE的临床可能性[4]。
急性血栓形成时因为凝血和纤溶系统同时被激活,血浆D-二聚体水平会升高,而D-二聚体诊断APE的阴性预测值较高[1-2]。当机体出现肿瘤、炎症、出血、创伤以及组织坏死或进行手术时,体内会产生纤维蛋白,导致D-二聚体水平升高,但却不能因此预测APE,因为D-二聚体诊断APE的阳性预测值不高[1-2]。研究显示,急诊科约30%的疑似APE患者通过D-二聚体检测阴性结合临床可能性评估可以排除APE,而不需要做进一步检查[2]。另外有研究表明,根据年龄界限调整的D-二聚体检测可以提高其对APE的诊断效能[5];一项荟萃分析结果表明,根据年龄调整的D-二聚体检测诊断APE的特异度由单独D-二聚体检测的34%提高到了46%,同时保持了>97%的灵敏度[6]。
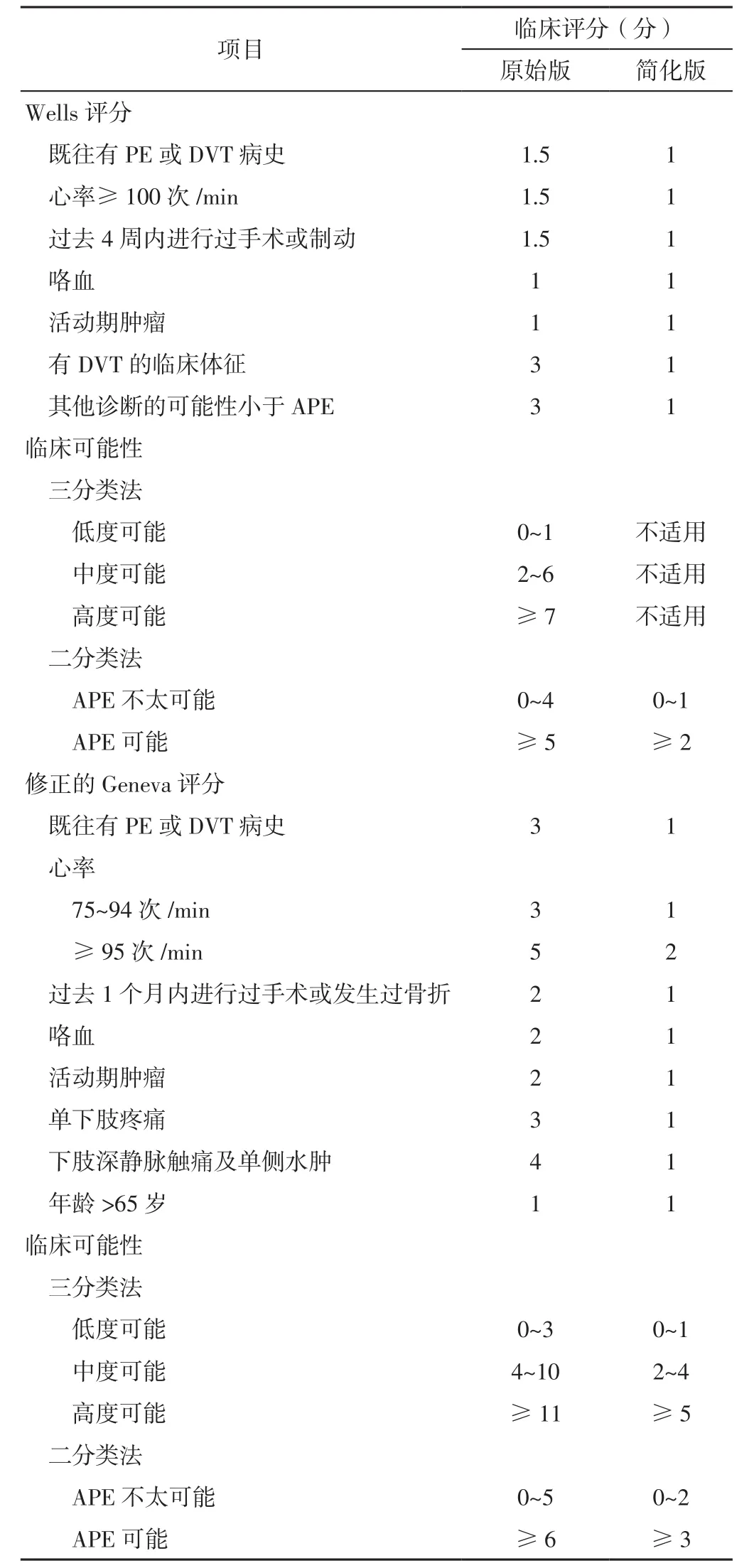
表1 Wells评分和修正的Geneva评分Table 1 The Wells score and the revised Geneva score
2 APE诊断策略
目前疑似APE患者的筛查确诊率较低,仅为10%~35%[7]。因此,使用诊断流程非常重要,而临床评估系统、血浆D-二聚体检测及影像学检查的联合运用被证实可以有效筛查出APE患者[1-2]。有研究者对急诊科、住院患者和初级护理部门中的疑似APE患者实施这些诊断策略后发现,患者抗凝治疗3个月后VTE复发率和心源性猝死率明显降低[8]。欧洲心脏病学会(European Society of Cardiology,ESC)分别于2014年和2019年给出了明确的APE诊断流程建议,详见图1~2[1-2]。
疑似高危APE患者可能会表现为危及生命的休克或低血压,需要与急性瓣膜病、心包填塞、急性冠脉综合征(ACS)以及主动脉夹层相鉴别。如果患者的血流动力学障碍与APE所致的急性肺动脉高压和右心功能障碍有关,则最有用的初步检查方式可能是床旁经胸超声心动图,一旦证据确凿,或者同时发现了右心血栓形成,则建议尽早给予系统溶栓治疗。当然,一旦患者通过支持治疗血流动力学稳定后,应该完成CT肺动脉造影(CT pulmonary angiography,CTPA)进行确诊。如果疑似ACS患者同时不能排除APE的可能,其一旦直接进入导管室进行造影检查排除ACS后,也可同时进行CTPA检查以评估有无APE或者同时进行经皮导管介入治疗。
对于没有休克或低血压的疑似非高危APE患者,CTPA是主要的确诊方式,但不是首选方式,因为大部分疑似APE患者可能不存在APE。对于急诊科患者,建议将D-二聚体检测联合临床可能性评估作为诊断APE的首选方式,因为可能有30%的患者可以通过这一方式被筛除,且其3个月内发生栓塞事件的风险<1%[2]。但是由于D-二聚体诊断APE的阴性预测值较低,若临床可能性评估显示高度可能或APE可能,则进行D-二聚体检测的必要性不大[2]。因而大多数医疗机构将CTPA作为D-二聚体检测阳性患者的第二检查方式,临床可能性评估显示高度可能或APE可能患者的首选检查。
疑似APE患者同时还应该进行下肢静脉加压超声检查。研究显示,30%~50%的APE患者可能合并下肢深静脉血栓,一旦发现近心端下肢深静脉血栓,应尽早启动抗凝治疗,尤其对于肾功能不全、造影剂过敏或妊娠等有CT血管造影(CTA)相对禁忌证的患者[7,9]。当然,对于拥有肺通气灌注扫描设备的医疗机构,下肢静脉加压超声检查在D-二聚体检测阳性和有CTA相对禁忌证的患者中也可作为首选检查方式,尤其是对于因CT射线检查可能增加乳腺癌风险的年轻女性患者。

图1 疑似高危APE患者的诊断流程Figure 1 Diagnostic process for patients with suspected high-risk APE
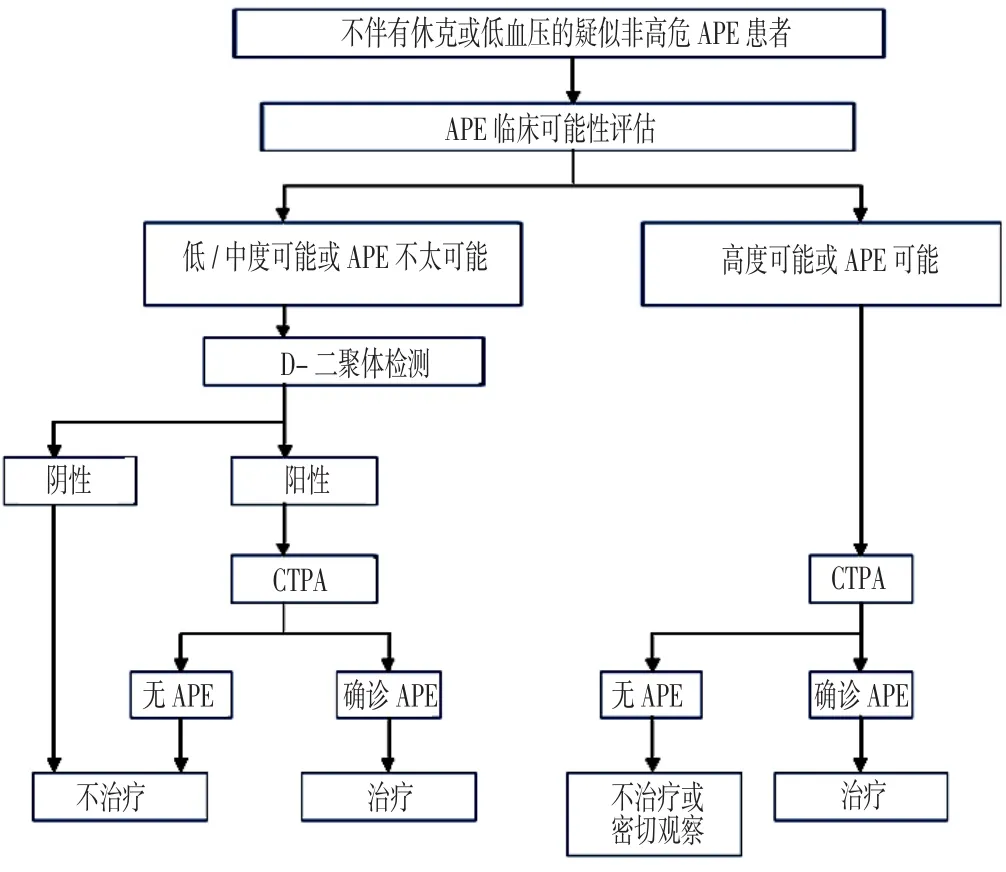
图2 疑似非高危APE患者的诊断流程Figure 2 Diagnostic process for patients with suspected not high-risk APE
当然也有越来越多的证据表明,可能存在APE的过度诊断[10]。来自美国的研究显示,CTPA使APE的表观发病率上升了80%,但对死亡率无明显影响[10]。有学者认为,通过CTA偶然发现的PE患者应该接受治疗,尤其是那些肿瘤合并近心端PE的患者,但是这种建议缺乏有效的证据支持[11]。目前看来,对于非创伤性胸痛患者,“胸痛三联”(针对冠状动脉疾病、APE和主动脉夹层)的CTA检查对冠状动脉疾病的排除相对准确,但考虑到目前发表的研究中APE和主动脉夹层的发生率不高(<1%),这种诊断方法的获益风险比(包括辐射增加和造影剂使用)仍需要充分评估[12]。
3 APE治疗策略
APE治疗策略详见图3。大多数APE患者可能没有血流动力学障碍,因此排除严重肾功能障碍后,根据体质量给药的低分子肝素或磺达肝癸钠可以作为首选治疗药物。无休克或低血压的患者在确诊APE后需要根据肺栓塞严重指数(PESI)分级或简化的肺栓塞严重指数(sPESI)评分、影像学检查和心肌损伤标志物检测进一步进行早期死亡风险分层,具体评估方法见表2。对于早期死亡风险为低危的患者,如果依从性好,应考虑早期出院和门诊治疗;对于其他早期死亡风险患者,应通过超声心动图(或CTA)检查和肌钙蛋白检测评估其右心功能。全身溶栓是死亡风险为高危APE患者首选的早期再灌注治疗方案;对于有溶栓禁忌证的患者以及溶栓不能改善血流动力学的患者,在有外科手术条件的医疗机构,建议进行外科手术取栓,在有条件进行介入治疗的医疗结构,经皮导管介入也可以作为另一种手术方式。当然,手术决策最好由包括胸外科和心脏介入等专家在内的多学科团队进行评估。足量系统溶栓治疗,作为早期再灌注的首选治疗方式,可以预防潜在的危及生命的血流动力学障碍,然而这一获益却被出血性脑卒中或大出血的高风险所抵消[13]。因此,对于早期死亡风险为中高危的APE患者,不建议将系统溶栓作为常规治疗,但如果出现血流动力学障碍的临床表现,则应予以考虑。对于极有可能出现血流动力学障碍并且系统溶栓预期出血风险较高的早期死亡风险为中高危的APE患者,外科手术取栓或经皮导管介入治疗可作为补救性替代治疗措施。对于早期死亡风险为中低危的患者,建议进行抗凝治疗,因为现有证据不支持早期再灌注治疗,并且没有证据表明卧床休息对这些患者有临床获益[1-2]。

图3 APE风险管理策略Figure 3 Risk management strategy in APE
3.1 稳定血流动力学治疗和呼吸支持治疗 急性右心衰竭所致的心排血量下降是早期死亡风险为高危的APE患者的主要死因,因此,稳定血流动力学治疗对其至关重要。研究表明,积极扩容治疗并不会使此类患者获益,反而会引起机械拉伸过度,或反射性抑制收缩,从而使右心室功能恶化;相反,适量(500 ml)的液体刺激可能有助于提高血压正常的APE患者的心排血量[2]。药物治疗、外科手术或介入再灌注治疗的同时(或等待特异性治疗期间),经常需要使用血管活性药物。去甲肾上腺素可通过直接正性肌力作用来改善患者的右心室功能,同时可通过刺激外周血管α受体和提高体循环压力来改善患者的冠状动脉血流,但其仅适用于伴有低血压的APE患者。不过,将心排血量过度提高可能会导致通气-灌注失调,因为该过程会将高阻血管的血流重新分配到低阻血管中。相对而言,肾上腺素则结合了去甲肾上腺素和多巴酚丁胺的优点,但却没有后者的全身血管舒张作用。因此,肾上腺素可能更适合出现休克的APE患者。血管扩张剂可降低肺动脉压和肺血管阻力,但给药后并不能特异性作用于肺血管系统。一项小型临床研究结果显示,吸入一氧化氮可改善APE患者的血流动力学和气体交换[14]。初步研究资料表明,左西孟旦可通过舒张肺血管和增强右心室收缩功能来恢复APE患者的右心室-肺动脉耦合[15]。
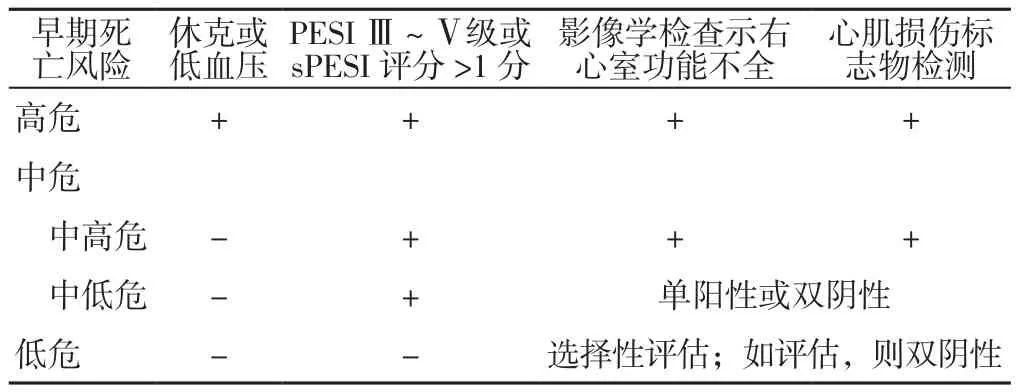
表2 APE患者早期死亡风险分层Table 2 Risk stratification of early death in APE patients

表3 静脉泵入普通肝素时APTT的监测与药物调整Table 3 APTT monitoring and drug adjustment during intravenous pumping of unfractionated heparin
低氧血症和低碳酸血症在APE患者中较为常见,且多数病情较轻,但当患者合并卵圆孔未闭时,其低氧血症症状会加重,尤其是右心房压超过左心房压者[2]。而机械通气引起的胸腔内正压可以减少APE患者的静脉血液回流,加重右心衰竭,因此应使用低潮气量(约6 ml/kg)进行机械通气治疗以保持吸气末压力<30 cm H2O(1 cm H2O=0.098 kPa)。此外,试验证据表明,体外膜肺对于早期死亡风险为高危的APE患者可能有效,但仅有个案报道[2]。
3.2 抗凝治疗 APE患者抗凝治疗的目的是预防早期死亡和复发性症状性或致命性VTE,抗凝治疗的标准时间为≥3个月[1-2]。APE患者抗凝治疗前5~10 d建议给予肠外抗凝剂(包括普通肝素、低分子肝素或磺达肝癸钠)[1-2]。后期如选择维生素K拮抗剂(VKA)作为后续抗凝剂,VKA可与肠外抗凝剂重叠使用;如选择直接口服抗凝药物如达比加群或依度沙班,则需要桥接肠外抗凝剂使用;如果选择利伐沙班或阿哌沙班进行抗凝治疗,则直接口服治疗或使用肠外抗凝剂1~2 d后开始口服治疗[1-2];如果直接使用利伐沙班或阿哌沙班进行抗凝治疗,则需要在利伐沙班初始使用的前3周或阿哌沙班初始使用的前7 d给予负荷剂量[1-2]。在某些情况下,抗凝治疗超过3个月或者无限期抗凝,可能是为了预防血栓再次形成,这时需要权衡血栓再次形成与出血的风险[1-2]。
3.2.1 肠外抗凝治疗 临床可能性评估为高度或中度可能的APE患者在等待确诊性检查结果的同时,应启动肠外抗凝治疗,可静脉注射普通肝素、皮下注射低分子肝素或皮下注射磺达肝癸钠,更建议选择低分子肝素或磺达肝癸钠,因为其具有较低的大出血和肝素诱导的血小板减少症风险[16]。但普通肝素更适用于需要早期再灌注治疗的患者,或者严重肾功能损伤(肌酐清除率<30 ml/min)或严重肥胖的患者,因为其t1/2短,易于监测,可以被鱼精蛋白迅速逆转[2]。采用普通肝素进行治疗时需要监测活化部分凝血活酶时间(APTT)(见表3)。低分子肝素用量建议见表4。
采用低分子肝素进行治疗时不需要常规监测凝血指标,但孕产妇应考虑在妊娠期间定期监测抗Ⅹa因子活性(抗Ⅹa水平)[2]。抗Ⅹa因子活性的峰值应在最后1次注射低分子肝素4 h后测量,而低谷值应在下次注射低分子肝素前4 h测量[11]。
磺达肝癸钠是一种选择性Ⅹa因子抑制剂,每日皮下注射1次,按患者体质量调整剂量,无需监测凝血指标;严重肾功能不全(肌酐清除率<30 ml/min)患者禁用磺达肝癸钠,因为药物累积会增加出血的风险;中度肾功能不全(肌酐清除率为30~50 ml/min)患者也会因为药物累积增加出血的风险,因此,对于这些患者磺达肝癸钠的剂量应减少50%[17]。
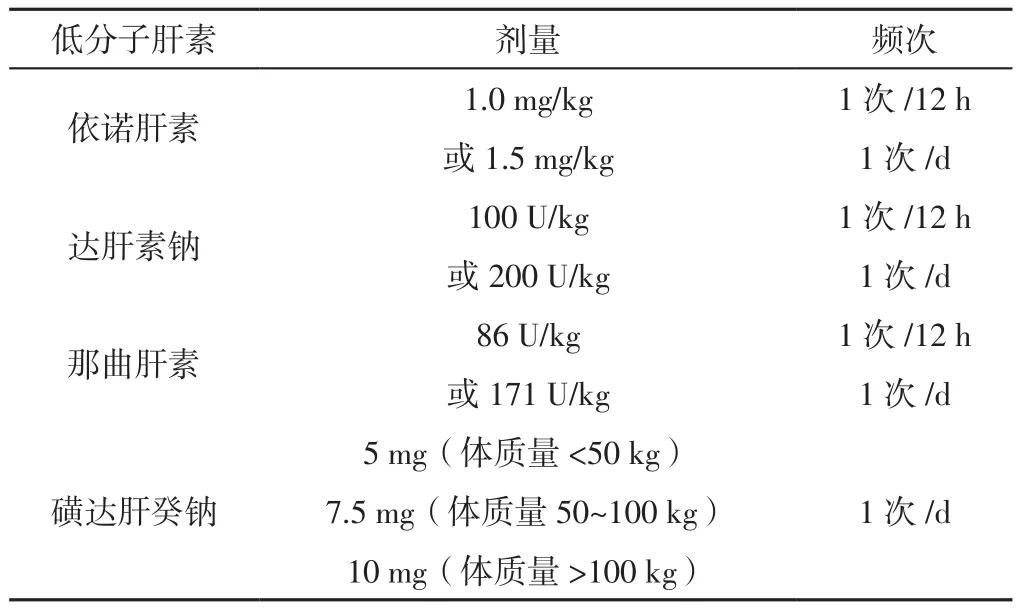
表4 低分子肝素用量建议Table 4 Low molecular weight heparin dosage recommendations
3.2.2 VKA 对于APE患者,口服抗凝剂治疗最好与肠外抗凝治疗同时开始。近50多年来,VKA一直是口服抗凝治疗的“金标准”,其中华法林、阿西诺香醇、菲普罗克素、菲尼酮和氟尼酮仍是APE患者的主要口服抗凝药[18]。对于APE患者,VKA与普通肝素、低分子肝素或磺达肝癸钠至少重叠使用5 d,直到国际标准化比值(INR)连续2 d为2.0~3.0,则可单独使用华法林[11]。华法林可在<60岁或其他健康门诊患者中以10 mg剂量起始,在高龄和住院患者中以5 mg剂量起始,每日剂量根据未来5~7 d的INR进行调整,目标水平为INR处于2.0~3.0[11]。有研究表明,根据药物遗传学检测结合基因型和临床数据可以推荐华法林的剂量[19-20]。但是,药物遗传学检测好像并未提高VKA的用药质量,根据患者的临床数据给药可能优于固定负荷剂量,要把重点放在改善抗凝治疗的基础设施建设上,如优化INR检测与向患者提供反馈以及个体化剂量调整的流程[21]。
3.2.3 直接口服抗凝剂(DOAC) 使用DOAC治疗VTE的试验结果表明,这些药物的疗效并非劣效于标准肝素/VKA,而且可能更安全(尤其是在大出血方面)[22]。目前,DOAC可作为VTE的标准治疗的替代方案,且欧盟已批准利伐沙班、达比加群和阿哌沙班用于VTE的治疗[1-2]。欧洲心律协会(European Heart Rhythm Association)发表了在不同临床情况下DOAC的应用和出血并发症处理的实用性建议[23]。DOAC在新的美国胸科医师学会(ACCP)指南中的地位较以往有所提高,且优于VKA,其具体用法及代谢特点见表5[24]。

表5 DOAC在APE患者抗凝治疗中的用法及其代谢特点Table 5 The use and metabolic characteristics of DOAC in anticoagulation therapy for APE patients

表6 APE患者溶栓治疗方案Table 6 Thrombolytic therapy for APE patients

表7 溶栓治疗禁忌证Table 7 Contraindications for thrombolytic therapy
3.3 溶栓治疗 APE患者的溶栓治疗较单纯普通肝素抗凝治疗能更迅速地恢复肺动脉灌注。而早期开通阻塞的肺动脉可迅速降低患者肺动脉压,同时改善其右心室功能。但APE患者溶栓治疗的血流动力学获益仅限于最初几天,治疗1周后,获益不大[1-2]。
建议对于合并低血压(即收缩压<90 mm Hg,持续15 min以上)且无溶栓治疗禁忌证的APE患者,采用溶栓治疗[24]。APE患者低血压越严重、持续时间越长,其休克与心肌损伤的相关特征越明显,则系统溶栓治疗的指征越明显;反之,如果APE患者低血压短暂或不明显,没有休克或心肌损伤的特征,但有出血的危险因素,则其更倾向于选择初始抗凝治疗而不是系统溶栓治疗。如果APE患者不进行系统溶栓治疗,而其低血压持续存在或变得更明显,或休克、心肌损伤的临床特征进展或恶化,则可启动系统溶栓治疗。APE患者溶栓治疗方案见表6,溶栓治疗禁忌证见表7[1-2]。对于APE患者,推荐采用2 h溶栓治疗方案,而不建议第一代溶栓药所使用的12~24 h方案[13]。瑞替普酶和去氨普酶在改善APE患者血流动力学参数方面与重组组织型纤溶酶原激活剂(rt-PA)类似,但目前上述药物均未被推荐用于APE患者的治疗[13,25]。
从36 h内临床和超声心动图指标改善情况来看,90%的APE患者对溶栓治疗反应良好,而最大的获益时间是症状出现后48 h内,当然对于症状持续6~14 d的患者,溶栓治疗仍然是有用的[2]。对于危及生命的早期死亡风险为高危的APE患者而言,大多数溶栓治疗禁忌证是相对的;而对于没有血流动力学障碍的患者,溶栓治疗的临床获益尚存在争议[13]。试验数据汇总分析显示,接受溶栓治疗的APE患者颅内出血发生率为1.9%~2.2%,且其与年龄增长和合并症有关[13]。一项包括121例早期死亡风险为中危的APE患者和另一项包括118例伴有血流动力学不稳定或严重肺栓塞的APE患者的试验结果均表明,APE患者使用减少剂量的rt-PA进行治疗是安全的[2]。对于右心活动性血栓患者,溶栓治疗的效果仍存在争议,在一些系列报道中患者有良好结局,但在其他报道中,溶栓治疗后患者短期病死率仍超过20%[2]。
3.4 外科血栓切除术 血栓切除术历史悠久,技术成熟,可用于早期死亡风险为高危的APE患者或部分早期死亡风险为中高危的APE患者,特别是有溶栓治疗禁忌证或溶栓治疗失败的患者[2]。
3.5 介入治疗 介入治疗是通过导管介导的治疗方式,对肺动脉血栓进行清除治疗,其目的是清除主肺动脉的血栓,以恢复APE患者右心室功能,改善患者胸痛、气促等症状,提高存活率。介入治疗适用于同时具备下述情况的伴有低血压的APE患者:(1)出血风险高;(2)系统溶栓治疗失败;(3)在系统溶栓治疗起效前(如在数小时内)发生可能导致死亡的休克。APE的介入治疗包括在出血风险不高的情况下给予导管介导的溶栓治疗,或在出血风险高的情况下给予不溶栓的导管介入治疗。对于有绝对溶栓治疗禁忌证的APE患者来说,介入治疗的方式包括:(1)猪尾导管或球囊导管碎栓术;(2)应用流体力学装置进行的血栓消融术;(3)血栓抽吸术;(4)血栓旋切术。而对于无绝对溶栓治疗禁忌证的APE患者,导管介导的溶栓治疗或机械联合药物溶栓治疗可作为选择。研究显示,低剂量导管介导的溶栓治疗后早期APE患者右心室功能恢复的程度与标准剂量全身溶栓治疗后相似[24]。系统溶栓治疗最重要的限制是增加了出血的风险,包括颅内出血。由于导管介导的介入治疗使用较低剂量的溶栓药物(溶栓药物用量约为系统溶栓药物用量的1/3),因此偏远部位(如颅内、胃肠道)出血风险较低。然而,介入治疗较系统溶栓治疗APE患者更有效的原因可能为:(1)将药物直接注入肺动脉使局部溶栓药物的浓度较高;(2)血栓捣碎后局部导管注入的药物增加,渗透率增加,由此增强内源性或药物溶栓的力度。观察性研究也表明,导管介入治疗可以有效地清除APE患者的肺动脉血栓,降低肺动脉压,改善右心室功能,且并不会增加大出血发生风险[24]。目前将导管介导的溶栓治疗与系统溶栓治疗进行比较的随机试验或观察性研究较少,对于需要溶栓治疗且出血风险不高的患者,第10版美国胸科医师学会静脉血栓栓塞症治疗指南(ACCP 10)更倾向于系统溶栓治疗而非导管介入溶栓治疗,因为与单纯抗凝治疗相比,支持系统溶栓治疗的证据更多[24]。
3.6 腔静脉滤器植入术 腔静脉滤器植入术适用于有绝对抗凝治疗禁忌证的APE患者和尽管充分抗凝治疗但仍有客观证据证实PE复发的患者。观察性研究表明,腔静脉滤器的植入可能会减少APE患者病死率,但可增加VTE复发风险[1-2]。约10%行腔静脉滤器植入术的患者术后会出现包括滤器内血栓在内的早期并发症,晚期并发症更为常见,约20%的患者出现DVT复发,高达40%的患者出现血栓后综合征[2]。无论患者是否使用了抗凝药,或者抗凝药持续使用了多久,其5年和9年发生腔静脉滤器堵塞的比例分别为22%和33%[2]。因此,植入非永久性滤器时,建议在抗凝治疗的情况下尽早取出滤器。而对于可以标准抗凝治疗的患者,并不建议常规使用腔静脉滤器[24]。
4 特殊类型APE
4.1 妊娠相关APE APE是孕产妇死亡的主要原因,且孕产妇分娩后患APE的风险较高,尤其是剖宫产者。虽然妊娠期疑似APE的孕妇有可能在行影像学检查确诊的过程中使胎儿暴露于电离辐射,但是这种担忧有可能会遗漏高危APE患者。同时,如果妊娠期间因无法确诊而被误诊为APE也会增加孕妇和胎儿因抗凝治疗带来的出血风险以及对分娩过程的影响。因此,提高诊断的确定性十分必要。
由于D-二聚体水平可能在整个妊娠期均是升高的,因此通过D-二聚体是否升高来评估孕妇是否患有APE的作用有限。因此相关的前瞻性研究正在获得更多的关于D-二聚体阈值的证据,后期有可能通过不同的D-二聚体检测方法来提高D-二聚体对疑似APE孕妇的诊断准确性,同时结合下肢静脉加压超声检查,一旦发现超声检查结果为阳性(即通过下肢静脉超声明确存在下肢深静脉血栓),即可开始启动抗凝治疗[4]。妊娠期确诊APE者可优先选择肺灌注显像,以减少电离辐射对胎儿的影响。
由于肝素不会通过胎盘屏障,在乳汁中分泌量也很少,因此围生期APE的治疗以肝素或普通肝素抗凝治疗为主[26]。体质量较大或肾功能异常的产妇在使用低分子肝素时可以根据抗Ⅹa活性来调整剂量。低分子肝素要在实施硬膜外镇痛前至少停用12 h,拔除硬膜外导管12~24 h后才可恢复使用。分娩后可以口服VKA进行抗凝治疗,至少6周,总体治疗时间为3个月[24]。除非情况危急,围生期尽量避免进行溶栓治疗。
4.2 肿瘤相关APE 癌症患者发生VTE的总体风险是普通人群的4倍[27]。癌症患者术后发生VTE的风险尤其高,因此需要保持持续的警惕性。首先,D-二聚体阴性仍然具有较高的排除APE的价值,若有条件进行根据年龄调整的D-二聚体检测,可进一步提高APE诊断的正确率。其次,由于目前CTA检查的广泛应用,会在癌症患者中发现越来越多的无症状性PE,考虑到癌症患者PE的高风险性,建议这部分患者也接受专科医生的评估,以给予合适的抗凝治疗[2]。
癌症患者合并APE时,应首选低分子肝素进行抗凝治疗,且至少持续3~6个月,并定期评估出血风险-抗凝治疗获益比[28]。约有10%不明原因的PE患者可能在未来5~10年内确诊为癌症,且大多数患者发生在PE确诊后的前1~2年[28]。有学者建议,盆腔和腹部CT结合乳腺X线检查和痰细胞学检查是对此类患者最有效、危害最小的筛查策略[28]。然而,如此广泛的筛查策略与基本的临床评估相比,患者在5年生存率方面并无获益[28]。
5 小结
综上所述,APE尤其是早期死亡风险为高危和中高危的患者,病情凶险、病死率高,因此要求医务工作者尽快做出及时、正确的诊断,并给予合适的治疗,以降低病死率。本文根据2014年和2019年ESC急性肺栓塞指南[1-2]建议的诊断流程、危险分层及治疗策略对APE做了系统综述,临床医务工作者可以根据本文提及的诊断流程和治疗策略快速地对APE做出及时、正确的判断,同时参考本文中APE的可能病因进一步追查。另外,值得注意的是,在求因的过程中,应确保患者接受足疗程的抗凝治疗,并且对于具备溶栓治疗指征的早期死亡风险为高危的APE患者应积极采取合理的溶栓治疗。
作者贡献:田红燕、孟燕进行文章的构思与设计,撰写论文,对文章整体负责、监督管理;田红燕、孟燕、潘龙飞进行文献/资料收集;孟燕、潘龙飞进行文献/资料整理、论文的修订,负责文章的质量控制及审校;孟燕进行英文的修订。
本文无利益冲突。
本文文献检索策略:
检索数据库:万方数据知识服务平台、中国知网、Web of Science、PubMed;检索年限:2005—2020年;检索词:肺栓塞、静脉血栓栓塞症、深静脉血栓、血栓、D-二聚体、溶栓、抗凝及上述检索词的对应英文;检索方法:布尔逻辑检索。
