HPLC-MS/MS法检测福建中部海域养殖贝类麻痹性贝类毒素
2020-10-28杨云辉
杨云辉
(福建省渔业资源监测中心,福建 福州 350003)
作者简介:杨云辉(1987-),男,助理工程师,研究方向:水产品质量安全.E-mail:492836730@qq.com
近年来,受气候变化和陆源污染等因素影响,有毒赤潮在全球范围内呈逐年增加的趋势[1]。当海洋中的贝类大量滤食这些有毒藻类时,毒素便会在贝类体内积累和放大并转化为贝类毒素[2]。这种毒素可能对贝类本身不带来伤害,却可以通过食物链在人体中得以释放,使食用者产生相应的中毒症状,危害人体健康,甚至威胁生命安全。其中麻痹性贝类毒素(Paralytic shellfish toxins,PSTs)在每年全球由贝类毒素引起的中毒事件中所占的比例达87%,是全球分布最广、事故发生率最高、危害程度最大的一类毒素[3]。
福建沿海作为我国赤潮高发区之一,仅2012年至2018年7月就发生赤潮56起,其中有毒赤潮19起[4]。2017年6月,福建南部到中部沿海发现有毒赤潮,多个地区在贝类中检出麻痹性贝类毒素,多人因误食这些带PST毒素的贝类中毒而就医。频频发生的贝类毒素中毒事件,不仅影响了海水贝类产业,还带来了十分严峻的食品安全问题。为避免含有染毒贝类流入市场,在有毒赤潮高发期,对沿海各地的贝类毒素进行快速有效的筛查尤为必要。
HPLC-MS/MS法作为最具潜力的检测技术,目前在海洋生物毒素的检测分析领域已表现出明显的优势[5]。该方法几乎可以分析检测目前已确定化学结构的贝类毒素,并且可对目标毒素进行单独筛选和检测,分析速度快、灵敏度高,具有很好的重现性[6-10]。本实验使用高效液相色谱串联质谱仪(串联三重四极杆质谱仪)对2017—2018年期间从福建沿海各地采集的60批次不同品种的贝类进行PST毒素定量分析检测,分离鉴定8种PST毒素,为福建省沿海麻痹性贝类毒素成分研究以及今后的风险评估工作积累基础数据。
1 材料与方法
1.1 实验样品
2017年5月至2018年7月于福建中部海域各养殖区采集的牡蛎、贻贝、缢蛏、菲律宾蛤仔等样品,共计60批次(-20℃冷冻保存),如表1所示。

表1 样品分布情况Tab.1 The distribution of the sample 单位:批次Unit:batch
1.2 仪器与试剂
Triple Quad 5500液相色谱-串联质谱仪(美国AB SCIEX 公司);Genius ABN2ZA氮气发生器(英国Peak公司);3-30K高速离心机(德国Sigma 公司);N-EVAP-24氮吹仪(美国0rganomation公司);Milli-Q Integral 5超纯水一体化智能系统(美国 Millipore公司);SL-502N分析天平(上海民桥精密科学仪器有限公司);KQ-600DB数控超声波清洗器(昆山市超声仪器有限公司);MS3 DS25涡旋振荡器(德国IKA 公司)等。
甲酸(色谱纯美国TEDIA 公司);乙腈(色谱纯德国MERCK 公司);乙酸乙酯(色谱纯 MERCK 公司);三氯甲烷(分析纯国药集团化学试剂有限公司);甲醇(谱纯MERCK公司);GTX1/4标准溶液(24.8 μg/mL & 8.1 μg/mL上海安谱科学仪器有限公司);GTX2/3标准溶液(45.2 μg/mL & 17.2 μg/mL上海安谱);dcGTX2/3标准溶液(40.9 μg/mL & 9.2 μg/mL上海安谱);GTX5标准溶液(21.1 μg/mL上海安谱);STX标准溶液(24.7 μg/mL上海安谱);dcSTX标准溶液(21.4 μg/mL上海安谱)。
1.3 实验材料
HLB固相萃取柱(美国Waters公司):3 mL/60 mg,使用前依次用6 mL甲醇、6 mL水和6 mL甲酸溶液(0.5%)活化。
1.4 实验方法
实验采用高效液相色谱质谱串联法检测PSTs。
1.4.1 提取
称取5 g试样,置于50 mL塑料离心管中,加入5 mL甲酸溶液(0.5%),3 000 r/min涡旋1 min,超声提取5 min,10 000 r/min离心10 min,移出上清液,残渣再加入4.5 mL甲酸溶液(0.5%)重复提取两次,合并3次上清液加甲酸溶液(0.5%)定容至15 mL(参照“GB 5009.213—2016《食品安全国家标准 贝类中麻痹性贝类毒素的测定》”方法)。
1.4.2 净化
提取液中加入20 mL乙酸乙酯,涡旋混匀30 s,10 000 r/min离心10 min,弃去上层溶液;加入20 mL三氯甲烷,3 000 r/min涡旋混匀30 s,10 000 r/min离心10 min;取3 mL上层溶液加入已活化的固相萃取柱中(1滴/s),收集流出液至刻度离心管,再加入1 mL甲酸溶液(0.5%),收集流出液至3.5 mL;加入4.5 mL乙腈,混匀后放置5 min,10 000 r/min离心10 min,取上清液超滤膜过滤供HPLC-MS/MS仪器分析,所得1 mL滤液相当于0.125 g样品。
1.4.3 液相色谱条件
色谱柱:HILIC-A柱,柱长50 mm,内径2.1 mm,粒径3 μm;
流动相:流动相A为甲酸溶液(0.1%),流动相B为乙腈(Acetonitrile),梯度洗脱条件见表2;

表2 流动性梯度洗脱条件Tab.2 Gradient elution conditions
柱温:30℃;进样量:2.0 μL。
1.4.4 质谱分析条件
离子源:电喷雾离子源(ESI);
扫描方式:正离子扫描;
监测方式:多反映监测模式,麻痹性贝类毒素的母离子、子离子和碰撞能量见表3;

表3 PSTs监测离子及碰撞能量Tab.3 The monitoring ion and collision energy of PSTs
电喷雾电压:5 500 V;
离子源温度:500℃;
气帘气压力:35.0 psi;
碰撞气压力:7 psi;
雾化气压力GS1:50.0 psi;
辅助加热气压力GS2:50.0 psi。
2 结果
2.1 分析性能的研究
2.1.1 离子色谱图
由于PSTs结构与极性相近,出峰时间较为集中,几种PSTs均在1.85~1.92 min时间内出峰,如图1所示。其中GTX1/4、GTX2/3以及dcGTX2/3毒素又互为同分异构体,极性差异性小,实验过程中未能很好地分离,未能分开定量,所以测定时对这3组PST毒素进行加和计算。
2.1.2 标准曲线
由于贝类样品的基质较为复杂,为减少基质中其他杂质的干扰,减小影响,采用空白贻贝配制混合标准基质液,绘制基质匹配标准曲线。选用不含麻痹性贝类毒素的贻贝,按照与检测样品相同的操作步骤,得到空白贻贝基质液,并分别加入混合标准中间液,配制浓度梯度(以STX计)为10、20、40、50、100、200 ng/mL的混合标准工作液。以各目标化合物的质量溶度为横坐标(x),定量离子的峰面积为纵坐标(y),进行线性回归分析。各PSTs基质线性范围、线性方程及相关系数见表4。结果显示,在10.0~200.0 ng/mL范围内各麻痹性贝类毒素的线性关系良好,相关系数R2均大于0.997。
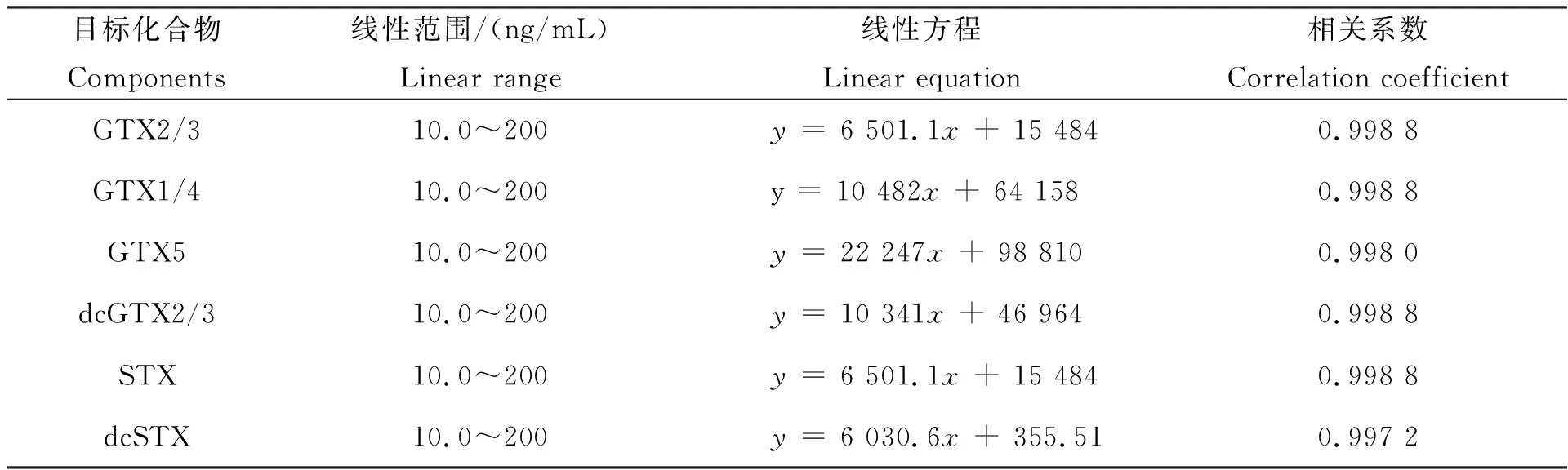
表4 PSTs线性范围、线性方程及相关系数Tab.4 The liner range,linear equation and correlation coefficient of PSTs
2.1.3 回收率、精密度和检出限
在空白样品中,加入PST毒素标准溶液,每个添加水平平行测试6次。实验结果表明,9种PST毒素的平均回收率在78.9%~89.7%之间,相对标准偏差(RSD)在1.5%~9.5%之间,方法的稳定性和准确度满足微分分析的要求。根据信噪比(S/N≥3)计算各目标化合物检出限,以信噪比(S/N≥10)计算各目标化合物定量限,测定计算结果见表5。

表5 贝类基质中添加PSTs的回收率和精密度(n=6)Tab.5 The recovery rate and precision of PST added in to the substrate of shellfish(n=6)
2.2 PSTs毒素检测结果
实验通过HPLC-MS/MS法检测4类60批次贝类样品中,检出PSTs毒素的样品17批次(检测结果见表6),均为2017年采集的贝类样品,其中:牡蛎4批次、贻贝13批次,缢蛏和蛤类样品均未检出;2018年采集的贝类样品均未检出PSTs毒素。检测的9种目标化合物中:dcSTX毒素检出频次最高,在17批次样品中检出,其中2批次小于定量限;检出GTX1/4毒素的样品5批次,均小于定量限;检出GTX2/3毒素的样品2批次,其中1批次小于定量限;检出GTX5毒素的样品4批次;检出dcGTX2/3毒素的样品3批次,其中2批次小于定量限;STX毒素均未检出。
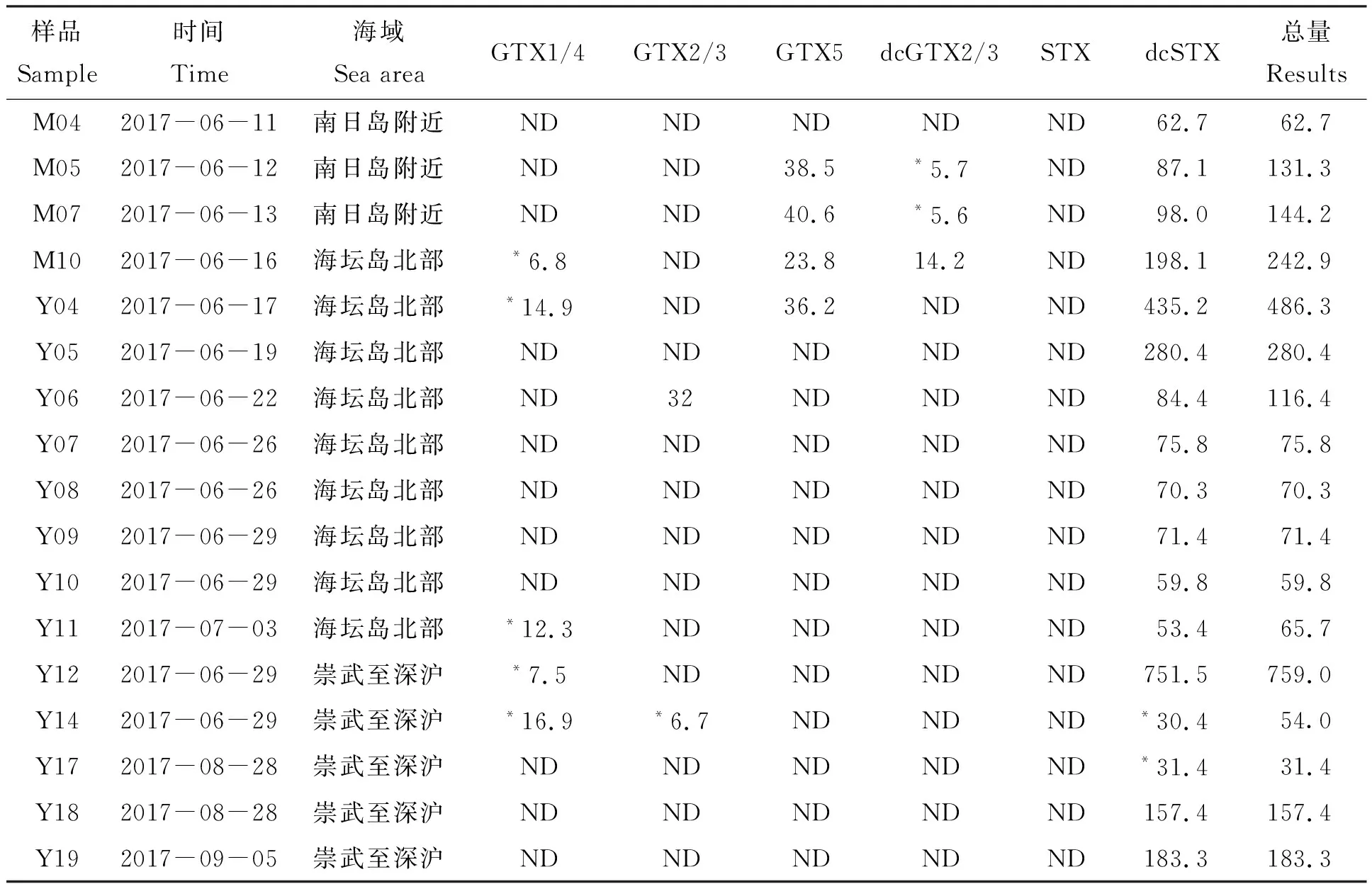
表6 阳性样品PSTs含量Tab.6 The results of PSTs from positive samples μg/kg
3 讨论
3.1 福建海域PSTs毒素的主要构成
结果显示,2017年福建中部海域贝类养殖区麻痹性贝类毒素主要成分为脱氨甲酰基石房蛤毒素(dcSTX、100%)、膝沟藻毒素(GTX1/4、29.4%)、膝沟藻毒素(GTX5、23.5%)、脱氨甲酰基膝沟藻毒素(dcGTX2/3、17.6%)、膝沟藻毒素(GTX2/3、11.8%),尚未发现石房蛤毒素(STX);不同养殖区间的贝类毒素成分和含量虽有差异,但大体上比较相似。牡蛎体中PSTs的主要成分有dcSTX、dcGTX2/3、GTX5、GTX1/4,贻贝体中PSTs的主要成分为dcSTX、dcGTX2/3、GTX5、GTX1/4、GTX2/3,由于牡蛎和贻贝生长环境相似,其PST毒素成分差异性不大。
与其他一些学者的研究结果相吻合,如王旭峰等[11]在深圳大鹏澳海域的翡翠贻贝中检出GTX2、GTX3、GTX5、dcGTX2、dcGTX3、NEO、C1和C2等8种毒素;张卓[12]等在深圳大鹏澳海域牡蛎中检出dcSTX、GTX1、GTX4、GTX5、dcGTX2、dcGTX3、NEO、C1和C2等9种,未检出STX。
3.2 麻痹性贝类毒素的来源
本次实验中检测出PSTs贝毒的贝类样品均采自2017年6—9月福建省中部海域,根据相关报道[13],2017年6月在福建省泉州海域发生链状裸甲藻赤潮,同时在莆田和平潭海域也检测出低密度链状裸甲藻,相关贝类质量安全监管跟踪监测显示,直至9月5日泉州海域养殖贝类才连续2周未检出PSTs贝毒。链状裸甲藻赤潮发生时间以及PSTs贝毒监测结果与本实验样品采集时间和检测结果相似,由此推测2017年养殖贝类样品中所检测出的麻痹性贝毒可能来自于2017年在福建省中部海域发生的链状裸甲藻赤潮。相关研究表明,链状裸甲藻可产生PSTs毒素[14-16],其主要产毒成分为C1、C2、GTX5、dcGTX2、dcGTX 3和dcSTX[17-18]。本次实验检测出的麻痹性贝毒主要成分为dcSTX、GTX1、GTX2、GTX3、GTX4、GTX5、dcGTX2和dcGTX3,与链状裸甲藻产毒成分相似。同时贝类对藻类有滤食作用,可在体内富集藻类毒素,因此链状裸甲藻应是2017年福建中部海域麻痹性贝类毒素的主要影响因素。
3.3 不同贝类PSTs的差异
2017年样品中牡蛎和贻贝检测出PSTs贝毒,但缢蛏和蛤类样品中未检出。可见不同贝类对于PSTs毒素的富集作用不同。南日岛附近海域于2017年6月11日发现链状裸甲藻,最高细胞密度1.4×105个/L,养殖区牡蛎体内PSTs毒素由62.7 μg/kg(第1天)→ 131.3 μg/kg(第2天)→ 144.2 μg/kg(第3天)→ ND(第4天)→ ND(第5天)。说明牡蛎能第一时间将周边环境中链状裸甲藻滤食进体内,体内PSTs毒素开始富集,随着环境中链状裸甲藻密度降低,体内PSTs毒素富集趋势减缓,开始被迅速消解。而海坛岛北部海域于2017年6月15日检出有低密度的链状裸甲藻,最高细胞密度为3.3×103个/L,养殖区贻贝体内PSTs毒素由486.3 μg/kg(第3天)→280.4 μg/kg(第5天)→116.4 μg/kg(第8天)→73.1 μg/kg(第12天均值)→65.6 μg/kg(第15天均值)→65.7 μg/kg(第19天)。说明随着时间推移,贻贝体内PSTs毒素含量逐渐降低,但相比牡蛎,贻贝对PSTs毒素的消解能力较弱。由此可见不同贝类对PST毒素的消解能力具有明显的差异。崇武至深沪海域于2017年6月6日发现链状裸甲藻赤潮(赤潮基准密度:5×105个/L),最高细胞密度1.79×106个/L,最大影响面积13.2 km2,于6月13日消退,链状裸甲藻爆发持续时间超过12 d。直至2017年9月5日,崇武至深沪海域养殖贻贝体内仍能检出较大量的PSTs毒素(183.3 μg/kg)。对比海坛岛贻贝实验结果发现,海域中链状裸甲藻密度越高、赤潮持续时间越长,对养殖贝类的影响越大,麻痹性贝类毒素在贝类体中存在的时间越久,对贻贝食用安全的风险也越大。
