斯钙素1在肾细胞癌患者外周血清中的表达及临床意义
2020-10-27苏世强杨翠霞
苏世强,张 晋,杜 泓,陈 延,杨翠霞,李 珅
(1.河北省石家庄市人民医院泌尿外科,河北 石家庄 050011;2.中国人民解放军联勤保障部队第980医院麻醉科,河北 石家庄 050082)
肾细胞癌(renal cell carcinoma,RCC)是起源于肾实质的恶性肿瘤,简称肾癌。近年来RCC发病率逐年上升。RCC早期多无症状,近年来随着健康体检的逐渐普及,其检出率不断升高,但仍有近1/3RCC患者在初次就诊时肿瘤已经远处转移[1]。目前,临床上尚无便捷有效地评估RCC患者治疗预后的生物标记物。斯钙素( stanniocalcin,STC) 是一类糖蛋白激素,人类STC家族分为STC1和STC2[2],STC参与机体代谢、炎症及肿瘤的发生发展等病理生理过程,Meyer等[3]研究发现RCC患者STC2高表达,并与肿瘤侵袭力性及不良预后密切相关,因而认为STC2可以作为判断肾切除术后RCC患者预后的肿瘤标志物。目前关于外周血清STC1在RCC判断其预后的文献鲜有报道。本研究旨在通过检测RCC患者外周血清中STC1基因和蛋白水平的表达差异,结合RCC患者临床病理参数和预后生存情况,初步探讨血清中STC1表达异常在判断RCC患者预后方面的临床意义。
1 资料与方法
1.1一般资料 收集2014年6月—2015年6月河北省石家庄市人民医院泌尿外科初次行手术且术后病理确诊的50例RCC患者(试验组)。所有患者术前临床病理及影像资料完整,术后进行规范的随访。50例RCC患者中,男性28例,女性22例;年龄40~79岁,中位年龄55岁。临床分期按照第8版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)肾癌分期和2017年TNM分期系统,收集同期正常人群血清50例作为对照组,男性27例,女性23例;年龄41~78岁,中位年龄54岁。2组患者性别、年龄差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会审核通过,患者知情同意书并签署知情同意书。
1.2实时荧光定量-聚合酶链反应(real-time polymerase chain reaction,Real-time PCR) 采集RCC患者术前清晨空腹外周血6 mL(3 mL 提取RNA,3 mL 提取血清),同时采集健康体检者清晨空腹外周血6 mL,采用乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)抗凝,室温静置30 min,2 500 r/min离心10 min,然后吸取上清液备用。冻存在-80 ℃冰箱中。用Trizol试剂(Invitrogen,Carlsbad,CA)提取血清中的总RNA,引物合成序列(见表1)按照说明书,经一步RT-PCR试剂盒(全式金,北京)逆转录到cDNA上。采用SYBRGreen染料法进行实时定量PCR(ABI 7500,美国应用生物系统公司)。每个样本设3个复管,目的基因和β-actin基因在同一反应条件下进行,同时设立阴性对照。使用Roto Gene 3000软件手动操作,计算CT值,以2-△△Ct法计算2组基因表达水平差异[4]。反应体系为:SYBR Green(2X) 10 μL,正向引物0.25 μmol/L,反向引物 0.25 μmol/L,cDNA模板 1 μL,无核酸蒸馏水至20 μL。反应条件:94 ℃ 1 min,94 ℃ 5 s,60 ℃ 34 s,40个循环。

表1 引物合成序列Table 1 Primer synthesis sequence
1.3酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测 采用 ELISA 法检测血清中 STC1的蛋白含量:参照试剂说明书加样于反应孔中后37 ℃孵育 1 h,洗板,每微孔先滴入底物Ⅰ 50 μL,再滴入底物Ⅱ 50 μL,混匀,避光反应15 min,然后滴入终止液,每孔50 μL,混匀,使反应终止;30 min 内进行检测,酶标仪设为450 nm,记录各微孔的吸光度值(optical density,OD) ,根据标准曲线的回归方程式计算 STC1的含量。
1.4资料收集 所有患者术前进行(血细胞分析、生化等检查)、腹部超声或CT以及肺部影像学检查。术后规范性随访每例患者,每3个月回访并记录生存状态,所有患者中位随访时间为59.3 个月。生存分析采用计算患者总生存率(overall survival,OS),即从患者手术日期到因各种原因而死亡的时间。
1.5统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用独立样本的t检验,计数资料比较采用χ2检验;STC1在肾细胞癌中的预后作用采用Kaplan-Meier方法绘制生存曲线log-rank比较两组间的差异。P<0.05为差异有统计学意义。
2 结 果
2.12组外周血清STC1基因(STC1mRAN)表达比较 Real-time PCR结果显示,试验组患者外周血清中STC1基因的表达明显高于对照组(1.203±0.271vs0.353±0.182,t=12.132,P<0.001)。
2.22组外周血清STC1蛋白含量的比较 ELISA结果显示,RCC患者外周血清中STC1蛋白的表达明显高于正常人群对照组(23.112±6.054vs12.583±4.592,t=7.792,P<0.001)。
2.3血清STC1基因含量和临床参数的关系 进一步对50例RCC患者血清STC1含量和临床病理参数等进行了相关性分析,RCC患者血清中STC1mRNA 表达明显升高,RCC患者肿瘤组织中表达STC1变化在患者有无临床症状、不同Fuhrman分级、是否伴坏死、AJCC肾癌分期、淋巴结转移和是否远处转移方面差异有统计学意义(P<0.05),见表2。

表2 RCC患者外周血中的STC1mRNA表达与临床病理学特征关系Table 2 Relationship between STC1 mRNA expression in peripheral blood of renal cell carcinoma patients and the clinical pathological parameters
2.4RCC患者术前血清STC1蛋白表达水平与预后关系 50例RCC患者均获随访,中位随访时间为59.3个月,随访期间17例患者因各种原因发生死亡。按外周血清中STC1表达水平的中位数分为低表达组和高表达组。采用Kaplan-Meier方法绘制生存曲线,STC1 高表达组患者总体生存明显差于低表达组患者(P<0.001),见图1。
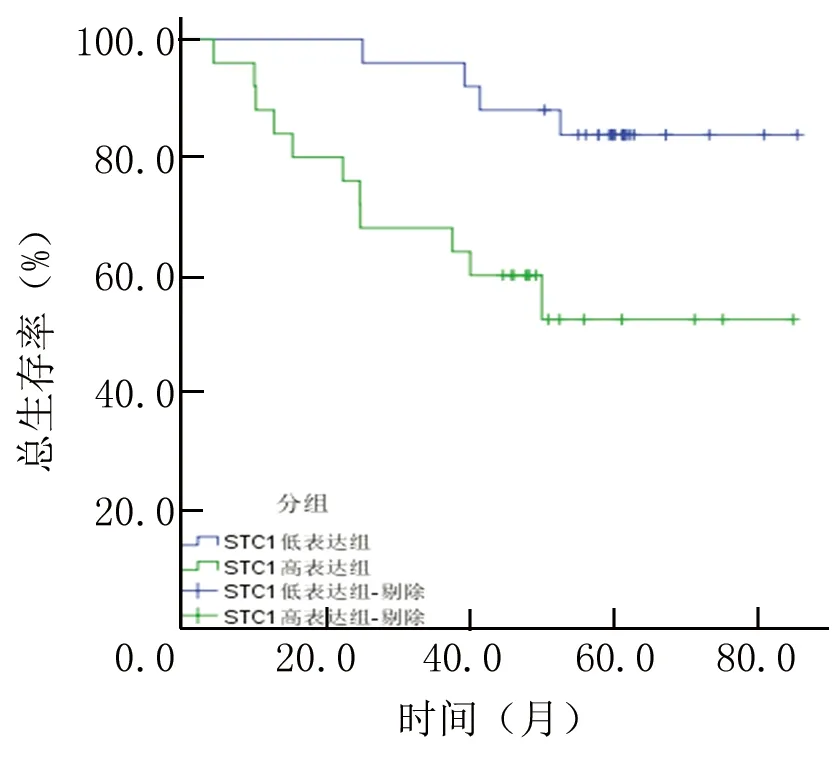
图1 RCC患者血清STC1蛋白低表达和高表达组术后总体生存曲线
3 讨 论
RCC的具体发病机制尚不完全清楚,研究发现RCC发生与发展受到多种基因调控,其中涉及癌基因的激活、抑癌基因的失活和增殖调节失控等多因素多环节,并通过多条信号转导通路共同起作用。缺氧诱导因子(hypoxia-inducible factors,HIF)在RCC发生发展中发挥重要作用,近年来,学者高度关注一种与HIF-1α密切相关的糖蛋白激素—STC,目前研究证实内源性低氧HIF-1α是缺氧条件下诱导 STC1mRNA 表达增强的一个关键因子,STC1通过促进缺氧区域的血管生成和提高肿瘤细胞的缺氧耐受性,来维持肿瘤细胞的能量代谢、新血管形成及肿瘤增殖[2-5]。Ma 等[6]通过在RCC组织和细胞水平研究发现缺氧促进 STC1表达。Meyer等[3]研究发现RCC患者中STC2高表达,而且发现STC2高表达患者总生存期较短,得出结论STC2可作为RCC患者术后判断预后的肿瘤标记物。STC1同样在多种恶性肿瘤患者血清和肿瘤组织中异常表达,樊鑫等[7]研究发现,膀胱癌患癌组织中STC1在基因和蛋白水平均表达升高,进一步通过向体外培养膀胱癌细胞中加入外源性STC1蛋白,可见STC1可促进膀胱癌细胞的增殖、降低其凋亡,进一步的迁移实验发现外源性STC1蛋白可明显增强膀胱癌细胞的迁移能力,而Bai 等[8]研究发现STC1通过细胞周期蛋白E1(cyclin E1)/周期蛋白依赖激酶(cyclin dependent kinase 2 )通路促进前列腺癌细胞增殖,前期研究发现STC1在RCC患者癌组织中表达上调,STC1表达水平与RCC总体生存呈负相关[4],如果术前就可以判断患者预后将临床意义更大,关于血清STC1判断RCC预后方面的研究报道较少,本研究通过检测RCC患者外周血清中STC1表达情况,研究外周血清中STC1表达水平与RCC患者临床病理参数的关系,初步探讨血清中STC1表达异常在判断RCC患者预后方面的临床意义。
众所周知,肿瘤诊断学研究的一个热点是寻找敏感度、特异度高的的肿瘤标志物不仅有助于术前诊断,也可用于肿瘤预后评估,目前尚无有效的肿瘤标记物来判断肾细胞癌预后情况。STC1异常表达与RCC预后关系成为近几年的研究热点。曾金敏等[9]研究发现RCC患者外周血STC1基因表达阳性,进而通过RCC在细胞水平研究发现不同浓度STC1影响肾癌细胞的增殖与凋亡。Ma等[6]研究发现在细胞水平STC1通过调节HIF-1α来调控RCC肿瘤细胞的增殖,并且发现RCC患者肿瘤组织在STC1基因和蛋白水平表达均显著上调,进一步抑制STC1可以抑制肾癌细胞生长迁徙和浸润侵袭,STC1可能通过促进上皮间皮变使RCC发生远处转移[10]。本研究采用Real-time PCR和ELISA法检测2组血清中STC1表达情况。结果显示,试验组患者血清中STC1在基因和蛋白水平表达均明显高于对照组(P<0.05) ,与既往文献报道STC1在各种肿瘤中表达水平上调,如肝细胞癌[11]、胃癌[12]、卵巢癌[13-14]和乳腺癌[15]和结肠癌[16]相一致。本课题组之前研究也发现RCC肿瘤组织STC1 中表达上调,提示RCC患者血清SCT1水平与癌组织中SCT1均表达升高[4]。
本研究通过检测STC1在RCC患者和正常人群血清中的表达情况,探讨 STC1与RCC患者临床病理特征的关系以及其在判断RCC患者预后中的价值。发现RCC患者外周血STC1基因高表达多见于已经出现临床症状、Fuhrman分级为Ⅲ~Ⅳ级、肿瘤伴有坏死、AJCC肾癌临床分期多为Ⅲ期和Ⅳ期和出现淋巴结转移及远处转移的患者。关于STC1与RCC临床病理变量的关系,Ma等[6]也研究发现RCC肿瘤组织中STC1的基因表达水平和RCC患者组织的Fuhrman分级和临床分期明显相关。前期研究也发现的RCC肿瘤组织中高STC1 的表达水平与RCC不良预后密切相关[4]。此外,既往也有较多文献报道了STC1在其他肿瘤中的预后作用,如Chan等[11]发现血清中STC1高表达与肝细胞癌更大的肿瘤直径和更差的5年无病生存相关;Brantley等[15]发现原发肿瘤组织中STC1的表达水平与乳腺癌晚期复发有着较强的关联,STC1的表达水平越高,乳腺癌晚期复发概率越高。由于临床分期、淋巴结转移和是否远处转移在很大程度上决定了RCC患者的预后。本研究通过分析外周血STC1表达水平与RCC患者预后的相关性,发现STC1表达水平与伴发临床症状、高Fuhrman分级和AJCC肾癌临床分期、出现淋巴结转移及远处转移等预后不良因素明显相关。本研究生存分析也证实了RCC血清中STC1的高表达者预后不良。由于血清STC1的高表达不具备组织特异性,需要结合患者病史及影像学检查综合评估。本研究为单中心回顾性研究,并且样本量较少,故需多中心大样本前瞻性临床研究进一步证实。
总之, 外周血清STC1高表达对RCC患者可能有较高的临床应用价值,有望成为RCC患者判断预后的新的肿瘤标志物。
