阿尔茨海默症的探索者——张晨教授
2020-10-27张晨
张 晨
(首都医科大学基础医学院,北京 100069)
1 个人简介
张晨教授(图1),现任首都医科大学基础医学院院长、博士生导师。1998年毕业于中国科学技术大学(学士),2003年毕业于中国科学院上海神经科学研究所(博士,导师周专教授),2004-2010年在Thomas C Südhof教授实验室从事博士后、助理研究员工作;2010-2018年于北京大学生命科学学院任研究员、博士生导师,2018年调入首都医科大学后任基础医学院院长,带领首都医科大学基础医学院荣获“2019年全国教育系统先进集体”称号。现任中国生物物理学会理事、中国实验动物学会理事、中国神经科学学会理事等。共发表论文60余篇。负责国家级研究课题十余项,包括国家杰出青年科学基金、国家优秀青年科学基金,并以首席科学家身份承担国家重点研发计划“基于重大神经疾病非人灵长类模型的干细胞治疗评价研究”;入选国家百千万人才工程并被授予“有突出贡献中青年专家”称号;获北京市“长城学者”、青年北京学者、教育部“新世纪优秀人才支持计划”、高等学校科学研究优秀成果奖(自然科学奖,一等奖,第二完成人)、全国百篇优秀博士论文奖等。

图1 张晨教授
2 主要学术贡献
阿尔茨海默症(Alzheimer’s disease,AD)是最常见的神经退行性疾病,严重影响老年人生活质量。国际老年痴呆协会的数据显示,我国当前AD患者超过600万;同时随着我国加速步入老龄化社会,预计到 21 世纪中叶我国AD患者将超过2 000万;因此AD的诊疗研究——尤其是AD 精确发病机制的探索——已经成为一个迫在眉睫的事关社会公共健康的重要科学问题。已有研究[1]结果显示,AD大脑中神经突触(脑中神经元之间进行信息传递和处理的最小单元)的功能障碍是造成认知缺陷的原因,其发生远早于脑中神经元死亡和临床症状[淀粉蛋白沉积(amyloid plaques)和神经纤维缠结(neurofibrillary tangles)]的出现。淀粉蛋白沉积假说(Aβ假说)的主要提出者Dennis J.Selkoe教授早在2002年就以“Alzheimer’s disease is a synaptic failure”为题在Science撰文提出了“AD的致病主要原因是突触的损伤”的假说[2],该假说被本领域的大量后续工作所证实[3-6]。张晨教授团队长期致力于探索AD病理情况下大脑神经突触功能的早期失常机制,从单细胞分辨率水平的神经网络视角对AD的病理机制做出了创新性工作,简述如下:(1)发现神经信号的短时程可塑性失常是AD的早期病理事件,结合早老素(presenilin)基因修饰动物发现短时程可塑性的分子机制是细胞内钙库Ryanodine受体缺失[7-8];(2)为实现单细胞分辨率水平的神经网络机制研究,开发了基于双光子研究AD动物清醒状态下短时程记忆的技术平台、基于机器学习的自动图像分析方法和用于在体记录的新型荧光记录电极等新技术,发现前额叶神经网络无法编码短时记忆是AD的极早期病理事件,该病变早于可塑性失常[9-14]。(3)通过大规模筛选发现了数个特异性调控神经信号传递(突触数量和受体)的新分子(ABHD6、PTPRO等),为AD的极早期干预提供了新靶点[15-21]。主要学术成绩和创新成果详述如下。
2.1 发现前额叶神经网络无法编码短时记忆是AD的极早期病理事件
当前本领域内公认AD致病的主要原因是突触的损伤,张晨教授前期工作发现 AD 相关基因PS1的表达产物早老素的作用环节是兴奋性突触前的钙库 Ryanodine 受体介导的突触短时程可塑性,暗示AD大脑中的单个突触的传递失衡是早于神经元死亡的大脑变化[7-8],这些成果在Faculty of 1000、Science Signaling 等权威学术平台上被众多科学家多次正面评价。由于 AD 迄今为止并没有成功的治疗和干预策略,兼之成年后神经再生的潜能非常低,因此如何寻找疾病早期大脑变化的特征已经成为一个非常重要的基础和临床科学问题。运用成像手段对于大脑网络进行观察被认为是寻找AD大脑早期变化的一个重要手段,以往的研究重点集中在几百微米尺度上的大脑核团之间的相互连接特性,缺少在单细胞分辨率下对AD脑变化的研究工作,这主要是受制于缺乏合适的研究工具。
张晨教授团队近5年来搭建了基于清醒动物的应用双光子在体成像技术分析AD大脑神经微环路功能的先进技术平台,针对海量的图像数据建立了基于遗传算法和机器学习的自动图像分析方法,大幅提高了分析海量双光子成像数据的效率、准确性和可靠性[10](图2),其中对图像分析算法中使用的遗传算法的鲁棒性和人工神经网络的容错性进行了系统的描述,基于脑神经网络的特性建立了强容错性人工神经网络[12];开发了可用于在体成像和记录的荧光玻璃电极,将高分子材料Parylene-C镀在电生理记录玻璃电极上,经特殊工艺,使其产生足够的荧光强度,推进了在体电生理记录的可视化[11](图3)。应用这些工具,张晨教授团队发现小鼠mPFC、V1、SSC等神经环路在信息处理过程中存在远高于随机模型的高阶相关性,AD动物模型的mPFC神经微环路中神经元之间的功能连接强度显著弱于野生型动物模型,且在AD 动物尚未出现突触电生理指标异常时发生短时记忆的原位处理能力障碍[9](图4),为长期有效改善AD症状和防治提供了新的线索。
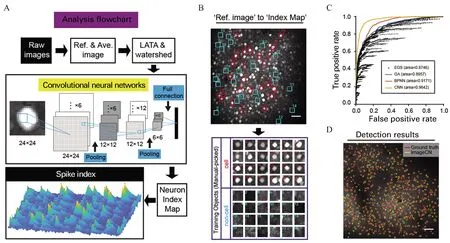
图2 基于深度学习的双光子成像数据分析方法

图3 可用于电生理记录的荧光玻璃电极的简单制造工艺
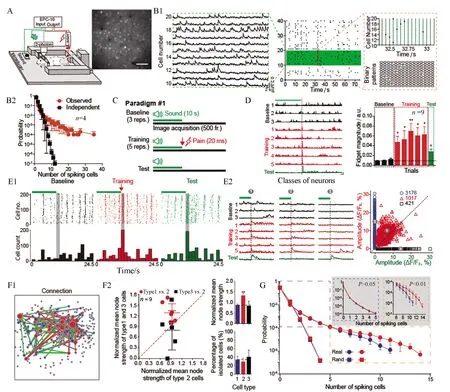
图4 基于类短时程记忆训练模式下mPFC神经网络分析
张晨教授团队建立的基于遗传算法的人工神经网络容错性分析方法被法国的Bernard Girau教授和IEEE资深成员Cesar torres-huitzil在权威杂志IEEEAccess的综述中进行了正面的评价,认为该方法在神经网络分析上具有泛化能力;关于荧光电极制造工艺的工作被评为LabonaChip杂志当期的封面文章;研发的超小型显微镜—μScope于2013年获得北京大学第七届实验技术成果奖(一等奖);2018 年关于神经微环路失常导致阿尔茨海默症的研究成果被CellReports作为当期的推荐论文,在其官网首页滚动展示。
2.2 针对AD的极早期干预,以突触数量和突触受体为指标,筛选出多个调控突触功能的新分子,为防治和有效改善AD症状提供了新靶点
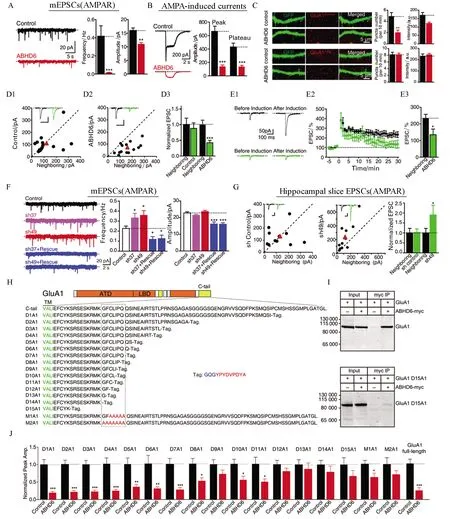
图5 ABHD6负调控AMPA受体介导的突触传递
基于领域内已有的大量研究,突触功能失调被证明是AD早期的主要事件之一,但是以往AD的干预治疗均主要以Aβ假说为基础(迄今为止基于Aβ假说的药物研发均未有成功的案例),因此通过突触调控改善AD症状的可能性越来越得到领域内科学家的重视。张晨教授团队在调控突触数量和突触受体领域做出了系统性的工作。在前期工作中发现了δ-阿片受体(delta opioid receptor, DOR)激活导致的阿片受体上膜过程是与兴奋性神经肽的释放过程相偶[21];突触特异分子neurexin 的表达量与抑制性突触传递效率成反比[19]。张晨教授团队近年来通过功能筛选发现了一个新的突触后AMPA受体相互作用蛋白ABHD6。目前已知的大部分AMPA受体调节亚基均是正向调节AMPA受体的功能,而张晨教授团队发现的ABHD6是一种AMPA受体负向调控分子,它可以直接与AMPA受体C端相互作用,通过不依赖其水解酶活性的方式降低AMPA受体的膜转运和AMPA受体介导的兴奋性的突触传递[22-24];张晨教授团队通过建立人工突触形成体系,运用全基因组筛选发现新的突触黏附分子PTPRO正向调控兴奋性突触的数目,并发现这种促突触生成作用是通过其胞外段结构域介导的,从而实现突触传递效率的正向调控[16](图6)。张晨教授团队关于ABHD6的工作发表后被国际同行引用并肯定了其对调节突触后AMPA受体转运和功能的重要性,领域内的两位权威专家瑞士巴塞尔大学Bernhard Bettler教授和德国弗莱堡大学的Bernd Fakler教授在经典综述杂志CurrentOpinioninNeurobiology上对该工作进行了正面的评价,并在整个研究领域已知重要蛋白的模式图中加上候选人新发现的蛋白ABHD6。团队关于PTPRO的工作发表于神经科学领域权威杂志美国神经科学会会刊JournalofNeuroscience,并被选为当期的 Featured article。
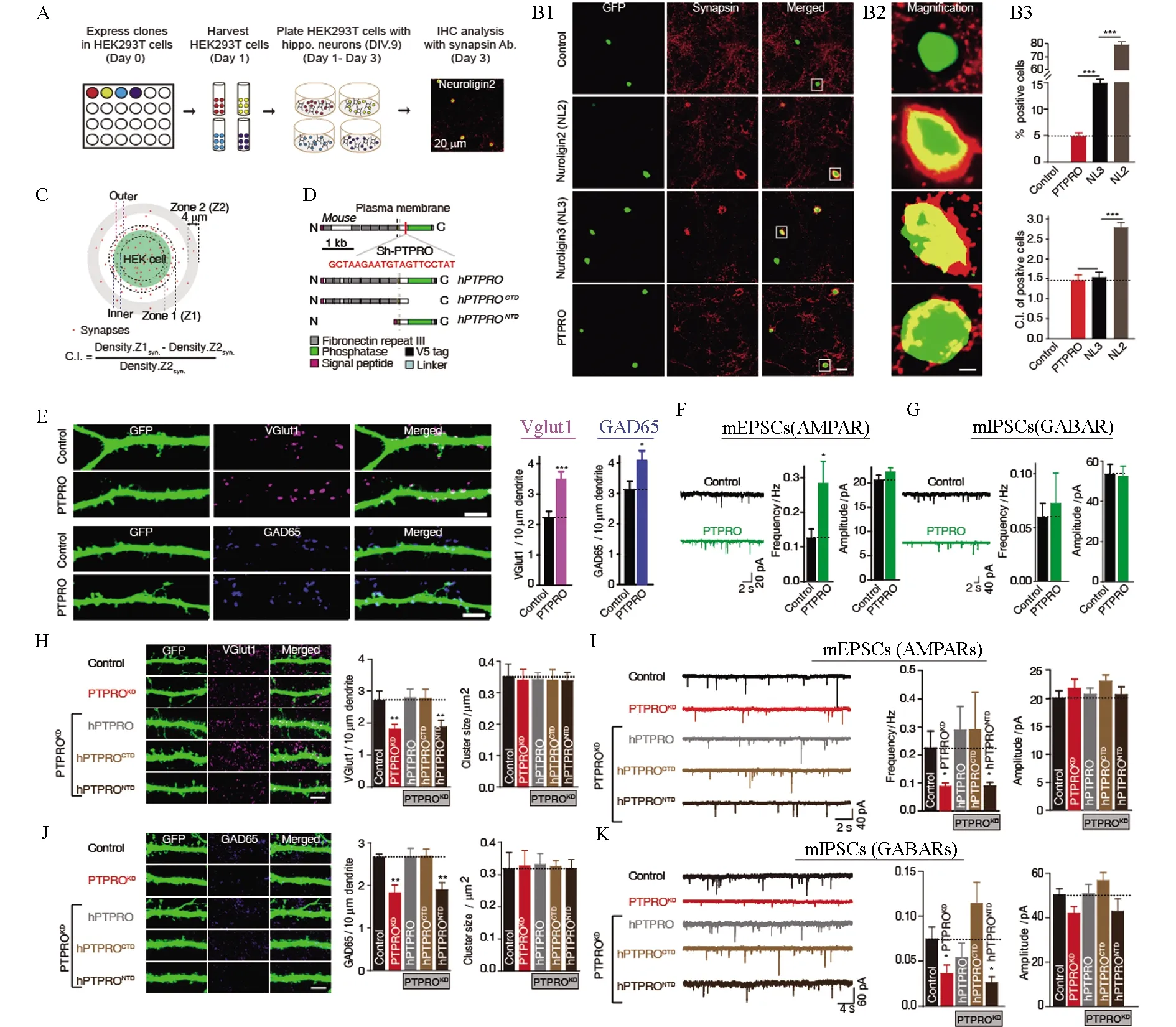
图6 PTPRO是可以促进突触形成的突触黏附分子
