GLP-1受体在脂多糖诱导的大鼠急性肺损伤中的作用及其机制
2020-10-27段智邓加雄雷小保李涛
段智,邓加雄,雷小保,李涛
(郴州市第一人民医院重症医学科,湖南 郴州423000)
Glucagon like peptide-1(GLP-1)受体属于G蛋白偶联受体B家族中的胰高血糖素受体亚家族。越来越多的研究表明,此受体除了在血糖的调节中发挥重要作用外,在包括心血管、肾脏、神经退行性病变等疾病中也发挥重要作用[1,2]。GLP-1受体广泛分布于人体器官及组织中,在肺部表达也较为丰富[3],但其在肺部疾病中的作用却少见报道。有研究发现利拉鲁肽在急性肺损伤中具有保护作用[3],但机制不明确。细胞通过自噬清除功能缺失的细胞器、结构破坏的蛋白质和侵入细胞的病原体等,从而发挥保护作用[4]。研究发现,GLP-1类似物可以通过激活细胞自噬缓解帕金森病中神经病变[5]。GLP-1可以通过上调自噬缓解糖尿病肾病的进展[6]。可见GLP-1受体可能通过细胞自噬发挥其生理学作用。我们以往的研究证实,增强细胞自噬可以减轻脓毒症急性肺损伤(acute lung injury,ALI)[4]。因此,本研究继续探讨GLP-1受体脓毒症ALI中的作用及其机制。
1 材料与方法
1.1 实验试剂
TUNEL试剂盒(江苏凯基生物技术股份有限公司,中国南京);兔抗大鼠Bax、Bcl-2、GAPDH、Beclin-1、P62单克隆抗体及二抗(武汉爱博泰克生物科技有限公司,中国武汉);LC3单克隆抗体(美国Immunoway公司,美国)。
1.2 实验动物模型与分组
成年雄性SD大鼠30只,体质量180~220 g,购于南方医科大学实验动物中心。参考以往研究建立ALI模型[7],大鼠经麻醉后,钝性分离并暴露气管,从气管内缓慢注射脂多糖(LPS,5 mg/kg),并缝合。假模型大鼠在接受手术后,气管内仅注射0.5 ml生理盐水(normal saline,NS)。
采用随机数表法将30只大鼠随机分为5组(每组6只):对照组大鼠建立假模型5 min后接受0.5 ml NS处理;空白药物组大鼠建立假模型5 min后接受GLP-1受体激动剂利拉鲁肽处理(2 mg/kg)[8];模型组大鼠建立ALI模型5 min后接受NS处理(0.5 ml);治疗组大鼠建立ALI模型后5 min接受利拉鲁肽处理(2 mg/kg)[8];抑制剂组大鼠建立ALI模型后5 min接受利拉鲁肽(2 mg/kg)及自噬抑制剂3-methyladenine(3MA,10 mg/kg)处理。大鼠在建立ALI模型12 h后处死,并检查相关指标。
1.3 实验方法
1.3.1 肺损伤 处死后取右下肺于10%中性福尔马林中固定、切片、脱蜡至HE染色,并参照以往研究评估肺损伤分数[7]。
1.3.2 肺组织湿干重比 分离右上肺,用吸水纸吸干表面水分后称量肺湿重,置于80℃烤箱72 h,称量肺干重。计算肺组织湿干重比(wet to dry ratio, W/D)。肺W/D=肺湿重/肺干重。
1.3.3 蛋白免疫印迹实验 分离肺组织,匀浆离心取上清,采用蛋白免疫印迹法,浓缩胶为5%,分离胶为10%,电泳后转移到FVDF膜,一抗LC3B、P62、Beclin-1、Bax、Bcl-2、GAPDH 4℃孵育过夜,二抗(1∶5 000)室温孵育2 h。一抗仅有GAPDH是以1∶5 000稀释度添加,其余均为1∶1 000稀释度添加。免疫化学发光法曝光并进行灰度值分析。
1.3.4 凋亡细胞检测 肺切片后,参照TUNEL检测试剂盒说明书,hoechst标记细胞核,FITC二抗标记TUNEL阳性细胞。
1.4 统计学处理

2 结 果
2.1 GLP-1受体对细胞自噬的影响
与对照组比较,模型组大鼠肺组织中LC3Ⅱ/Ⅰ及Beclin-1表达增加,P62表达下降;与模型组比较,治疗组大鼠肺组织中LC3 Ⅱ/Ⅰ 及 Beclin-1表达显著增加,P62表达显著下降(均P<0.05;图1,表1)。
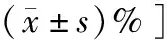
表1 4组大鼠自噬相关蛋白表达情况比较

图1 Western blotting检测自噬相关蛋白
2.2 GLP-1受体对肺损伤的影响
对照组及空白药物组大鼠肺组织结构正常。与对照组比较,模型组肺结构严重破坏,肺泡壁明显增厚,大量中性粒细胞浸润,呈弥漫性间质炎性改变,肺水肿及肺损伤分数明显增加。与模型组比较,治疗组肺泡壁稍增厚,少量炎性细胞渗出,肺水肿及肺损伤分数显著下降。与治疗组比较,抑制剂组肺泡壁增厚及炎性细胞浸润明显,肺水肿及肺损伤分数进一步增加(均P<0.05;图2,表2)。

图2 HE染色检测肺组织病理变化
2.3 GLP-1受体对肺组织细胞凋亡的影响
与对照组比较,模型组大鼠肺组织中Bax表达及凋亡细胞增加,Bcl-2表达下降;与模型组比较,治疗组大鼠肺组织中Bax表达及凋亡细胞显著下降,Bcl-2表达显著增加;与治疗组比较,抑制剂组大鼠肺组织Bax表达及凋亡细胞显著增加,Bcl-2表达显著下降(均P<0.05;图3和4,表2)。

表2 5组大鼠肺损伤及细胞凋亡情况比较
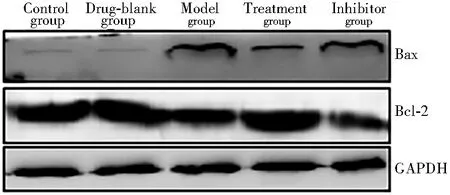
图3 Western blotting 检测细胞凋亡相关蛋白

图4 TUNEL染色检测肺组织细胞凋亡
3 讨 论
GLP-1受体不仅表达于胰腺,也表达于胰腺外组织,包括中枢神经系统、胃肠道、心血管、肺、肾脏、淋巴细胞及间充质干细胞等组织[3]。大量研究表明,除了调节高血糖相关代谢性疾病,其在其他疾病的发展中扮演重要作用。研究发现,激活GLP-1受体可以保护心脏免受缺血再灌注损伤[9]。GLP-1受体在肺部表达丰富[10]。有研究报道,GLP-1可以显著降低阻塞性肺疾病大鼠的发病率及死亡率,激活GLP-1受体可以显著改善急性肺损伤[3,8,11,12]。本研究同样证实,GLP-1激动剂可以显著减轻LPS介导的肺损伤,这与上述研究结果是相符的。但尽管如此,激活GLP-1受体减轻肺损伤的机制尚不明确。
以往研究已证实,上调细胞自噬可以显著减轻ALI[4]。而GLP-1受体对于细胞自噬的影响也有相关报道[13]。GLP-1类似物通过AMPK/mTOR途径诱导自噬,促进肝脏脂质积累[14]。激活GLP1受体可能通过促进细胞自噬,减轻细胞凋亡,从而缓解2型糖尿病患者慢性神经病变[15]。从基础实验到临床试验,都有数据证实基于GLP-1的治疗可以促进心脏代谢异常患者的细胞自噬水平[16]。尽管如此,在肺部疾病中,GLP-1对细胞自噬的作用尚未见研究报道。本研究结果证实激活GLP-1受体可以显著上调肺组织中LC3II/I、Beclin-1及下调P62表达,提示自噬水平增强,这是首次证明GLP-1受体对ALI中自噬水平有影响。细胞自噬通过清除细胞内损伤的细胞器、失调的蛋白质及异物等,从而维持细胞稳态,这对于细胞应对各种应激状态是非常关键的。为了探讨GLP-1受体是否通过细胞自噬减轻ALI,本研究使用了自噬的特异性抑制剂3MA。本研究结果表明,抑制细胞自噬可以显著抑制激活GLP-1受体对肺损伤及细胞凋亡的影响。
综上,激活GLP-1受体可以显著减轻脂多糖介导的急性肺损伤,其机制可能与其通过上调细胞自噬、进而抑制细胞凋亡有关。
