汉氏菱形藻生理特性对硝基苯胁迫的响应
2020-10-26杜庆才石先阳胡春香
杜庆才 石先阳 胡春香

摘要:研究不同质量浓度硝基苯(nitrobeneze)对汉氏菱形藻(Nitzschia hantzschia)生长、可溶性糖含量、可溶性蛋白含量、叶绿素a含量和藻细胞导电率的影响。结果表明,随着硝基苯质量浓度的升高,汉氏菱形藻的生长受到抑制,处理5 d时藻培养液依次由深黄色逐渐变为浅黄色;2 d后可溶性糖含量升高,1 d时100 mg/L硝基苯处理组可溶性蛋白含量为对照组的89.1%,为最低值,之后呈现逐渐上升趋势。低质量浓度硝基苯对藻细胞叶绿素a含量有促进作用,中、高质量浓度有抑制作用,而50 mg/L处理3 d后叶绿素a含量逐渐恢复;藻细胞的电导率随硝基苯质量浓度的升高而逐渐升高,低质量浓度处理3 d后电导率逐渐恢复,而高质量浓度伤害藻细胞,导致汉氏菱形藻逐渐死亡。
关键词:硝基苯;汉氏菱形藻;生理;电导率;环境胁迫
中图分类号: X172 文献标志码: A 文章编号:1002-1302(2020)17-0302-05
硝基苯类是被广泛应用的化工原料,据统计每年大约有因硝基苯类产生的3万t以上污染物流入环境中[1],但随经济发展该类化合物的需求呈明显上升趋势。美国环境保护局(EPA)调查发现,在有机化学品厂的废水中硝基苯含量最高可达190 mg/L,调查案例中有3%以上的工厂废水中的硝基苯含量在100 mg/L以上[2]。2005年,国内突发龙腾化工厂硝基苯车间爆炸、海门港化工厂硝基苯装置爆炸、中石油吉林石化公司双苯厂爆炸等事故导致硝基苯直接泄露[3-4]。硝基苯是高毒性物质,可通过接触或食物链富集危害生物[5-6]。国内外对硝基苯类化合物的研究主要集中于它们在生物体内的富集与毒性毒理机制方面[7-11]。藻类是水生态系统的重要初级生产者,汉氏菱形藻(Nitzschia hantzschia)是淡水生态系统中的广适物种,硝基苯对其生理特性的胁迫响应未见报道。本研究针对硝基苯污染对水生态环境中汉氏菱形藻的生理指标进行测定,探究硝基苯对其的生理响应机制,旨在为探索污染物硝基苯对环境影响情况提供理论依据。
1 材料与方法
1.1 材料与试验设计
汉氏菱形藻由中国科学院水生生物研究所淡水藻类藻种库提供。取对数生长期的汉氏菱形藻接种于250 mL三角瓶中,加 100 mL HB-D1培养基进行培养,培养条件为温度(25±1) ℃,连续24 h光照培养,光照度约2 000 lx[40 μmol/(m2·s)],置培养箱中定时摇动:5次/d。无菌台依次加10、50、100 mg/L硝基苯,各处理组设3个平行样,分别在0、24、48、72、96、120 h时取样测定各生理指标。
1.2 测定项目和方法
1.2.1 硝基苯处理对藻细胞生长的影响 从转接藻种开始用紫外分光光度计测定吸光度,每隔24 h测定经硝基苯处理的藻液的吸光度,连续测定5 d,取3个平行样的平均值。
1.2.2 可溶性蛋白含量的测定 取5 mL样品离心后,加去离子水2 mL超声波破碎,4 ℃离心上清液待测。可溶性蛋白含量的测定采用考马斯亮蓝 G-250 法并参照Bradford等的方法[12-13]。
1.2.3 可溶性糖含量的测定 可溶性糖含量的测定采用蒽酮比色法。
1.2.4 叶绿素a含量的测定 取一定藻液4 ℃离心后,加入体积分数为95%的乙醇,避光4 ℃下提取24 h,4 ℃离心、转速为8 000 r/min,上清液用紫外分光光度计测定吸光度。根据公式Ca=13.95D665 nm-6.88D649 nm;计算叶绿素的含量[14]。
1.2.5 藻细胞电导率的测定 取藻液8 mL室温下5 000 r/min用去离子水洗涤3次,加入16 mL去离子水,室温避光放置24 h,在20~25 ℃恒溫下,用电导仪测定溶液的电导率。测过电导率后,再放入100 ℃沸水浴中15 min,冷却后再在20~25 ℃室温下测定其煮沸电导率,伤害率=处理电导率/煮沸电导率×100%[15]。
2 结果与分析
2.1 硝基苯对藻细胞生长的影响
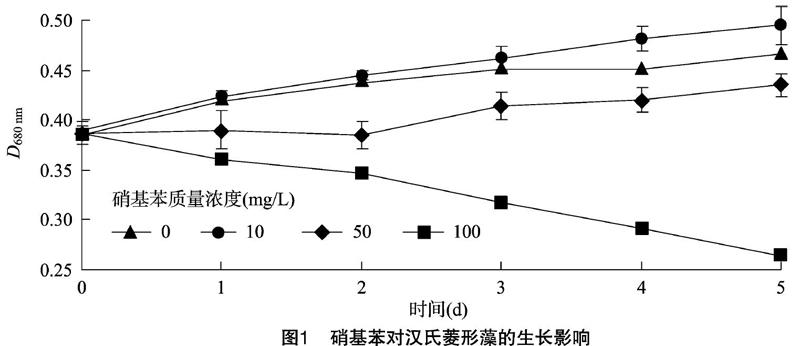
不同的硝基苯质量浓度胁迫汉氏菱形藻的生长动力学曲线见图1。低质量浓度 10 mg/L 硝基苯处理,对汉氏菱形藻生长抑制作用不明显;50 mg/L处理在2 d内表现轻度的抑制生长,2 d后开始逐渐恢复生长;而100 mg/L硝基苯胁迫对汉氏菱形藻生长抑制显著。5 d 后藻液由深黄色转变为浅黄色后接近透明现象,具体情况见图2。与对照相比藻液颜色变化效果很明显,硝基苯对汉氏菱形藻生长的影响呈现较为明显的剂量-效应关系,与莱茵衣藻影响结果一致[15],不同的是50 mg/L硝基苯胁迫下,汉氏菱形藻2 d后逐渐恢复生长,而莱茵衣藻需要4 d后才能逐步恢复生长,在相同胁迫条件下汉氏菱形藻表现出较强的耐受性。
2.2 硝基苯对可溶性糖含量的影响
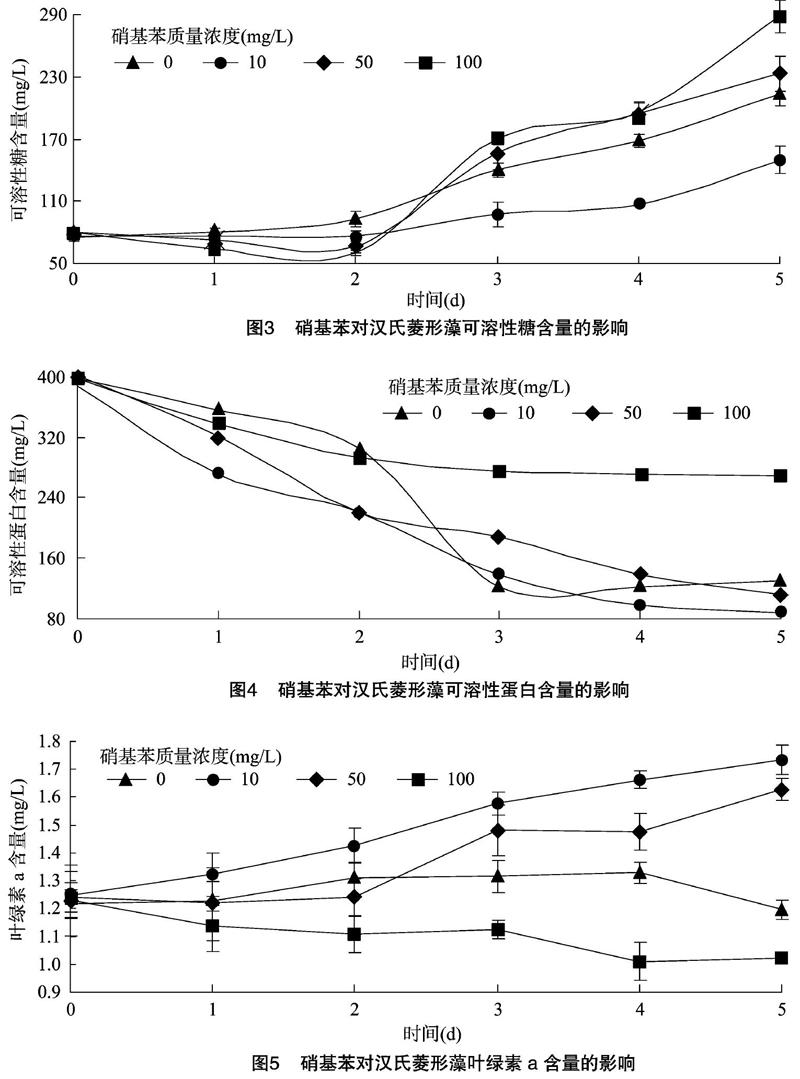
由图3可知,硝基苯处理使得汉氏菱形藻的可溶糖含量在2 d下降到最低点,之后藻细胞内可溶性糖含量随硝基苯质量浓度升高呈现梯度升高现象。可能是汉氏菱形藻的自身物质被降解成可溶性糖从而缓解了对藻细胞的伤害。在试验处理组内,藻细胞可溶性糖含量增加越迅速硝基苯质量浓度越高,5 d时,50、100 mg/L质量浓度处理组高于对照,10 mg/L质量浓度处理组低于对照。可能是50、100 mg/L质量浓度硝基苯胁迫下,藻细胞为应对不利环境分解自身物质应对,而10 mg/L质量浓度胁迫下,藻细胞质量浓度弱于对照且受伤害程度较弱,因此藻细胞分解自身糖类物质较少。
2.3 硝基苯对可溶性蛋白含量的影响
由图4可知,在1 d时,10、50、100 mg/L的硝基苯处理组均呈现最低的可溶性蛋白含量,依次是对照含量的63.7%、71.7%、93.6%,而且在1~3 d呈现出明显的回升趋势。3 d后10 mg/L硝基苯处理与对照相比无明显差异。10、50 mg/L质量浓度处理组与对照在4 d后,样品可溶性蛋白含量处于稳定状态,100 mg/L质量浓度处理有上升趋势,说明藻细胞逐渐适应环境胁迫。
2.4 硝基苯对叶绿素a含量的影响
由图5可知,质量浓度为10 mg/L硝基苯处理对汉氏菱形藻叶绿素a含量有促进作用;50 mg/L硝基苯在处理2 d之前有抑制作用,处理3 d后藻细胞叶绿素a含量有增加趋势;而100 mg/L硝基苯对汉氏菱形藻叶绿素a含量抑制作用比较明显且没有恢复的迹象,与汉氏菱形藻呈现浅黄色生长现象相吻合。
2.5 硝基苯对藻细胞的电导率情况
在正常情况下,生物细胞膜对物质具有选择性透过能力,当处于硝基苯胁迫条件下,汉氏菱形藻的藻细胞膜受到破坏,膜通透性变大,导致胞内细胞质外渗,所以直接表现在细胞浸提液的导电率增强,细胞浸提液导电率增大与膜通透性增大密切相关,而膜通透性程度增加与环境胁迫强度有直接关系。由图6可知,汉氏菱形藻细胞经过处理后,各处
理组与对照相比,随硝基苯的质量浓度增大,对藻类的伤害率呈现梯度上升。10 mg/L硝基苯处理,3 d 时藻细胞基本恢复正常状态;50 mg/L硝基苯处理3 d后逐渐恢复,到处理后5 d时基本上恢复到正常状态;而100 mg/L硝基苯处理,对汉氏菱形藻藻细胞的伤害是不能恢复的,与前面的生长影响情况测定得出的情况一致。
3 讨论
汉氏菱形藻生理特性对硝基苯胁迫的响应与胁迫质量浓度密切相关。10 mg/L硝基苯对汉氏菱形藻的生长无明显影响,而100 mg/L硝基苯则对汉氏菱形藻生理生长有明显的抑制效应,直至导致藻细胞死亡。虽然自然界水体环境中的硝基苯浓度通常较低,但藻细胞暴露于100 mg/L硝基苯质量濃度下还是完全有可能的[16-17]。因为硝基苯被广泛应用,世界各地主要河流水系中普遍存在污染物硝基苯[18-21],而当硝基苯污染事件爆发时,在小环境内,硝基苯的污染往往高出100 mg/L,藻类可能遭受更高浓度的硝基苯胁迫,从而被抑制生长,进一步影响淡水生态系统的稳定性。
本研究显示,10 mg/L硝基苯胁迫下对汉氏菱形藻吸光度几乎没有抑制作用,而100 mg/L硝基苯质量浓度下6 d后显微镜很难检测到有活的藻细胞,与对莱茵衣藻的研究结果相似。通过50 mg/L质量浓度硝基苯处理发现,处于胁迫环境下汉氏菱形藻藻细胞通过自身释放可溶性糖、可溶性蛋白等有机物的应激反应适应环境。汉氏菱形藻的可溶性糖含量下降表明,高质量浓度硝基苯胁迫下能够影响藻类的能量代谢与利用,并且高质量浓度胁迫下可能导致汉氏菱形藻藻细胞叶绿素a含量降低进而影响光合作用的性能[15]。
硝基苯对汉氏菱形藻的胁迫研究发现,在处理48 h内可能由于环境胁迫的原因,藻细胞对培养基营养物质利用较低,表现出汉氏菱形藻藻细胞转接培养48 h内自身的可溶性糖含量一直在减少。在 48 h 时处理组与对照组相比,汉氏菱形藻可溶性糖含量分别是对照组的81.82%、67.93%、62.64%。而再持续培养48 h后,尤其在3 d后藻细胞的可溶性糖含量回升最快,说明汉氏菱形藻对100 mg/L硝基苯含量以下胁迫条件下,48 h是其逐步恢复生理生长的临界点。4 d后可溶性糖含量回升到 170 mg/L 左右并逐渐趋于稳定,表明藻细胞适应后能利用培养基中的营养物质并有效地进行物质如糖类的合成。可能是藻细胞生长后期细胞吸收培养基中营养物质的能力下降,另一因素可能是培养基中的营养物质被逐步利用减少而受限制。汉氏菱形藻和莱茵衣藻在硝基苯胁迫的逆境条件下[15],汉氏菱形藻表现出较强较快的适应能力,100 mg/L硝基苯胁迫条件下,莱茵衣藻逐步快速死亡,6 d时几乎检测不到存活的藻细胞,而汉氏菱形藻通过分解自身细胞质如可溶性糖、可溶性蛋白被动适应逆境胁迫,2 d后可以逐步恢复生理生长。研究还表明,24 h内低、中、高质量浓度硝基苯胁迫下汉氏菱形藻细胞可溶性蛋白质含量与对照相比明显下降,而3 d后各质量浓度处理组基本上恢复稳定状态。可溶性蛋白与可溶性糖均是藻细胞内主要的细胞质,在硝基苯胁迫下,汉氏菱形藻通过自身物质分泌出可溶性蛋白到细胞外起到很好缓冲与保护作用,如果胁迫环境进一步增强,由于藻细胞分泌蛋白达到极限会直接影响藻细胞的生理功能,就会使汉氏菱形藻生长受阻直至因细胞破损死亡。汉氏菱形藻光合作用场所在叶绿体上,光合色素是物质基础。研究表明,汉氏菱形藻对不同质量浓度硝基苯胁迫,光合色素中叶绿素a含量有不同的响应。较高质量浓度硝基苯胁迫下光合色素含量明显降低,可能是细胞膜系统功能在硝基苯胁迫下遭到破坏,有研究表明25 mg/L硝基苯可以伤害植物膜系统[9],也可能是硝基苯上的硝基官能团与叶绿体捕光复合体系中的蛋白质结合[22],导致汉氏菱形藻的叶绿体中捕光复合体受抑制,使其叶绿素a含量降低,光合作用能力下降,从而影响汉氏菱形藻光合色素含量,与纤细裸藻、莱茵衣藻影响有相似性[23]。藻细胞光合色素含量与藻细胞生长中的吸光度也呈现较好的一致性。本研究表明,硝基苯对藻类的毒性可能主要是先通过分解自身的可溶性糖类、蛋白质减轻毒害,当硝基苯质量浓度较高时,藻类自身通过分解较多自身物质以及部分细胞器中的蛋白质变性,从而失去继续生长的可能。
高质量浓度的硝基苯使汉氏菱形藻细胞膜受到的损伤加剧,其选择透过性增大导致细胞的电解质外泄加剧,致使其伤害率上升,以至于在测试时间内细胞没有恢复正常的生理迹象。
4 结论
(1)汉氏菱形藻暴露在质量浓度为100 mg/L硝基苯环境下1~6 d内,对藻细胞的伤害是很难恢复的,即导致细胞死亡。(2)硝基苯质量浓度为10、50 mg/L时,处理后1 d汉氏菱形藻的可溶性蛋白含量降至最低点,2 d时的可溶性糖含量降到最低点,之后恢复到稳定值,这种变化趋势反映了汉氏菱形藻对硝基苯胁迫下的响应机制。(3)通过对硝基苯胁迫下汉氏菱形藻细胞生长、可溶性糖含量、可溶性蛋白含量、叶绿素a含量、电导率等生理生化响应模式研究,结果表明10、50 mg/L硝基苯胁迫下影响汉氏菱形藻细胞的正常生理态势,经响应后可以逐步恢复到正常生理生长状态,而100 mg/L硝基苯胁迫下,对藻细胞的伤害是难以恢复的。
参考文献:
[1]Hankenson K,Schaeffer D J. Microtox assay of trinitrotoluene,diaminonitrotoluene,and dinitromethylaniline mixtures[J]. Bulletin of Environmental Contamination and Toxicology,1991,46(4):550-553.
[2]Cai Z Q,Fu J,Du P H,et al. Reduction of nitrobenzene in aqueous and soil phases using carboxymethyl cellulose stabilized zero-valent Iron nanoparticles[J]. Chemical Engineering Journal,2018,332:227-236.
[3]Wang C,Feng Y J,Zhao S,et al. A dynamic contaminant fate model of organic compound:a case study of nitrobenzene pollution in Songhua River,China[J]. Chemosphere,2012,88(1):69-76.
[4]Zhu L Y,Ma B L,Lei Z,et al. The study of distribution and fate of nitrobenzene in a water/sediment microcosm[J]. Chemosphere,2007,69(10):1579-1585.
[5]Holder J W. Nitrobenzene carcinogenicity in animals and human hazard evaluation[J]. Toxicology and Industrial Health,1999,15(5):445-457.
[6]Beauchamp R O,Richard D I,Douglas E R,et al. A critical review of the literature on nitrobenzene toxicity[J]. CRC Critical Reviews in Toxicology,1982,11(1):33-84.
[7]Fletcher J S,Mcfarlane J C,Pfleeger T,et al. Influence of root exposure concentration on the fate of nitrobenzene in soybean[J]. Chemosphere,1990,20(5):513-523.
[8]劉 宛,李培军,周启星,等. 氯苯类胁迫对蚕豆幼苗超氧化物歧化物活性的影响[J]. 农业环境科学学报,2004,23(3):432-436.
[9]徐应明,袁志华,李军幸,等. 氯苯、硝基苯胁迫对小麦种子萌发和幼苗生理特性的影响[J]. 灌溉排水学报,2004,23(5):6-9.
[10]李秀霞,邵 红,王 仲,等. 硝基苯胁迫对水稻种子萌发和幼苗生理特性的影响[J]. 种子,2007,26(2):39-40.
[11]Dunnivant F M,Schwarzenbach R P,Macalady D L. Reduction of substituted nitrobenzenes in aqueous solutions containing natural organic matter[J]. Environmental Science & Technology,1992,26(11):2133-2141.
[12]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(2):248-254.
[13]黄文敏,邢 伟,李敦海,等. 外源抗坏血酸对烟草细胞生长及衰老的影响[J]. 农业环境科学学报,2006,25(5):1157-1161.
[14]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:134-137.
[15]杜庆才,张德禄,王高鸿,等. 莱茵衣藻生长和光合作用对硝基苯的响应[J]. 西北师范大学学报(自然科学版),2007,43(3):71-74.
[16]仲建强,张兰英,孙立波,等. 模拟地下水原位修复高浓度硝基苯污染的研究[J]. 农业环境科学学报,2007,26(3):920-924.
[17]卢桂兰,郭观林,王世杰,等. 水体中硝基苯厌氧降解微生物的筛选及其降解特性研究[J]. 农业环境科学学报,2010,29(3):556-562.
[18]Yurawecz M P,Bart J P. Identification of chlorinated nitrobenzene residues in Mississippi river fish[J]. Journal of AOAC International,1983,66(6):1345-1352.
[19]Yamagishi T,Miyazaki T,Horii S,et al. Identification of musk xylene and musk ketone in freshwater fish collected from the Tama River,Tokyo[J]. Bulletin of Environmental Contamination and Toxicology,1981,26(5):656-662.
[20]Noordsij A,Puyker L M,Gaag M D. The quality of drinking water prepared from bank-filtered river water in the Netherlands[J]. Science of the Total Environment,1985,47:273-292.
[21]He M C,Yan S,Li X R,et al. Distribution patterns of nitrobenzenes and polychlorinated biphenyls in water,suspended particulate matter and sediment from mid- and down-stream of the Yellow River (China)[J]. Chemosphere,2006,65(3):365-374.
[22]刘碧云,周培疆,李佳洁,等. 丙体六六六对斜生栅藻生长及光合色素和膜脂过氧化影响的研究[J]. 农业环境科学学报,2006,25(1):204-207.
[23]陆光华,赵元慧,汤 洁,等. 绿藻对硝基苯类化合物的富集与释放研究[J]. 环境科学研究,2001,14(3):4-5.
