低温胁迫下牛皮杜鹃MAPK级联参与ABA信号转导的基因表达分析
2020-10-26刘璐刘芸伯佟佳欣闫彤徐洪伟周晓馥
刘璐 刘芸伯 佟佳欣 闫彤 徐洪伟 周晓馥

摘要:为了探究牛皮杜鹃在低温胁迫下MAPK级联途径参与ABA信号转导的分子机制,通过转录组测序的方法对4 ℃低温处理组和25 ℃正常对照组牛皮杜鹃进行研究。结果表明,转录组测序共得到6.40 Gb clean data,低温组筛选出12 261个差异表达基因,其中上调基因和下调基因的数量分别为6 811个和5 450个。对关键基因进行KEGG注释发现,共有228个差异表达基因富集到MAPK信号通路-植物通路,其中ABA信号转导通路中大部分差异表达基因发生上调,说明该信号通路在低温胁迫下被激活。推测牛皮杜鹃在低温胁迫下可激活MAPK级联途径中相关基因的表达来参与ABA信号转导过程,进而应对低温环境所带来的不利影响。
关键词:牛皮杜鹃;低温胁迫;MAPK级联途径;ABA信号转导;基因表达分析
中图分类号:S685.210.1 文献标志码: A 文章编号:1002-1302(2020)17-0059-06
牛皮杜鹃(Rhododendron chrysanthum Pall. )别称牛皮茶,杜鹃花科杜鹃属,是世界上最珍贵的种质资源之一,由于具有重要的观赏及药用价值[1],因此极具开发潜力。
低温作为一种主要的逆境胁迫,严重影响植物的地理分布和品质[2]。脱落酸(ABA)既是一种植物激素也是一种信号传导物质,在植物逆境研究方面具有重要意义[3]。有研究证实,低浓度的ABA处理冬小麦幼苗会促使其生长,而高浓度的ABA则会抑制幼苗的光合作用效率,引起生物量积累下降[4]。 MAPK(mitogen activated protein kinase)级联途径包括MAPKKK-MAPKK-MAPK 3个组分,这3个组分既可独自发挥作用也可彼此协作发挥作用,使植物及时作出相应的反应以抵御逆境胁迫带来的危害,该途径也被认为是植物细胞将胞外刺激转换成胞内反应的主要途径之一[5-7]。大量研究表明,MAPK级联途径的3个组分均可直接或间接地参与ABA信号转导过程,ABA信号也可调控MAPK级联途径中相关组分基因的表达[8],但是对两者相互作用的分子机制却鲜有研究。
近年来,转录组测序技术应用广泛,它可不依赖参考基因组,这为牛皮杜鹃等无内参的非模式生物的转录组研究提供了新方法[9]。本研究以牛皮杜鹃为试验材料,应用转录组测序的方法研究在 4 ℃ 低温胁迫下牛皮杜鹃MAPK级联途径参与ABA 信号转导过程的基因表达情况,旨在从分子水平上探究二者相互作用的分子机制,为植物抗逆境胁迫研究提供理论基础和科学依据。
1 材料与方法
1.1 材料
牛皮杜鹃采自长白山,用1/4 MS培养基置于吉林师范大学吉林省植物资源科学与绿色生产重点实验室模拟高山植物智能人工气候室中正常培养[光—暗周期14 h—10 h;昼温25 ℃,夜温18 ℃;光子通量密度50 μmol/(m2·s)],选取8个月大的牛皮杜鹃组培苗为试验材料。
1.2 方法
1.2.1 样品处理 2018年9月20日选择8个月大长势一致且良好的牛皮杜鹃随机分成2组,每组12棵。随机选择其中1组置于智能人工培养箱[光—暗周期14 h—10 h;昼温25 ℃,夜温18 ℃;光子通量密度50 μmol/(m2·s )]中,记为对照组;另外1组移至4 ℃ 低温环境下,记为低温组。24 h后取出2组牛皮杜鹃于液氮中速冻后置于低温冰箱中保存备用,每组3次重复。
1.2.2 转录组测序数据分析 mRNA文库构建委托华大基因完成。对得到的原始数据进行过滤,去除不符合要求的reads,以保证结果的可靠性。使用RPKM值衡量基因的表达量,用以差异基因表达量的确定和分析,并筛选差异表达基因及功能注释。
1.2.3 统计分析 使用SPSS 16.0进行单向ANOVA,运用LSD检验差异性。采用Sigmaplot 12.5进行图表绘制。
2 结果与分析
2.1 RNA质量检测
经华大基因检测,对试验组和对照组样品总RNA进行质量评价,符合建库标准。
2.2 数据组装和质量分析
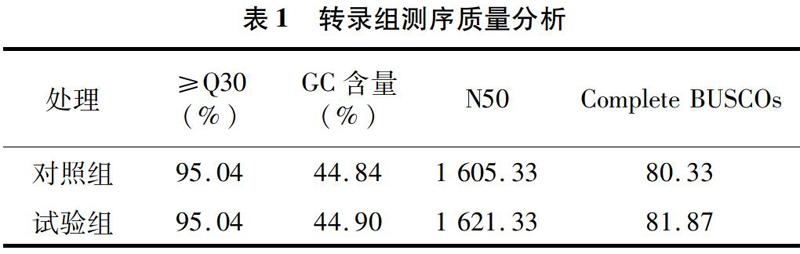
通过高通量测序获得原始数据,统计原始数据测序量。使用BUSCO数据库对组装的转录本进行产量评估。结果显示,Q30均在95% 以上,GC含量接近50%,N50值在1 k左右,说明测序数据可以用于组装(表1)。
对过滤后符合要求的数据进行预处理,得到clean reads数。如表2所示,2组中的clean reads均占原始raw reads的85 % 以上,说明数据组装和测序精确度较好。
2.3 差异表达基因的筛选与注释
2.3.1 差异表达基因的筛选 為了研究低温胁迫下ABA调控MAPK信号在牛皮杜鹃中的作用,对低温处理组和对照组牛皮杜鹃进行转录组分析。将差异表达量大于2倍的基因视为差异表达基因。在此标准下,低温组共筛选出12 261个差异表达基因,包括6 811个上调基因和5 450个下调基因。
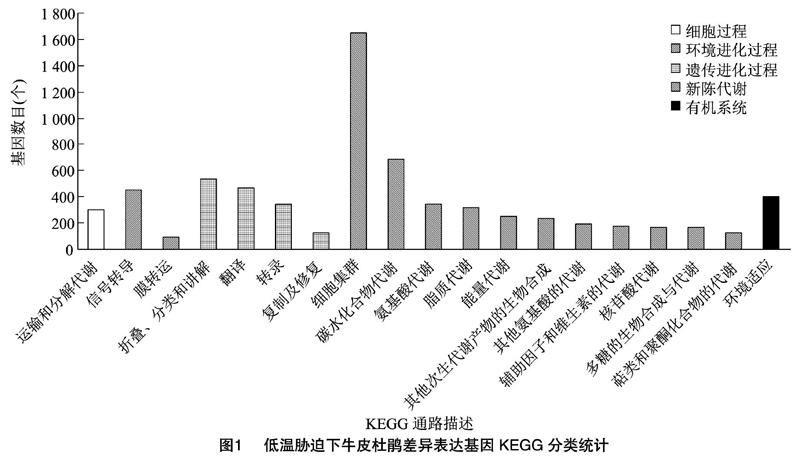
2.3.2 差异表达基因的KEGG富集分析 根据KEGG数据库,低温组筛选出的差异表达基因中有7 031个基因被注释在细胞过程、环境进化过程、遗传进化过程、新陈代谢和有机系统这五大类代谢通路的19个小类中(图1)。其中,在2组牛皮杜鹃的差异基因KEGG分类中,448个差异基因参与了信号转导这一途径。
在信号转导途径中,有228个差异表达基因富集到MAPK信号通路-植物通路,对这部分差异基因进一步富集分析,以Qvalue最小的前20个GO Term作图(图2)。分别为MAPK信号通路-植物、植物-病原互作、植物激素信号转导、氨基糖和核苷酸糖代谢、蛋白酶体、色氨酸代谢、磷脂酰肌醇信号系统、乙醛酸和二羧酸代谢、过氧化物酶体等。
由图3可见,牛皮杜鹃PYR/PYL-PP2C-SnRK2信号通路在响应低温胁迫的过程中,差异基因的表达量发生显著改变,且大部分的差异基因表达量发生上调(表3),由图4可知,低温胁迫下SnRK2促使下游AREB/ABF家族中的差异基因表达量发生显著变化,推测在低温胁迫下牛皮杜鹃激活了ABA信号转导途径中相关基因的表达,促进气孔关闭、种子休眠。
2.4 低温胁迫下MAPK级联途径参与ABA信号转导的关键基因表达分析
2.4.1 低温胁迫对牛皮杜鹃MAPK级联信号途径中关键基因的影响 结合图2分析结果,最终确定从MAPK信号通路-植物、植物-病原互作、植物激素信号转导、氨基糖和核苷酸糖代谢、蛋白酶体、色氨酸代谢、磷脂酰肌醇信号系统、乙醛酸和二羧酸代谢、过氧化物酶体这几个代谢途径寻找低温胁迫下MAPK级联途径参与ABA信号转导途径中发生差异表达的关键基因。
MAPK信号通路-植物和植物激素信号转导是低温胁迫下牛皮杜鹃信号转导途径中2个最重要的途径,参与多种植物代谢活动。对这富集在2条代谢通路的差异基因进行统计分析,结果显示,在这2条代谢通路中,上调基因的数量都大于下调基因的数量,说明牛皮杜鹃这2条代谢途径中的大部分关键基因的表达受低温胁迫影响显著。
结合表3与图5结果,在MAPK级联信号途径中,低温胁迫激活了MAPK17/18,然后以逐级磷酸化的方式激活MKK3、MPK1/2以及下游胁迫适应基因,其中MAPK17/18、MKK3和MPK1/2基因表达量发生上调,胁迫适应基因表达量发生下调。结果表明,牛皮杜鹃MAPK级联信号途径中的关键基因受到低温胁迫的显著影响。
2.4.2 低温胁迫下牛皮杜鹃MAPK级联途径参与ABA信号转导调控 ABA作为一种主要的逆境激素,在植物面临低温、干旱、高盐等非生物胁迫时,其含量在短时间内会明显上升,通过激活多条途径中相关基因的表达来维持自身生理状态的稳定。在本研究中,如图3所示,在外界环境信号刺激下,通过启动类胡萝卜素生物合成过程来开启ABA合成系统,通过去磷酸化作用使得PP2Cs抑制SnRK2s活性,但受低温胁迫的影响导致ABA含量升高,解除了这种抑制作用,使得SnRK2得到释放,最终SnRK2促使下游AREB/ABF转录因子磷酸化,诱导ABA响应基因的表达。
而在低温胁迫下ABA的PYR/PYL-PP2C-SnRK2信号通路中的大部分基因的表达量都发生上调,推测牛皮杜鹃在低温胁迫下可以通过激活脱落酸合成相关基因,合成大量的脱落酸,促进气孔关闭,种子休眠,通过改变ABA信号转导途径中相关基因的表达量,增强牛皮杜鹃抵抗低温的能力。
3 討论
3.1 低温胁迫对牛皮杜鹃MAPK级联途径的影响
对拟南芥和其他植物的研究中发现,MAPK级联是植物响应逆境胁迫的一条重要代谢途径[10]。在研究非生物胁迫对玉米的抗氧化防御机制的影响时发现,在低温处理下,MAPK级联途径受到抑制后,玉米中抗氧化酶活性均不同程度减弱,对低温信号反应迟钝[11]。在本研究中,MAPK级联途径各组分在响应低温胁迫的过程中,先激活了MAPK17/18,然后以逐级磷酸化的方式依次激活MKK3、MPK1/2以及下游胁迫适应基因,其中MAPK17/18、MKK3和MPK1/2基因表达量发生上调,胁迫适应基因表达量发生下调。这些结果说明牛皮杜鹃MAPK级联信号途径中的关键基因受到低温胁迫的显著影响,并通过调节MAPK级联途径中相关基因的表达量来应对低温环境对其造成的不良影响。
3.2 低温胁迫对牛皮杜鹃MAPK级联途径参与ABA信号转导的影响
大量研究表明,植物在面临低温等非生物逆境胁迫时,会引起植物自身ABA的累积效应[12-13],而MAPK级联作为参与ABA信号转导的主要途径之
一,更是控制着细胞的诸多生命活动[14]。PP2C在非胁迫条件下可通过去磷酸化使SnRK2失去活性,进而使得ABA信号传递终止[15]。而一旦接受外界或植物自身信号刺激并激活ABA合成相关基因诱导合成ABA之后,ABA与受体蛋白结合并在与PP2C互作时便可抑制PP2C活性以达到释放SnRK2的目的,使得SnRK2恢复活性继而磷酸化下游的AREB/ABF,将上游信号向下传递[16]。在本研究中,低温胁迫下ABA的PYR/PYL-PP2C-SnRK2信号通路中的大部分基因的表达量都发生上调,推测低温胁迫可以通过激活MAPK级联途径,进而影响ABA信号转导途径中相关基因的表达量的变化,使其在ABA信号转导途径中发挥作用。
4 结论
综上所述,本研究通过转录组测序的方法对低温胁迫下牛皮杜鹃MAPK级联途径参与ABA信号转导过程中的关键基因进行分析,推测低温胁迫可以激活MAPK级联途径中3个蛋白激酶家族中的关键基因,并调控了ABA信号转导途径中相关基因的表达,从而激活ABA调控MAPK信号过程来应对低温胁迫环境。
参考文献:
[1]Zhou X,Chen S L,Wu H,et al. Biochemical and proteomics analyses of antioxidant enzymes reveal the potential stress tolerance in Rhododendron chrysanthum Pall[J]. Biology Direct,2017,12(1):10.
[2]肖玉洁,李泽明,易鹏飞,等. 转录因子参与植物低温胁迫响应调控机理的研究进展[J]. 生物技术通报,2018,34(12):1-9.
[3]丁海东,朱晓红,刘 慧,等. ABA信号转导途径中的MAPKS[J]. 植物生理学报,2011,47(12):1137-1144.
[4]张晓晶,李晨晨,刘志宏,等. 不同浓度 ABA 处理对冬小麦生理指标的影响[J]. 江苏农业科学,2015,43(9):103-105.
[5]Knetsch M,Wang M,Snaar-Jagalska B E,et al. Abscisic acid induces mitogen-activated protein kinase activation in barley aleurone protoplasts[J]. The Plant Cell,1996,8(6):1061-1067.
[6]Takahashi Y,Soyano T,Kosetsu K,et al. HINKEL kinesin,ANP MAPKKKs and MKK6/ANQ MAPKK,which phosphorylates and activates MPK4 MAPK,constitute a pathway that is required for cytokinesis in Arabidopsis thaliana[J]. Plant & Cell Physiology,2010,51(10):1766-1776.
[7]Zhang M,Su J,Zhang Y,et al. Conveying endogenous and exogenous signals:MAPK cascades in plant growth and defense[J]. Current Opinion in Plant Biology,2018,45:1-10.
[8]段志坤,秦曉惠,朱晓红,等. 解析植物冷信号转导途径:植物如何感知低温[J]. 植物学报,2018,53(2):149-153.
[9]唐仕云,杨丽涛,李杨瑞. 低温胁迫下不同甘蔗品种的转录组比较分析[J]. 生物技术通报,2018,34(12):116-124.
[10]Fujita Y,Fujita M,Satoh R,et al. AREB1 is a transcription activator of novel ABRE-dependent ABA signaling that enhances drought stress tolerance in Arabidopsis[J]. The Plant Cell,2005,17(12):3470-3488.
[11]Fujita Y,Nakashima K,Yoshida T,et al. Three SnRK2 protein kinases are the main positive regulators of abscisic acid signaling in response to water stress in Arabidopsis[J]. Plant and Cell Physiology,2009,50(12):2123-2132.
[12]洪 岚,刘 旭,李 玲. 植物AREB/ABF转录因子及其参与的ABA信号转导[J]. 植物生理学报,2011,47(3):211-217.
[13]丁红映,王 明,谢 洁,等. 植物低温胁迫响应及研究方法进展[J]. 江苏农业科学,2019,47(14):31-36.
[14]魏 强,李 静,刘 艺,等. MAPK信号转导通路在人参多糖诱导白血病K562细胞凋亡中的作用[J]. 中草药,2013,44(2):193-198.
[15]李悦鹏,张晓兰,于 雷,等. MAPK级联途径激酶结构特点及其信号转导途径在园艺作物逆境中的作用[J]. 植物生理学报,2018,54(8):1305-1315.
[16]伍静辉,谢楚萍,田长恩,等. 脱落酸调控种子休眠和萌发的分子机制[J]. 植物学报,2018,53(4):542-555.
