电针对骨骼肌萎缩模型大鼠的干预效果及作用机制研究
2020-10-26刘祥华罗湘筠李文倩
刘祥华,罗湘筠,李文倩
(湖南中医药高等专科学校附属第一医院 湖南省直中医医院,湖南 株洲 412000)
骨骼肌萎缩患者主要的临床表现是肌纤维发生进行性缩小或者消失,患者肌肉质量、容积缩小,其骨骼肌运动以及内分泌功能发生受损。临床发现,骨骼肌萎缩主要包括失神经性肌萎缩、衰老性肌萎缩和药源性肌萎缩等,引起患者肢体运动功能障碍,对正常生活产生严重影响[1]。目前骨骼肌萎缩的原因较为复杂,其发病机制尚不明确,通过研究其发生机制,能控制患者骨骼肌萎缩[2]。电针可有效延缓失神经性骨骼肌萎缩,已经有大量的研究证实,其能改善周围神经损伤的症状,促进神经损伤修复,对靶器官骨骼肌有延缓萎缩作用[3],目前临床中关于电针治疗骨骼肌萎缩作用机制尚不明确。本研究旨在研究电针对骨骼肌萎缩模型大鼠的干预效果及作用机制,为临床治疗骨骼肌萎缩提供理论参考。
1 材料与方法
1.1 材料
1.1.1 研究动物 选取健康雄性清洁级Sprague-Dawley大鼠30只(由重庆医科大学动物实验中心提供,医学动物合格证号:SCXK渝2012-0002),体质量190~220 g,鼠龄8~10周。本研究符合我院研究伦理委员会标准。
1.1.2 主要试剂 Akt、mTOR、p-Akt、p-mTOR一抗(美国CST公司提供);PBS缓冲液(波尔实验室提供);MURF1、PGC-1α、FNDC5 ELISA试剂盒(美国Bio-Rad公司提供)。
1.2 方法
1.2.1 骨骼肌萎缩模型建立 30只大鼠随机分为模型组、假手术组和电针组,各10只。参考高睿琦[4]文献,所有大鼠给予10%的水合氯醛(0.3 mL/100 g)麻醉后,在无菌手术台上进行建模。具体操作:固定,将麻醉后的大鼠固定在干净的手术台中;备皮,将大鼠右后肢充分暴露后,做好消毒的准备工作;将手术器械高温消毒后,沿大鼠大肌间隙进行钝性分离,坐骨神经暴露;神经缺口建立,将坐骨神经剥离,使用手术剪将电针组和模型组两组大鼠坐骨神经中段切断后,将两段进行游离段反折,制作2.0 mm的神经缺口,假手术组大鼠只需要将坐骨神经暴露,不需要将坐骨神经切断。
1.2.2 电针干预 大鼠建模2 d后,早9:00将电针组大鼠在柔软型固定器上进行固定,进针采用毫针,取穴参照《大鼠穴位图谱的研制》和《实验电针学》进行:侧足三里、承山。进针5~7 mm后,将侧足三里、承山两穴与电针仪连接,电针参数设置:采用连续波,频率为5 Hz,强度1.5 mA。1次/d,每次维持10 min,需要连续干预3周。假手术组和模型组大鼠每天进行固定,时间与电针组保持一致。
1.2.3 腓肠肌湿重、干重测定 大鼠建模成功后,采用10%的水合氯醛(0.3 mL/100 g)对大鼠进行麻醉,将大鼠腓肠肌快速分离,采用电子天平进行称重,主要包括湿重、干重、干重/体重比值。
1.2.4 骨骼肌肌纤维直径、面积测定 HE染色:快速提取大鼠骨骼肌,使用40 mL/L的多聚甲醛进行固定,常温下使用15%的EDTA脱钙6周,脱水后进行石蜡包埋,制作3 μm的组织切片,HE染色,观察。骨骼肌经过HE染色后,采用LeicaQwin图像分析系统,分析骨骼肌肌纤维直径、面积,标本做4个切面,选择4个髙倍镜视野,观察骨骼肌肌纤维直径、面积,记录实验数据。
1.2.5 骨骼肌相关蛋白检测 采用ELISA检测,将采集到的标本,取50 mM碳酸盐(pH9.5, 0.05 mol/L CB)适当稀释的抗MURF1、PGC-1α、FNDC5 0.1 mL,添加至聚苯乙烯反应板孔中,加盖后温度4 ℃ 24 h,次日使用洗涤剂洗涤3次后,甩干。在各孔中加入稀释液(pH7.4, 0.02 mol/L Tris-HCl缓冲液)稀释的待测标本0.1 mL,同时加入阳性和阴性的对照标本,在43 ℃置60 min,将液体移除洗涤3次后,甩干。在各孔中加入MURF1、PGC-1α、FNDC5的酶标抗体0.1 mL,43 ℃置60 min。液体移去后洗涤3次,甩干。在各个孔中加入底物液四甲基联苯胺(TMS),空白孔不加,0.05 mol/L枸橼酸(10.5 g/L)4.86 mL混匀,加入邻苯二胺(OPD)4 mg,置棕色小瓶中,临用时加30% H2O24.0 μL,混匀]0.1 mL,置黑20 min,在各孔中加入2 mol/L H2SO40.05 mL,终止反应。在酶标仪上读取A405吸收值。分析MURF1、PGC-1α、FNDC5蛋白表达。
1.2.6 Akt/mTOR通路相关蛋白检测 采用Western Blot检测,将采集到的标本10 000×g离心处理10 min,取出上清液,采用BCA蛋白浓度测定试剂盒检测蛋白定量,将50 μg蛋白加入到2×SDS凝胶加样缓冲液中,100 ℃加热处理5 min促使蛋白变性。SDS聚丙烯酰胺凝胶电泳完成后进行转膜,结束后取下硝酸纤维素膜,在5%脱脂牛奶中4 ℃下封闭1 h,封闭结束后,加一抗(Akt、mTOR、p-Akt、p-mTOR)使用0.05%~0.1% TBST给予稀释(1∶1 000),4 ℃孵育过夜保存,之后使用0.05%~0.1% TBST洗膜,3次,每次5 min,加二抗使用0.05%~0.1% TBST给予稀释(1∶10 000),室温摇动孵育1 h,最后使用0.05%~0.1% TBST洗膜,3次,每次5 min。采用DAB染色试剂盒显色,光密度扫描后进行定量分析。以GAPDH为内参。
1.3 统计学处理
2 结果
2.1 电针对骨骼肌萎缩模型大鼠腓肠肌湿重、干重的影响
如表1所示,电针组骨前肌湿重、干重、干重/体重高于模型组,低于假手术组,差异具有统计学意义(P<0.05)。模型组骨前肌湿重、干重、干重/体重低于假手术组,差异具有统计学意义(P<0.05)。
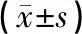
表1 各组大鼠腓肠肌湿重、干重比较
2.2 电针对骨骼肌萎缩模型大鼠骨骼肌肌纤维直径、面积的影响
如表2所示,电针组骨骼肌肌纤维直径、面积高于模型组,低于假手术组,差异具有统计学意义(P<0.05)。模型组骨骼肌肌纤维直径、面积低于假手术组,差异具有统计学意义(P<0.05)。
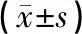
表2 各组大鼠骨骼肌肌纤维直径、面积比较
如图1所示,假手术组大鼠骨骼肌肌纤维分布均匀,排列整齐,纤维之间的间隙保持一致,细胞核主要在肌细胞周围散布。模型组大鼠骨骼肌肌纤维结构不规则,排列混乱,肌纤维发生萎缩,纤维之间的间隙增大,细胞核大小不一致,分布不规律。电针组大鼠骨骼肌肌纤维萎缩程度低于模型组,细胞核增加呈聚集分布。

图1 3组大鼠骨骼肌病理学观察(HE染色,200×)
2.3 电针对骨骼肌萎缩模型大鼠骨骼肌相关蛋白的影响
如表3所示,电针组骨骼肌相关蛋白MURF1表达低于模型组,PGC-1α、FNDC5表达高于模型组,差异具有统计学意义(P<0.05)。电针组骨骼肌相关蛋白MURF1表达高于假手术组,PGC-1α、FNDC5表达低于假手术组,差异具有统计学意义(P<0.05)。模型组骨骼肌相关蛋白MURF1表达高于假手术组,PGC-1α、FNDC5表达低于假手术组,差异具有统计学意义(P<0.05)。
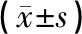
表3 各组大鼠骨骼肌相关蛋白表达比较
2.4 电针对骨骼肌萎缩模型大鼠Akt/mTOR通路的影响
如表4所示,电针组Akt、mTOR、p-Akt及p-mTOR表达高于假手术组和模型组,差异具有统计学意义(P<0.05)。模型组Akt、mTOR、p-Akt及p-mTOR表达低于假手术组,差异具有统计学意义(P<0.05)。见图2。
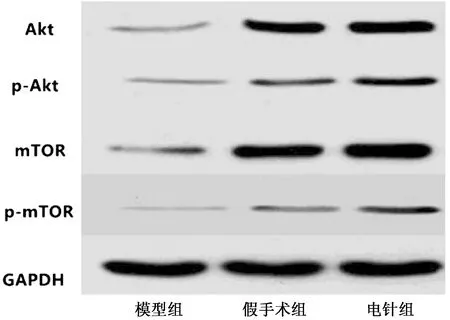
图2 3组大鼠Akt/mTOR通路相关蛋白(WB图)
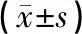
表4 各组大鼠Akt/mTOR通路相关蛋白比较
3 讨论
骨骼肌萎缩发生的主要原因是因为机体中肌蛋白合成显著减少,分解过多,许寿生[5]研究指出,骨骼肌萎缩中蛋白质的分解速度显著大于其合成速度。本研究建立骨骼肌萎缩模型,采用电针进行干预,通过调控Akt/mTOR通路,研究其对骨骼肌萎缩作用机制,为临床治疗骨骼肌萎缩提供理论支持。
本研究结果显示,电针组骨前肌湿重、干重、干重/体重高于模型组,低于假手术组,说明通过电针治疗后,能改善大鼠骨前肌湿重、干重以及干重/体重。肌肉重新获得神经支配,肌肉萎缩速度变快,导致靶肌肉发生了不可逆的萎缩,肌细胞发生纤维化,其神经不能进行再支配[6-7]。电针组骨骼肌肌纤维直径、面积高于模型组,低于假手术组,说明电针能延缓大鼠骨骼肌萎缩的程度,促进其恢复。相关研究指出,电针对增龄性骨骼肌萎缩模型大鼠进行干预,大鼠腓肠肌湿重/体重增加,肌纤维平均横截面积也随之增加[8-9]。苏艳红等[10]研究也指出,采用后肢悬垂法建立骨骼肌萎缩模型,对其腓肠肌上端末梢进行针刺,发现大鼠比目鱼肌湿重/体重比值增加,其横截面积扩大。
骨骼肌是机体中重要的运动器官,也是重要的内分泌器官,机体中多种活性多肽以及细胞因子均通过骨骼肌分泌和合成,对骨骼肌糖、脂肪、蛋白质代谢发挥调控作用[11-12]。MuRF1属于一种泛素蛋白连接酶,在骨骼肌和心肌中表达,泛素蛋白酶有多个调节点,影响因素较多,在骨骼肌萎缩过程中发挥着重要作用[13]。在骨骼肌萎缩模型研究中,MuRF1 mRNA表达水平较高,在代谢发生之前,是诊断早期骨骼肌萎缩的重要指标[14]。本研究显示,模型组大鼠MuRF1蛋白表达较高,本研究与其保持一致。MuRF1具有泛素连接酶活性作用,其表达上调会导致粗丝连接蛋白发生断裂甚至水解,通过降解肌纤维蛋白,导致骨骼肌萎缩,发生病变[15]。本研究结果显示,电针组骨骼肌相关蛋白MURF1表达低于模型组,说明电针干预能下调MURF1表达。FNDC5属于一种肽类激素蛋白主要通过肌肉分泌。PGC-1α属于一种过氧化物酶体增殖物激活受体γ辅激活因子,FNDC5是其主要的依赖性肌肉因子[16]。PGC-1α参与线粒体生成、能量代谢以及肌纤维类型转化过程。相关研究指出,PGC-1α对骨骼肌中的FNDC5有促进作用,通过外部的应激刺激对骨骼肌中的PGC-1α、FNDC5表达有诱导作用,通过断裂能促进肌肉因子Irisin形成[17-18]。本研究显示,电针组PGC-1α、FNDC5表达高于模型组,说明电针能上调PGC-1α、FNDC5表达,从而调控大鼠骨骼肌萎缩情况。
mTOR属于雷帕霉素靶蛋白,Akt可以直接作用于mTOR,因此mTOR是Akt下游的一种底物,发挥着重要作用。研究指出,mTOR是Akt下游的重要靶点,可以被磷酸化Akt激活,调控肌卫星细胞生长主要是通过下游靶物来完成,促进其增殖,有助于相关蛋白质合成,起到延缓骨骼肌萎缩的作用[19-20]。本研究结果证实,电针组Akt、mTOR、p-Akt及p-mTOR表达升高,说明电针能将Akt/mTOR信号通路激活。通过本研究进行分析,电针能有效控制失神经性骨骼肌萎缩的速度,通过调控Akt/mTOR通路相关蛋白表达,促进肌蛋白分解和合成,抑制肌细胞凋亡,促进肌卫星细胞增殖分化,参与神经肌接头传导,促进其肌细胞能量代谢转换,因此电针可治疗骨骼肌萎缩。
综上所述,电针对骨骼肌萎缩模型大鼠干预效果显著,能改善大鼠骨骼肌萎缩状况,通过激活Akt/mTOR通路,调控骨骼肌相关蛋白MURF1、PGC-1α和FNDC5表达,从而抑制骨骼肌萎缩。
