国内外定制式增材制造医疗器械监管法规概述及对行业发展的思考*
2020-10-26吴静刘斌
吴静 刘斌*
增材制造(又称3D打印)是以数字模型为基础,将材料逐层堆积制造出实体物品的新兴制造技术,对传统的工艺流程、生产线、工厂模式、产业链组合产生了深刻影响,是制造业有代表性的颠覆性技术。因其创新工艺,极大拓展产品创新设计,提升产品性能,降低研制周期,减少材料消耗,对医疗产品起到巨大的推动作用。随着增材制造技术在医疗健康领域的应用和发展,衍生出了一类适用于特定个体的定制式增材制造医疗器械,为患者和医生提供个性化医疗。
然而,由于定制式医疗器械是依据特定患者的需求设计,各异性强,产品数量少,无法按照标准化医疗器械的样本量要求去进行临床前试验研究及临床试验研究,因此适用于标准化医疗器械的监管法规及注册体系已不能完全适用于定制式医疗器械产品。基于此,国内外监管当局和学术界也进行了积极的探索和研究。迄今为止,已有多个国家出台了关于定制式增材制造医疗器械产品的监管法规及指南性文件。
本文将对国内外关于定制式增材制造医疗器械的监管法规及注册体系进行分析,以期为该类医疗器械产品的注册及审评提供一定的参考。同时,通过定制式增材制造医疗器械监管法规及注册体系的创新发展,剖析其对于我国定制式增材制造医疗器械行业发展的拉动效应,以期能够为生产企业及监管机构未来的工作提供一定的方向。
1 国外定制式增材制造医疗器械监管法规及注册体系概述
1.1 美国
美国FDA于1976年颁布的Food,Drug and Cosmetic Act(联邦食品、药品和化妆品法案,简称“食药化法”)修订案,首次提出定制式器械。于2012年7月9日颁布的Food and Drug Administration Safety and Innovation Act(食品和药品监管安全和创新法案)补充增加对定制式器械临床使用和上市后监管的要求[1]。从监管法规层面完善了对于定制式医疗器械的监管要求。
2014年9月24日,美国FDA发布了Custom Device Exemption(定制式器械豁免指南)[2]。该指南中明确指出,只有同时满足食药化法第520(b)条款各项要求时,医疗器械才可以被认定为定制式器械。该指南指出,患者匹配器械与定制式器械的差异,通常患者匹配器械是一系列不同的规格范围可被批准用于治疗患者人群,是可以进行临床研究的器械。而定制式器械是用于罕见病症的患者或满足医师独特需求,具有唯一的规格尺寸,难以开展临床研究。定制式器械一种是以患者为中心,另一种是以医师为中心,且无法同时以患者和医师为中心。该指南还指出,定制式医疗器械无需符合上市前批准(Pre-Market Approval,PMA)要求,并且无需遵循强制性性能标准,但不能豁免质量体系规范方面的要求,包括设计控制、医疗器械报告、说明书和标签,以及企业注册和列表等。该指南进一步指出,定制式医疗器械的上市后监管更加严格,规定其每个类型产品每年生产数量不得超过5件,且要求生产企业按规定生产,并每年向FDA上交年度报告。指南中还指出通常不会通过标识或广告来销售最终的定制器械。
2017年12月5日,美国FDA发布了Technical Considerations for Additive Manufactured Devices(增材制造医疗器械相关技术考量)[3]。该指南以增材制造工艺流程图展开,从3D打印设计、软件工作流、材料控制、后期处理和测试考量5个方面阐述了增材制造医疗器械需要考量的技术要素[4]。具体每个方面的考量要点可参见图1所示。
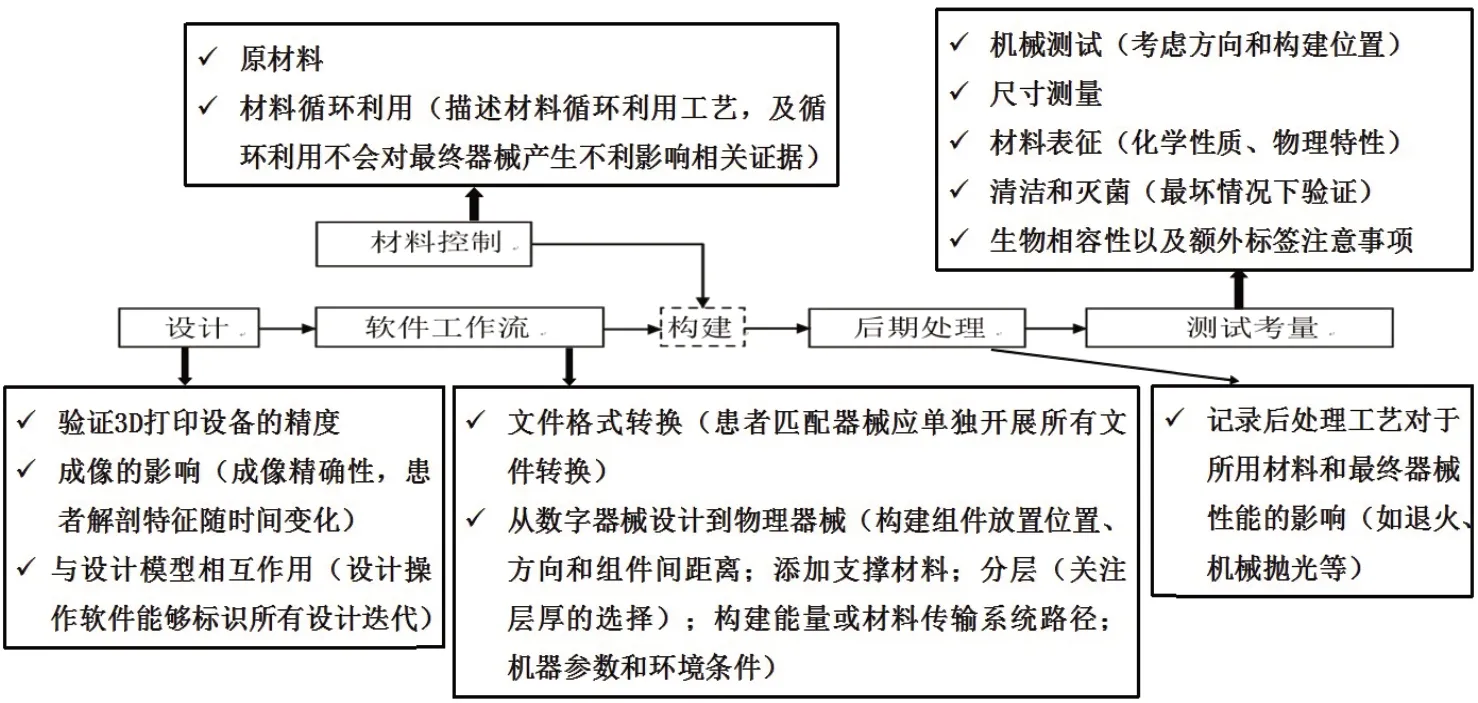
图1 增材制造医疗器械各关键步骤的技术考量
1.2 欧盟
2017年5月5日发布的欧洲议会和理事会关于医疗器械的法规[5]中给出了定制式医疗器械的定义:根据国家法律授权的任何人员的书面处方,凭借该人员的专业资格而专门制造的器械,具有特有的设计特性,计划专用于特定患者,专门满足个人条件和需要。该法规中突出了对定制式医疗器械监管的要求,包括对其生产企业的资质要求,对其设计人员和临床使用机构的要求,以及用于保证定制式医疗器械可追溯性的相关要求等。同时,指出对于高风险定制式医疗器械,其制造商需要取得公告机构的认证。
2009年11月11日发布的Guidance Note For Manufacturers of Custom-made Medical Devices(针对定制式医疗器械制造商的指导性说明)[6],给出了定制式医疗器械投放市场的必要的步骤以及各个步骤中的关注点,可总结概括为图2所示。
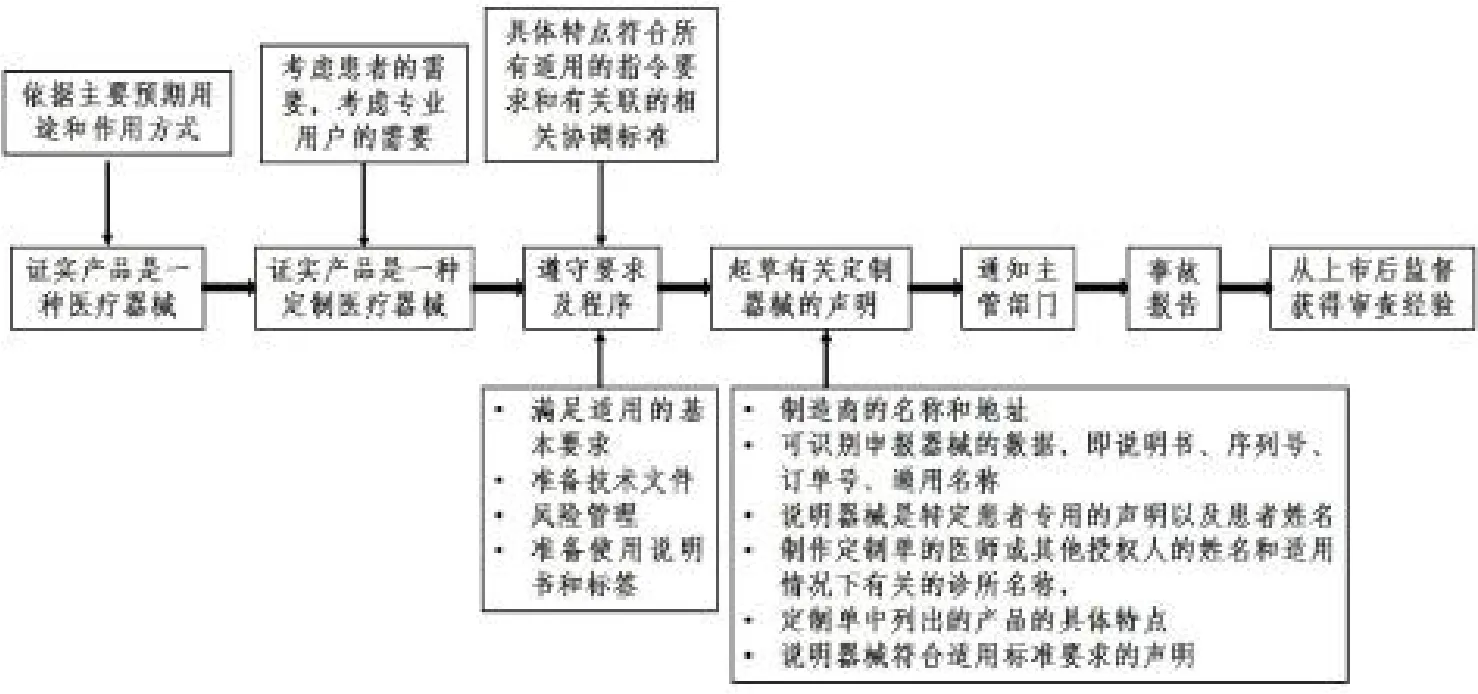
图2 定制式医疗器械上市流程及关注点
1.3 澳大利亚
澳大利亚医疗器械监管部门(Therapeutic Goods Administration,TGA)于2016年2月23日发布的Custom-made Medical Devices,Information for Sponsors,Health Professionals&Manufacturers(给予医疗专业人员和制造商的关于定制式医疗器械的信息)[7]主要明确了定制式医疗器械的定义及监管要求,指出定制式医疗器械应是根据医疗专业人员的具体要求设计,且预期仅用于一个个体,或用来满足一名医疗从业人员操作的特殊需要的器械,并明确患者匹配型医疗器械不属于定制式医疗器械。为便于大众理解,文件中给出了定制式医疗器械的举例。该文件中也明确了监管部门对定制式医疗器械的医疗专业人员和制造商提出的相关要求,用于指导定制式医疗器械的相关工作[8]。随着高风险植入性定制式医疗器械越来越多地应用于临床,现有的针对低风险定制式医疗器械的监管要求显然已不能满足当前的需要。澳大利亚医疗器械监管部门于2019年2月发布了关于定制式医疗器械监管法规的征求意见[9],对定制式医疗器械制造商(进口医疗器械代理商)提出了更高的要求,包括制造商需起草定制式医疗器械的声明并提供给使用该器械的患者,允许TGA对定制式医疗器械生产场地进行现场审查,定制式医疗器械制造商或代理商需向TGA提供销售定制式医疗器械的年度报告,同时提出了植入性定制式医疗器械文件保存的要求。
1.4 加拿大
加拿大医疗器械监管部门于2016年2月18日发布了关于定制式医疗器械的指导原则Guidance for Health Care Professionals on Special Access and Custom-Made Medical Devices[10],该指导原则主要给出了定制式医疗器械的定义,依据医疗人员给出的设计特征的指令生产,不同于常规销售的医疗器械,仅适用于特定患者或者有特殊需求的医疗人员。同时给出了定制式医疗器械应满足的特殊要求,包括定制式医疗器械的申报流程;医疗人员必须向制造商描述定制式医疗器械的设计和要求;Ⅲ类和Ⅳ类定制式医疗器械需要取得进口和销售许可,需要满足法规中规定标签的要求,其中对于标签的要求也同样适用于Ⅰ类和Ⅱ类定制式医疗器械。
1.5 国际医疗器械监管机构论坛
国际医疗器械监管机构论坛(international medical device regulators forum,IMDRF)下设多个工作组,其中个性化医疗器械工作组主要研究个性化医疗器械的术语和监管要求。该工作组于2018年11月7日发布了Definitions for Personalized Medical Devices(个性化医疗器械术语),该指南的发布也意味着国际上对于个性化医疗器械产品认识的初步统一。该指南性文件给出了作为大类的“个性化医疗器械(personalized medical device)”的定义,以及属于个性化医疗器械且按照个性化程度由高到低的“定制式医疗器械(custom-made medical device)”“患者匹配医疗器械(patient-matched medical device)”“适应性医疗器械(adaptable medical device)”的定义,并给出了部分举例。闵玥等[11]在《IMDRF个性化医疗器械术语解读》中对该指南中涉及的术语进行了详细解读。
该工作组于2020年3月18日发布的指南性文件Personalized Medical Devices-Regulatory Pathways[12],给出了定制式医疗器械、患者匹配医疗器械及适应性医疗器械的监管路径和要求。对于个性化程度最高的定制式医疗器械,应满足的上市监管要求也是最高的,除需满足该类别非定制式医疗器械的法规要求及安全有效性的基本要求外,还要求进行计算机模型和模拟方法的验证,以及物理机械性能测试,要求医疗机构将定制式医疗器械与传统治疗方法和已上市可替代器械的风险受益进行对比分析。同时对于制造商也提出了进一步的要求,包括需满足制造和记录保存的要求,提供包含定制式医疗器械详细信息的声明。关于定制式医疗器械的上市,要求其制造商或代理人向器械使用的管辖区的监管当局申报注册或通知。对于定制式医疗器械的上市后监管,要求其制造商或代理人按照监管当局的报告要求上报上市后的不良事件或现场安全纠正措施。
1.6 小结
表1是对美国、欧盟、澳大利亚以及加拿大在定制式医疗器械上市前和上市后监管的比较研究,纵观上述已建立定制式医疗器械监管法规及注册体系的国家,均给出了定制式医疗器械的定义,且突出了医疗专业人员在定制式医疗器械设计开发中的作用。关于定制式医疗器械的上市途径,欧盟和加拿大均从医疗器械的风险等级的角度出发,要求风险等级高的定制式医疗器械需取得上市许可;而美国和澳大利亚目前对于定制式医疗器械走的豁免路径。对于定制式医疗器械上市前和上市后的监管要求,各国间也存在细微差异,但对于上市前的最基本要求不外于要保证产品临床使用的安全有效性,同时相较于常规医疗器械产品,增加了对医疗专业人员的要求。对于上市后的监管要求,主要集中于要求制造商或代理商向主管当局提交不良事件监测报告。而IMDRF这一国际协调组织的存在,定义了个性化医疗器械这个大类,按照个性化程度由高到低又划分为定制式医疗器械、患者匹配医疗器械以及适应性医疗器械,使得国际上对于该大类医疗器械有了基本统一的认识。关于个性化医疗器械的监管要求的指南也将使得国际上对于该大类医疗器械的监管模式进一步协调统一,进而更好地推动全球个性化医疗器械的创新发展。
2 中国定制式增材制造医疗器械监管法规及注册体系概述
我国的《医疗器械注册管理办法》[13]中规定了医疗器械的注册申报要求,但对于为特定个体设计加工以满足患者特殊需求或医护人员特殊操作需求的定制式增材制造医疗器械是无法完全覆盖的。已有的技术审评规范性文件也大多基于标准化医疗器械,对于定制式增材制造医疗器械而言缺乏指导意义。基于上述原因,也使我国医疗器械监管机构不断汲取国外在定制式医疗器械上市前及上市后的监管经验并结合本国国情,努力探索并出台适合我国定制式增材制造医疗器械的法规及规范性文件。
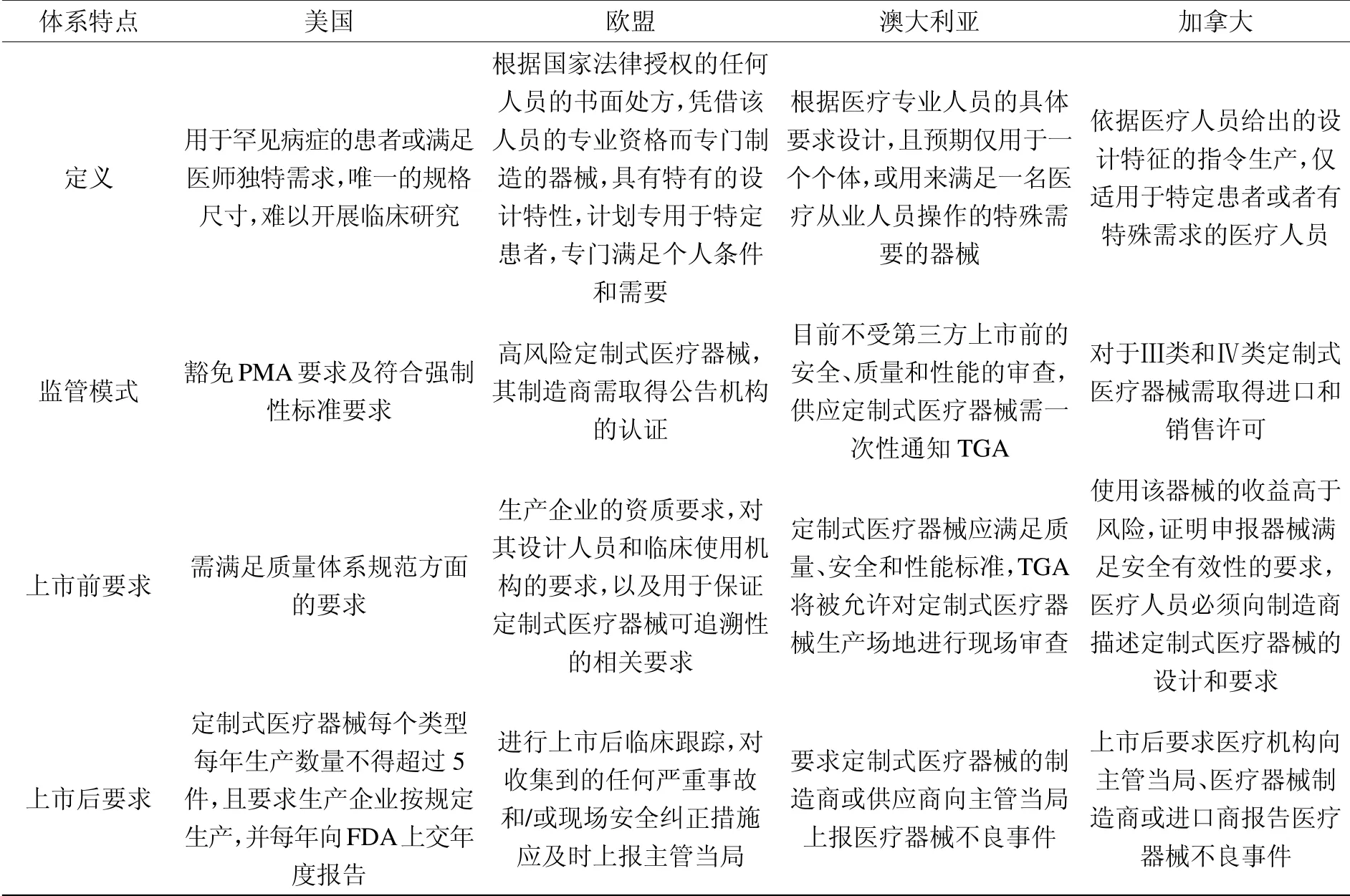
表1 美国、欧盟、澳大利亚及加拿大定制式医疗器械上市前和上市后监管的比较研究
2.1 监管法规
国家药监局联合国家卫生健康委于2019年7月4日发布了《定制式医疗器械监督管理规定(试行)》(以下简称《规定》)[14]。该《规定》中给出了定制式医疗器械和患者匹配医疗器械的定义,且二者均属于个性化医疗器械,其中定制式医疗器械是指为满足指定患者的罕见特殊病损情况,在我国已上市产品难以满足临床需求的情况下,由医疗器械生产企业基于医疗机构特殊临床需求而设计和生产,用于指定患者的、预期能提高诊疗效果的个性化医疗器械。对于定制式医疗器械,因其存在预期使用人数少,难以开展临床试验,为满足特殊临床需求设计生产,用于特定患者等特点,使得该类医疗器械难以通过现行的注册管理模式进行注册,因此对定制式医疗器械实行上市前备案管理。《规定》从备案管理、设计加工、使用管理、监督管理等方面提出了相应的要求,并给出了定制式医疗器械备案资料要求及说明,为该类医疗器械产品的备案提供技术指导。《规定》中强调,患者匹配医疗器械不适用于该《规定》要求,且当定制式医疗器械临床使用病例数及前期研究能够达到上市前审批要求时,应当按照相应的注册法规要求申报注册或者办理备案。
2.2 指导原则
除上述监管法规外,《无源植入性骨、关节及口腔硬组织个性化增材制造医疗器械注册技术审查指导原则(2019年第70号)》[15]于2019年10月16日公开发布。该指导原则的制定是基于定制式增材制造医疗器械的风险,以风险识别、风险控制为核心,贯穿医疗器械全生命周期,在风险可控的前提下,调整事前为必要监管,加强事中、事后监管,体现定制式增材制造医疗器械的内在规律,并加强监管理论制度创新,实现该类医疗器械的科学监管。该指导原则适用于可以实行注册管理的定制式增材制造医疗器械,特针对骨、关节、口腔硬组织无源植入性医疗器械,且为个性化设计适用于特殊病损情况和/或适配特殊解剖结构,同时要求全部或部分通过增材制造加工工艺实现,指导原则中指出患者匹配医疗器械中满足上述条件的也可适用。指导原则从15个方面详述了该类医疗器械产品的技术审查要点,指出该类医疗器械产品的审查重点除产品临床使用的安全性和有效性外,还重点关注实现个性化产品设计、完成增材制造加工的能力和质量,因此指导原则中对产品的研究要求、产品生产制造相关要求以及产品的临床评价要求三大方面进行了详尽的说明。相较于标准化医疗器械产品而言,笔者认为可能最大的差异就在于对产品生产制造方面的要求,指导原则中明确该类产品的生产制造应满足增材制造医疗器械医工交互6个方面的要求,包括设计软件、打印设备、原材料、打印工艺验证、后处理方法及验证、产品测试,并要求从个性化设计、产品交付和产品使用三方面对增材制造医疗器械医工交互能力进行确认。另一大差异可能就在于临床评价的要求,一般情况下该类产品需要通过临床试验的方式来评价安全性及有效性,但由于其本身设计及适用解剖部位的特殊性,可能在对照品选择、样本量设置及临床随访期的设置方面有其特殊性。
2.3 小结
与国外已发布的定制式医疗器械监管法规及注册体系中的内容相比,我国同样给出了定制式医疗器械的定义,突出了其需求由临床医生提出,为满足特殊临床需求设计生产,用于特定患者。我国对于定制式医疗器械的上市途径体现了一种动态监管的理念,先实行备案管理以满足临床急需,当临床使用病例数及前期研究能够达到上市前审批要求时,实行注册管理。我国对于定制式医疗器械上市前和上市后的要求无论是进行备案管理还是满足转化要求实行注册管理,均给出了详细的技术层面及管理层面的要求,为生产企业、医疗机构以及监管机构提供技术指导。
3 医疗器械监管科学研究对定制式增材制造医疗器械行业发展推动作用的思考
已形成的定制式增材制造医疗器械的法规及规范性文件足以看出我国药械监管机构在不断摒弃原有的基于传统基础技术风险控制的评价体系,逐步探究构建适应创新医疗器械的基于精准风险控制的评价监管体系。定制式增材制造医疗器械的设计加工体现了构建良好的医工交互机制的重要性,而监管人员、审评人员作为医疗器械是否满足上市要求的评价主体,应加强与科研、医疗人员间的互动,以共同加快医疗器械研发成果的转化,实现医疗器械的科学监管。
3.1 构建基于精准风险控制的评价监管体系
原有医疗器械评价体系以传统基础技术风险控制为方法,难以充分评价医疗器械,特别是创新医疗器械,因此为更好地推动医疗器械行业发展,要改变原有的评价体系,构建基于精准风险控制的评价监管体系,以医疗器械的临床预期为导向,采用大数据精准风险分析模式,注重客观指标与临床性能的关联性。开展对各类医疗器械不良事件的收集和分析,掌握医疗器械在长期临床使用中出现的风险,挖掘风险产生的本质原因并与器械全生命周期的各个过程建立联系。
3.2 加强监管人员、审评人员与科研、医疗人员间的相互协同作用
监管人员和审评人员是制定政策、法规的主体,以保证产品有法可依,有规可循,保证审评审批工作有理有据,科学公正;科研、医疗人员将是医疗器械产品设计开发的主体,为临床使用中提供更多的创新性医疗器械,满足更广泛的临床需求,并保证产品的可及性。而监管人员、审评人员和科研、医疗人员又有共同的职责,就是要保证医疗器械产品的安全有效性,保证产品的质量是可控的。所以目前鼓励审评审批部门与科研机构、临床机构共同开展课题研究,使得审评审批人员参与研究方案设计、试验过程及结果分析。与科研人员、医疗人员充分沟通,了解产品的设计理念,产品的临床风险,并能够把监管理念和法规安全融入设计研发过程,确保研究结果能够满足产品监管要求。同时科研人员、医疗人员通过与审评审批人员的交流合作,可以了解监管部门对于产品安全有效性的法规和性能要求,有利于科研成果的及时转化。
4 结语
中国精准医疗计划的启动推动了增材制造医疗器械创新发展,定制式医疗器械已由并跑或局部跟跑进入领跑新时代。器械的创新发展使得以传统基础技术风险控制为方法的医疗器械评价体系难以对其进行科学评价。我国应努力构建适应创新医疗器械的监管标准体系和技术保障体系,进一步提高我国医疗器械监管的有效性和精准性,为实现政府监管与医疗器械创新发展相互促进、良性互动提供制度保障、技术保障和理论保障。
