锰氧化微生物及其在土壤环境中的作用*
2020-10-24冯一舰
李 斐 吴 超 张 弛 冯一舰 钟 重
(浙江省生态环境科学设计研究院,浙江 杭州 310007)
锰(Mn)是自然环境中活跃的过渡金属,在微生物的催化作用下Mn(Ⅱ)能被氧化生成生物锰氧化物(Mn(Ⅲ)和Mn(Ⅳ))[1]。生物锰氧化物因其高反应活性和强吸附能力,显著影响环境污染物和营养物质的迁移转化,在多种元素的生物地球化学循环过程中起着非常重要的作用[2]。因此,锰氧化微生物及其代谢产物和代谢机理已经成为当前环境领域的研究热点。本研究主要综述了目前报道的锰氧化微生物分类、锰氧化代谢途径以及生物锰氧化在土壤环境中的作用。
1 锰的形态及微生物氧化作用
地壳中锰的丰度约为0.1%,是仅次于铁(约5%)和钛(约0.5%)的第三大过渡金属[3],广泛分布于土壤、沉积物等各类环境中。锰是生命所需的微量元素,是许多酶和蛋白的辅因子[4]。锰具有多种化合价,包括+2、+3、+4、+5、+6、+7价,但在自然环境中通常以+2、+3、+4价存在,即Mn(Ⅱ)、Mn(Ⅲ)和Mn(Ⅳ)[5]。其中水溶液中+2价还原态的锰离子最为稳定,水溶性最好,一般不易被化学氧化。Mn(Ⅳ)是最主要的氧化态锰,通常以二氧化锰固体的形式存在,具有较强的氧化性。二氧化锰是多种有机和无机物的氧化剂,也是许多化学反应的催化剂,比如双氧水分解产氧反应。近十年,Mn(Ⅲ)成为环境锰循环研究的焦点,已发现络合态Mn(Ⅲ)在沉积物好氧/厌氧交界处、海底孔隙水、含氧水等区域中的含量占总溶解锰的86%甚至100%。Mn(Ⅲ)存在于许多矿物中,常常与Mn(Ⅳ)形成混合价态的氧化物。由于Mn(Ⅲ)既可作为电子受体,又可作为电子供体,因此Mn(Ⅲ)在锰循环中有着举足轻重的作用[6],[7]1244。
在一般环境条件下(pH>3.0),双电子的锰氧化反应,即Mn(Ⅱ)氧化为Mn(Ⅳ),是自发的热力学过程。但在非碱性条件下(pH<8.5),化学锰氧化反应受到动力学限制,反应速率非常缓慢。然而,有微生物催化时,Mn(Ⅱ)氧化速率至少可以提高5个数量级[8]373,[9]。因此,自然环境中生成的锰氧化物,如土壤中的锰结核,一般认为是生物氧化作用的结果。这些生物成因的锰氧化物往往晶型较差,具有很强的吸附性和氧化性,能有效吸附多种重金属,改变重金属的迁移转化规律;也能氧化一些还原性物质,从而促进其他元素的地球化学循环,如硫化物、有机碳等[10]。土壤环境中已经检测到丰富并且活跃的锰氧化微生物以及它们的代谢产物——生物锰氧化物,这说明锰氧化微生物在土壤元素生物地球化学循环以及污染物净化方面起着重要作用[11]2。
2 锰氧化微生物分类
目前已经发现许多细菌可以氧化Mn(Ⅱ),锰氧化细菌主要隶属于低鸟嘌呤(G)和胞嘧啶(C)含量的厚壁菌门(Firmicutes)、高GC含量的放线菌门(Actinobacteria)以及变形菌门(Proteobacteria)的α-变形菌纲、β-变形菌纲和γ-变形菌纲,研究较为深入的锰氧化细菌有芽孢杆菌(Bacillussp.)SG-1、恶臭假单胞菌(Pseudomonasputida)MnB1/GB-1以及生盘纤发菌(Leptothrixdiscophora)SS-1(见表1)[8]373,其他报道的锰氧化细菌还有节杆菌(Arthrobacter)[22]、埃希氏杆菌(Escherichia)、壤霉菌(Agromyces)、纤维单胞菌(Cellulomonas)、贪铜菌(Cupriavidus)、细杆菌(Microbacterium)、罗尔斯顿菌(Ralstonia)、贪噬菌(Variovorax)[11]3、假交替单胞菌(Pseudoalteromonas)、红球菌(Rhodococcus)、盐单胞菌(Halomonas)、产微球茎菌(Microbulbifer)、亚硫酸杆菌(Sultobacter)、交替单胞菌(Alteromonas)[23]、气单胞菌(Aeromonas)[24]、Xuhuaishuia[25]等。目前报道的大多锰氧化细菌同时可以氧化Fe(Ⅱ),但也存在一些细菌只能氧化Fe(Ⅱ),例如披毛菌(Gallionella),另一些细菌只能氧化Mn(Ⅱ),例如锰氧化假单胞菌(Pseudomonasmanganoxidans)[26]。此外,研究者还发现许多真菌也能氧化Mn(Ⅱ),比如:曲霉菌属(Aspergillus)、青霉菌属(Penicillium)、枝孢属(Cladosporium)、支顶孢属(Acremonium)等[27]7383。
3 生物锰氧化代谢途径
目前发现的微生物锰氧化过程由细菌和真菌两大类生物完成。研究发现,细菌的锰氧化活性与细菌的生长有直接关系,通常在生长稳定期的开始阶段,胞内合成锰氧化因子(MOF)并释放到胞外,Mn(Ⅱ)在胞外MOF的催化下氧化为锰氧化物并沉淀于细胞外表面[28]。目前,研究比较深入的锰氧化途径主要有MCOs途径[29]和AHPs途径[21]3935。真菌的锰氧化主要包括非酶促和酶促两类过程,非酶促途径主要是真菌的代谢产物或自身细胞将Mn(Ⅱ)氧化;酶促途径则是真菌分泌酶,通过过氧化氢或酚类等物质的辅助将Mn(Ⅱ)氧化为Mn(Ⅲ)。尽管锰氧化微生物种类繁多,代谢途径多样,但主要的氧化产物一般是二氧化锰,Mn(Ⅱ)氧化为Mn(Ⅳ)由两个连续的单电子反应组成,Mn(Ⅲ)是其中间产物。
3.1 细菌MCOs锰氧化途径
许多细菌利用MCOs家族锰氧化酶进行锰氧化,这些MCOs包括生盘纤发菌SS-1的MofA、恶臭假单胞菌GB-1的MnxG和McoA、芽孢杆菌SG-1的MnxG和CotA、短芽胞杆菌MK-8的CopA以及土微菌ACM的MoxCBA(见表1)。MCOs的催化中心由多个铜原子组成,可以完成从基质到氧分子的单电子转移,其中基质包括Fe(Ⅱ)、Mn(Ⅱ)、木质素等[7]1245。不同来源MCOs氨基酸序列的同源性较低(<20%),但在铜结合位点处都具有非常保守的氨基酸序列,铜结合位点处氨基酸的残基按照一定规则有序排列,可以将铜原子结合在酶的特定位置[30]。研究者认为MCOs家族锰氧化酶的多铜中心包括1个Ⅰ型的铜结合位点以及2个Ⅱ型和1个TypeⅢ组成的3铜催化中心。反应基质首先与TypeⅠ的铜结合位点结合,1个电子由基质转移到铜原子,然后再转移到3铜催化中心,最终转递给氧分子,得电子后的氧分子与质子结合生成水分子[31]。多个宏观和微观的实验已经证实锰氧化菌MCOs的辅因子是铜原子[7]1245。在多铜中心(4个铜原子)处,Mn(Ⅱ)失去1个电子,被氧化为Mn(Ⅲ)。Mn(Ⅲ)离开基质位点,先被转移到持有位点,然后再被转移到双核位点。双核位点的Mn(Ⅲ)将另1个电子传递给持有位点的Mn(Ⅲ),自身氧化为Mn(Ⅳ),并形成氧桥,最终获得产物二氧化锰。持有位点的Mn(Ⅲ)获得电子后,被还原为Mn(Ⅱ),返回到基质位点,进行下一个电子转移反应[8]376。上述Mn(Ⅱ)氧化反应的第2步单电子转移反应,其本质是歧化反应,Mn(Ⅲ)自身发生氧化还原反应,歧化为Mn(Ⅱ)和Mn(Ⅳ)。当然,目前的实验发现并不能排除Mn(Ⅲ)继续被氧气氧化为Mn(Ⅳ)的可能[32]。

表1 典型的锰氧化细菌及其锰氧化酶
3.2 细菌AHPs锰氧化途径
2009年,研究者发现了细菌的另一类锰氧化酶,并命名为MopA,该酶属于AHPs家族,该酶的结构和锰氧化方式与MCOs完全不同[20]4130。根据已有的研究报道,橙单胞菌SI85-9A1、赤杆菌SD-21、恶臭假单胞菌GB-1和玫瑰杆菌AzwK-3b可以利用AHPs进行锰氧化(见表1)。一般认为,前3者通过AHPs直接氧化Mn(Ⅱ),玫瑰杆菌则是利用AHPs产生胞外超氧自由基,再由超氧自由基氧化Mn(Ⅱ)[21]3930。在AHPs的直接氧化过程中,Mn(Ⅱ)首先被氧化成Mn(Ⅲ),在橙单胞菌和赤杆菌的锰氧化反应液中检测到了Mn(Ⅲ)的存在[20]4135。Mn(Ⅲ)再通过歧化反应或者进一步被氧气氧化,生成终产物Mn(Ⅳ)。锰氧化过程属于次级代谢,橙单胞菌和赤杆菌的MopA表达受Mn(Ⅱ)诱导,在无Mn(Ⅱ)的条件下,MopA并不表达[20]4137。早期发现的AHPs通常以过氧化氢作为直接的电子受体,而上述MopA的锰氧化能力并不受过氧化氢含量影响,说明过氧化氢可能不是MopA的直接电子受体[33]。
与直接氧化不同,玫瑰杆菌AzwK-3b氧化Mn(Ⅱ)的过程中有胞外超氧自由基的参与。在反应体系中,研究者检测到了超氧自由基的产生,而添加超氧化物歧化酶(SOD)消耗体系的超氧自由基后,几乎检测不到锰氧化活性;添加过氧化氢酶则并不抑制锰氧化活性[34]。通过添加具有螯合作用的焦磷酸,在该体系中检测到了Mn(Ⅲ)的存在[21]3930。根据上述实验现象,研究者推测玫瑰杆菌AzwK-3b首先利用AHPs产生胞外超氧自由基(见式(1)),超氧自由基将Mn(Ⅱ) 氧化为Mn(Ⅲ),自身还原为过氧化氢(见式(2)),Mn(Ⅲ)通过继续氧化(见式(3))或歧化反应(见式(4))生成Mn(Ⅳ),Mn(Ⅳ)最终生成二氧化锰矿物(见式(5))。此外,研究者认为生成的中间产物过氧化氢应该被迅速分解,以避免将Mn(Ⅲ) 还原为Mn(Ⅱ),所以玫瑰杆菌AzwK-3b可能具有丰富的消耗过氧化氢的酶系,AHPs也可能可以消耗过氧化氢[21]3928。值得注意的是,虽然玫瑰杆菌AzwK-3b被证实是利用胞外超氧自由基实现Mn(Ⅱ)的氧化,然而其他很多能产生胞外超氧自由基的菌株并不能氧化Mn(Ⅱ),这说明玫瑰杆菌AzwK-3b具有其特殊的途径保障胞外超氧自由基对Mn(Ⅱ)的氧化,但具体机理还有待研究[35]。
(1)
(2)
Mn(Ⅲ)+1/4O2+H+→Mn(Ⅳ)+1/2H2O
(3)
Mn(Ⅲ)→1/2Mn(Ⅱ)+1/2Mn(Ⅳ)
(4)
Mn(Ⅳ)+2H2O→MnO2+4H+
(5)
3.3 真菌锰氧化途径
真菌对锰的氧化包括非酶促和酶促两类过程。在非酶促途径中,Mn(Ⅱ)可能被真菌的一些代谢产物或者自身细胞内物质所氧化,比如羟基酸[27]7385。在酶促途径中,真菌分泌的漆酶、木质素过氧化物酶和锰过氧化物酶可以将Mn(Ⅱ)氧化为Mn(Ⅲ)[36]。木质素过氧化物酶和锰过氧化物酶可以催化过氧化氢氧化Mn(Ⅱ),生成Mn(Ⅲ),而漆酶则需要酚类物质的辅助,才能将Mn(Ⅱ)氧化为Mn(Ⅲ)[37]。目前报道的真菌只能将Mn(Ⅱ)氧化为Mn(Ⅲ),最终获得的Mn(Ⅳ)可能由Mn(Ⅲ)的化学歧化反应获得。由于真菌分泌的很多小分子有机酸可以螯合或者还原Mn(Ⅲ),这显著降低了锰氧化物的产生速率[38]。此外,类似于玫瑰杆菌AzwK-3b,研究者发现子囊菌丝状真菌(Stilbellaaciculosa)也是利用胞外超氧化物实现Mn(Ⅱ)的氧化。当胞外超氧化物被清除或者烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶被抑制后,该真菌的锰氧化能力随即消失[39]。
4 土壤环境中生物锰氧化作用
土壤环境中锰含量较高(质量分数约为0.25%),存在丰富的锰氧化微生物和生物锰氧化物。与化学成因的锰氧化物相比,生物锰氧化物具有更差的晶型,因此呈现出更强的氧化性和吸附性。生物锰氧化物可与环境介质中多种无机和有机化合物发生物理化学反应,对土壤、沉积物和地下水中的化学组成与性质具有极大影响。
4.1 重金属污染物的吸附氧化
目前报道的生物锰氧化物中锰元素多以Mn(Ⅳ)存在,晶体基本单元是正八面体结构(MnO6),这些基本单元组成层状结构,晶型接近于δ-MnO2[40-41]。新生成的生物锰氧化物具有较多的Mn(Ⅳ)空缺,呈电负性,在土壤中可以吸附多种重金属污染物,例如:Co(Ⅱ)、Ni(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、As(Ⅲ) 、As(Ⅴ)等,也能吸附未氧化的Mn(Ⅱ)[42-43]。
NELSON等[44-45]研究了生盘纤发菌生成的锰氧化物对Pb(Ⅱ)的吸附特性,并与化学锰氧化物和商业锰氧化物进行对比。结果表明,生盘纤发菌生成的锰氧化物对Pb(Ⅱ)的吸附量可达520 mmol/mol,是化学锰氧化物及商业锰氧化物的2~5倍。TANI等[46]对比了锰氧化真菌KR21-2生成的锰氧化物与化学锰氧化物对重金属的吸附效果,发现生物锰氧化物对Co(Ⅱ)、Ni(Ⅱ)和Zn(Ⅱ)的吸附效率比化学锰氧化物(γ-MnO2)高10倍左右。LIANG等[47]利用微杆菌(Microbacterium)CSA40生成了锰氧化物,该锰氧化物可同时进行As(Ⅲ)氧化和As(Ⅴ)吸附,0.5 g/L的生物锰氧化物可去除污染地下水中90%以上的砷(砷初始质量浓度为1 000 μg/L),被认为是一种环境友好、经济高效的地下水As(Ⅲ)污染修复材料。ZHOU等[48]以恶臭假单胞菌MnB1为菌剂成功制备了纳米级生物锰氧化物,发现该生物锰氧化物对Pb(Ⅱ)、Cd(Ⅱ)和Zn(Ⅱ)的吸附能力是化学锰氧化物的7~8倍。然而需要注意的是,锰氧化物能将低毒性低迁移性的Cr(Ⅲ)氧化为高毒性高迁移性的Cr(Ⅵ),并且生物锰氧化物的氧化速率是化学锰氧化物的7倍[49],[50]166,[51]。因此,当利用生物锰氧化物修复重金属污染土壤时,需考虑Cr(Ⅵ)的次生污染问题。
研究人员也对生物锰氧化物吸附重金属的机理进行了研究。VILLALOBOS等[52]将可能的吸附机理分为两类:(1)静电吸附,在金属阳离子的总吸附比例中约占25%~50%;(2)表面络合吸附,所占比例可以达到50%~75%。此外,WU等[50]165提出了第3种吸附机理:金属阳离子可以在不同空位与锰氧化物结合形成不同的复合物,进入空位的金属阳离子能与晶格中相邻的氧原子形成两种不同的配合物,即3边共享的内层复合体和两边共享的表面复合体。
4.2 有机污染物的氧化降解
生物锰氧化物具有非常强的氧化性,被认为是自然界中氧化能力最强的几种氧化剂之一,可以氧化降解多种土壤有机物,包括除草剂、抗生素以及各种小分子有机物[53-55]。
ZHANG等[56]将δ-MnO2与7种氟喹诺酮类抗菌药物进行反应,结果表明锰氧化物与环丙沙星、恩诺沙星、诺氟沙星和氧氟沙星之间具有良好的反应活性,但与洛美沙星和吡哌酸的反应活性较差,证实了土壤中的锰氧化物在非生物途径降解氟喹诺酮类抗菌药物的过程中起了重要作用。LU等[57]利用类似手段,证实了土壤中二氧化锰对壬基酚有去除作用。LUO等[58]利用Pleosporalessp.Y-5制备了具有层状结构的钴锰氧化物,并将其用于非均相四环素的降解。结果表明钴锰氧化物具有良好的催化性能,反应10 min四环素去除率接近100%。连续重复试验5次后仍能较好去除四环素,表现出良好的重复利用性。FORREZ等[59]利用恶臭假单胞菌MnB1产生的锰氧化物降解双氯芬酸,结果发现在中性pH下,该锰氧化物氧化双氯芬酸的速率比化学合成的二氧化锰快10倍。降解过程中Mn(Ⅱ)质量浓度始终低于0.05 mg/L,说明锰氧化菌可利用被双氯芬酸还原的Mn(Ⅱ)继续产生锰氧化物。KIM等[60]发现7.9 mg/L的微生物锰氧化物可使合成雌激素(1 mg/L)在2 h内降解87%。最近报道发现,往邻苯二甲酸酯和As(Ⅲ)污染的土壤中接种锰氧化微生物,可以同时快速修复受污染土壤,并且不引起土壤土著微生物菌群的明显变化,显著减轻土壤修复导致的土壤板结、肥力降低等副作用[61]。
4.3 对自然界碳素循环的促进
植物根、茎、叶等细胞衰亡后,在土壤中残留大量难降解的颗粒性有机碳(POC),这些POC的降解也被认为与土壤锰氧化有重要关联[62]。在某些土壤中,锰的丰度与POC的氧化速率之间存在很强的正相关关系[63]12349,[64],即锰的生物有效性、迁移性和反应性对POC分解速率有显著影响,对自然界的碳素循环具有促进作用[65]。
SUNDA等[66]发现锰氧化物可将微生物不能直接利用的腐殖酸氧化为小分子有机物,如丙酮、甲醛、乙醛等,这些小分子有机物可作为微生物的生长底物从而促进其生长。锰氧化物,尤其是Mn(Ⅲ)的形成,促进了木质素等生物大分子的降解。Mn(Ⅲ)是Mn(Ⅱ)生物氧化的中间产物,具有非常强的氧化性,但由于其极不稳定,早先它的环境作用并不被关注[67]。在没有螯合剂保护的条件下,Mn(Ⅲ)确实很快歧化为Mn(Ⅱ)和Mn(Ⅳ)。但在微生物活跃的土壤环境中,存在大量Mn(Ⅲ)的螯合剂,比如草酸、柠檬酸、焦磷酸等,这些螯合剂可以稳定Mn(Ⅲ),并使其充分发挥氧化作用[68]。实验已经证实这些螯合剂可以从Mn(Ⅱ)的氧化途径中劫持中间产物Mn(Ⅲ),并将Mn(Ⅲ)与螯合剂结合的复合物释放到环境中。这些Mn(Ⅲ)的螯合复合物具有强氧化性,能够降解一些难降解物质,比如土壤中大量存在的木质素[69-70]。锰在土壤环境中并非均匀分布,还原态锰(Mn(Ⅱ))主要存在于深层土壤的厌氧区。研究发现,在土壤的好氧/厌氧交界面处,存在活跃的锰循环,Mn(Ⅱ)被大量氧化成Mn(Ⅲ),活跃的Mn(Ⅲ)被土壤有机质还原后又可恢复为还原态,该区域被认为是土壤锰氧化微生物的重要生态位,也是锰循环影响土壤碳循环的热点区域[63]12354。土壤好氧/厌氧交界面处活跃的锰循环总结如图1所示。
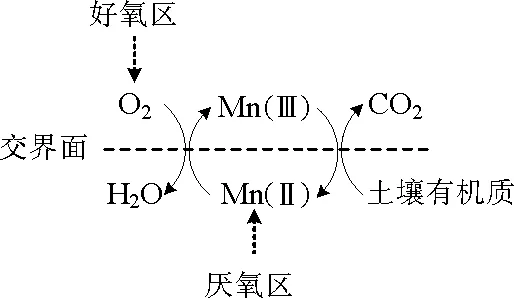
图1 土壤好氧/厌氧交界面处活跃的锰循环Fig.1 Active manganese cycling near oxic/anoxic interfaces in soils
5 展 望
本研究综述了目前报道的锰氧化微生物分类、锰氧化代谢途径以及生物锰氧化物在土壤环境中的重要作用,其中生物锰氧化物的环境作用方面,重点从生物锰氧化物对重金属、有机污染物和POC的吸附、氧化和降解等方面展开讨论。随着分析技术的快速发展以及研究工作的进一步深入,生物锰氧化物在土壤环境中的作用必定会更加清楚。基于目前研究进展,笔者认为未来还可以从以下几个方面开展相关研究:
(1) 目前发现的锰氧化微生物都是异养菌,并不是依靠锰氧化来获得生长代谢所需的能量,生物锰氧化对微生物自身的意义一直存在争议,这关系到生物锰氧化在土壤修复应用中是否需要外来营养源问题,直接关系应用条件及成本。
(2) 生物锰氧化物和有机物之间的界面作用对反应过程的影响尚不清楚,Mn(Ⅲ)与小分子有机物的螯合作用如何影响Mn(Ⅲ)的夺电子能力也尚不清楚,但可以确定的是,螯合作用在促进土壤Mn(Ⅲ)的稳定性和迁移性方面具有显著影响。
(3) 生物锰氧化物和中间产物在土壤环境中的作用还未进行充分研究,目前更多的报道在于其对缓解环境问题的积极意义,是否存在对环境的负面作用及可能的机制还不清楚。生物锰循环强化技术可能未来可用于修复受多种污染物污染的土壤,但处理效果、调控策略、工艺适用性等还有待研究,并应客观评估,充分做好前期试验。
(4) 现有研究多集中在固液两相的简单组分上,而土壤成分复杂,条件控制的难度较大,土壤环境中的其他成分对生物锰氧化物降解污染物的影响程度还有待研究,例如土壤中大量存在的钠、镁、钙离子和小分子可溶性有机物与污染物之间的竞争吸附以及土壤中其他还原性物质对目标物的竞争作用。
