下调HOTA I R 通过提高P T EN表达逆转HCC827细胞吉非替尼耐药
2020-10-23翟阳陈茜王玉珍李旭李丽娜
翟阳 陈茜 王玉珍 李旭 李丽娜
肺癌的发病率和死亡率均居全球及中国恶性肿瘤中的首位,其中约80%以上为非小细胞肺癌(nonsmall cell lung cancer, NSCLC)[1],目前分子靶向治疗已成为NSCLC治疗的主要手段之一,其中以吉非替尼(Gefitinib)为代表的表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factot receptor tyrosine kinase inhibitors,EGFR-TKIs)具有突出的成效,但晚期NSCLC患者一线使用Gefitinib靶向治疗的中位疾病无进展生存时间(progression-free survival, PFS)仅为9.6个月[2],因此,探索EGFR-TKIs耐药机制、寻找逆转耐药的途径成为了亟待解决的问题。
长链非编码RNA(long noncoding RNA, lncRNA)是长度超过200 nt的一类非编码内源性RNA,定位于细胞质及细胞核,因lncRNA缺乏明显的开放阅读框而不能编码蛋白质,但却能够通过转录、转录后及表观遗传学水平对肿瘤细胞的生物学特性进行调控[3-5]。HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)定位于人类染色体12q13.13,长度为2,364bp,既往研究[6-8]表明,HOTAIR异常表达于多种肿瘤细胞,能够通过双向结合多梳蛋白抑制复合体2(polycomb repressive complex 2, PRC2)和赖氨酸特异性去甲基化酶1(lysine specific demethylase 1, LSD1)修饰靶基因组蛋白并使下游基因沉默,同时能够促进上皮-间质化过程并能同肿瘤抑制因子及微小RNA(microRNAs, miRNAs)相互作用,从而调控肿瘤细胞的增殖、分化及凋亡,并参与肿瘤的发生与发展。
既往研究[9]发现,HOTAIR在NSCLC患者组织中呈高表达,且参与了NSCLC的发生发展及侵袭转移的过程。Zhang等[10]研究发现HOTAIR能够通过激活PI3K/Akt信号通路与第10号染色体缺失的张力蛋白同源的磷酸酶基因(phosphatase and tensin homology deleted on chromosome ten, PTEN)结合,从而促进子宫内膜癌细胞增殖。Li等[11]发现在人喉部鳞癌中,HOTAIR可诱导PTEN的甲基化和下调,导致PI3K/AKT通路活性增加,从而促进肿瘤的增殖和转移。Chen等[12]在乳腺癌中也得出了一致的结果。提示我们HOTAIR能够通过激活PTEN/PI3K/AKT信号通路发挥调控肿瘤的作用。
本研究采用质体转染法将体外合成的针对HOTAIR的siRNA转染HCC827GR入细胞中,通过生物信息学预测HOTAIR的靶基因,并应用实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)及Western blot方法检测HOTAIR及PTEN、PI3K、AKT的表达水平,同时采用MTT法检测各组细胞的吉非替尼半抑制浓度(50%inhibitory concentration, IC50),运用流式细胞术分析各组细胞凋亡率及生长周期的变化。从体外实验证明下调HOTAIR表达可以通过调控PTEN/PI3K/AKT通路,抑制HCC827细胞增殖,促进其凋亡,并可以逆转HCC827GR细胞对吉非替尼的耐药,下调HOTAIR表达可能成为逆转NSCLC患者EGFR-TKIs耐药的新策略。
1 材料与方法
1.1 实验材料 收集2019年1月-2020年1月陕西省肿瘤医院确诊的NSCLC患者外周血血清7例,其中吉非替尼治疗有效患者4例,耐药患者3例,男性3例,女性4例,平均年龄(65.7±10.3)岁。人肺癌HCC827细胞株及HCCC827吉非替尼耐药细胞株(HCC827GR)由西安交通大学生物医学中心实验室保存,HCC827GR细胞为前期参考Fumiaki等[13]在文献中提供的方法通过低浓度吉非替尼持续诱导HCC827细胞构建。用CCK-8法检测该细胞对吉非替尼的敏感性,计算IC50在20 μmol/L左右,并且在不加药培养基培养的条件下,相关耐药表型稳定至少6个月,即为构建成功。
1.2 细胞培养 使用RPMI-1640培养基加20%胎牛血清(FBS)和100 U/mL的双抗(均购自美国Hyclone公司),孵箱条件为37 °C,5%CO2,饱和湿度的培养箱中(购自美FOR-MA公司),0.25%胰酶+0.02% EDTA(购自美国Sigma公司)消化、传代。实验选用对数生长期的细胞。
1.3 生物信息 学分析利用Targetscan数据库(http://www.targetscan.org)及Starbase数据库(http://starbase.sysu.edu.cn)预测HOTAIR及PTEN的潜在相关结合位点。
1.4 siRNA转染 按实验需要分为6组:HCC827组、HCC827GR组、HCC827GR/HOTAIR-NC组、HCC827GR/si-HOTAIR组、HCC827GR/HOTAIR-NC+gefitinib组及HCC827GR/si-HOTAIR+gefitinib组。si-HOTAIR序列为5’-UUUUCUACCAGGUCGGUAC-3’,阴性对照(negative control, NC)序列为 5’-UUCUCCGAACGUGUCACGUTT-3’(由上海吉玛制药技术有限公司合成) ,转染前1天将(4-5)×104细胞接种在24孔板上,培养于37 °C、5%CO2、饱和湿度的培养箱中。第二天将稀释好的siRNA和lipofectaminTM2000(购自美国Invitrogen公司)试剂混匀形成siRNA/lipofectamin复合物,100 μL siRNA/Lipofectamin复合物加到含有细胞和培养基的培养板的孔中,放入CO2培养箱中37 °C温育24 h-48 h。
1.5 RT-qPCR 检测HOTAIR、PTEN表达HOTAIR引物上游:5’-TAGGCAAATGTCAGAGGGTT-3’,下游:5’-ACACAAGTAGCAGGGAAAGG-3’;PTEN引物上游:5’-CTATTCCCAGTCAGAGGCGCTAT-3’;下游:5’-TGAACTTGTCTTCCCGTCGTGT-3’;GAPDH: 上游:5’-ATTGATGGAT GCTAFGAGTATT-3’,下游:5’-AGTCTTCTGGGTGGCA GTGA T-3’(由北京鼎国昌盛生物技术有限责任公司合成)。结果判读:扩增完毕后行溶解曲线分析,以GAPDH为内参,采用公式:采用公式:2-ΔΔCq[ΔΔCq = Cq(target gene)- Cq(GAPDH)]计算各指标的mRNA相对表达量。以上步骤重复3次。
1.6 Western blot 检测各组细胞PTEN、PI3K、AKT蛋白表达选择生长良好的细胞,加入蛋白裂解液提取蛋白并采用BCA法定量(BCA蛋白定量试剂盒购自陕西先锋生物科技有限公司),取30 μg蛋白,加入等体积2×loading buffer,煮沸5 min。配制10% SDS-PAGE胶,将凝胶玻璃固定于电泳装置上,加入电泳缓冲液,将样品短暂离心,用微量上样器吸取适量样品,缓慢加入蛋白Marker及样品,之后在外槽中加入适量电泳缓冲液; 电泳、转膜、封闭后加入封闭液稀释好的一抗c-MET及β-actin(稀释比为1:2,000),密封条件下于4 °C 冰箱过夜。洗膜后加入封闭液稀释好的二抗(稀释比为 1:2,000),室温下于摇床上温和摇动2 h。洗膜、发光,ECL显影5 min。采用图像采集系统对X线片结果进行扫描取图,利用Image J 软件对所摄图片进行灰度值分析及比较。各组样品目的蛋白与相应内参的灰度值比值为其最终统计分析数据。每组重复3次。
1.7 MTT法检测细胞的药物敏感性 将HCC827GR细胞用0.25%胰酶+0.02% EDTA消化,接种于96孔板,置于37 °C、5%CO2、饱和湿度的培养箱中培养24 h,每孔中加入不同浓度梯度的吉非替尼,各浓度设5孔,并设调零孔(只有培养液)和对照孔(培养基+药物溶解剂+细胞)。分别培养24 h、48 h、72 h后:每孔加入灭菌的5mg/mL MTT(美国Sigma公司)20 μL,继续培养4 h,弃去培养液,加入DMSO液(美国Sigma公司)150 μL/孔,水平振荡10 min使紫蓝色结晶物充分溶解后置于高通量多功能微板测试(492 nm)测定各孔光吸收值(以A表示),以空白孔调零,取4孔平均值,计算出细胞抑制率IR=(1-A/A0)×100%[A:各药物浓度组光吸收值;A0:未加药物组(对照组) 光吸收值]。
1.8 细胞凋亡率检测 采用Annexin V-PE/7-AAD双染法,应用流式细胞仪检测(购自美国BD公司)HCC827GR细胞凋亡率的变化。取对数生长期细胞,用0.25%胰酶+0.02% EDTA消化,接种于6孔板,培养至对数生长期。再使用 0.25%胰酶(不含EDTA)消化细胞,进行细胞计数,使每个样品约(0.5-1)×106个/mL细胞,加入结合缓冲液500 μL,重悬细胞;室温、避光条件下加入7-AAD染液5 μL(陕西先锋生物科技有限公司) ,室温避光孵育5 min-15 min,再加入Binding buffer 450 μL,混匀,使抗体与细胞充分结合,加入1 μL Annexin V-PE染液,孵育15min,1h内上机检测。
1.9 细胞周期检测 取对数生长期细胞,用0.25%胰酶+0.02% EDTA消化,接种于6孔板,培养至对数生长期。再次使用常规胰酶消化法制成单细胞悬液; 用含3%小牛血清的70%乙醇固定,4 °C保存过夜;取冷存的细胞,1,000 r/min×8 min离心,去上清;PBS洗涤2次;加入150 μL RNase(5 g/L)(美国Sigma公司)和150 μL PI 溶液(50 μg/mL)(美国Sigma公司)于室温避光染色30 min;使用流式细胞仪检测,分析G0期/G1期、 S期、G2期/M期细胞百分比。
1.10Kaplan-MeierPlotter生存分析 从TCGA数据库(http://tcga-data.nci.nih.gov/tcga)中下载肺腺癌患者的临床数据。利用肺腺癌患者的生存时间以及状态数据结合HOTAIR及PTEN基因的表达情况,通过R软件“survminer”包中的surv_cutpoint函数选择最佳的cut-off值并进行Kaplan-Meier生存分析HOTAIR及PTEN基因表达与总生存期(overall survival, OS)的相关性。
1.11 统计学处理 采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(Mean±SD)表示,采用t检验,计数资料比较采用χ2检验,P<0.05表示差异有统计学意义。HOTAIR及PTEN表达与肺腺癌预后的关系采用Kaplan-Meier模型分析及Log-rank检验法,以P<0.05为差异有统计学意义。
2 结果
2.1 HOTAIR在HCC827GR耐药细胞中表达增高 RT-qPCR结果显示HOTAIR在HCC827GR耐药细胞中表达增高(P<0.01,图1),提示HOTAIR可能参与介导吉非替尼耐药。
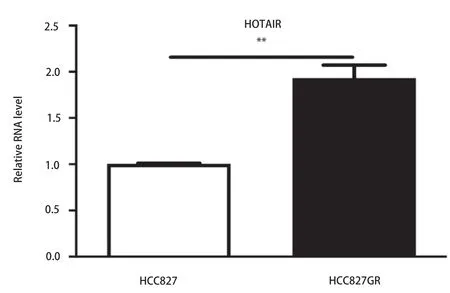
图 1 HOTAIR在HCC827GR耐药细胞中表达增高。Fig 1 The expression of HOTAIR increased in HCC827GR cells. **P<0.01
2.2 下调HOTAIR后HCC827GR细胞中HOTAIR表达降低 RT-qPCR结果显示,HCC827GR/HOTAIR-NC组与HCC827GR组相比无统计学差异,HCC827GR/si-HOTAIR组与HCC827GR/HOTAIR-NC组相比,转染后HCC827GR细胞中HOTAIR mRNA的表达水平下降(70.16±0.57)%,有显著差异(P<0.01,图2)。结果提示si-HOTAIR 转染可显著降低细胞中内源表达的HOTAIR。
2.3 下调HOTAIR逆转HCC827GR细胞对吉非替尼的耐药 MTT检测结果显示吉非替尼对转染前后HCC827GR细胞杀伤作用均随时间及浓度递增,转染后HCC827GR细胞48 h的IC50为(3.15±0.08)μmol/L,较转染前(18.14±0.17)μmol/L明显降低(P<0.01,图3)。
2.4 下调HOTAIR可提高HCC827GR细胞PTEN表达、降低PI3K及AKT表达 RT-qPCR及Western blot法检测分析结果均显示,与HCC827细胞组相比,HCC827GR细胞中PTEN表达水平降低,PI3K及AKT水平升高(P<0.05)。下调HOTAIR后的HCC827GR细胞,相对于阴性对照组,细胞中PTEN的表达水平升高,而PI3K及AKT的表达则较前下降,有显著差异(P<0.01,图4)。
2.5 下调HOTAIR对HCC827GR细胞凋亡及周期的影响 我们用流式细胞仪技术对HCC827细胞、下调HOTAIR后的HCC827GR细胞以及吉非替尼处理过的HCC827GR细胞进行了细胞凋亡的检测。其中将Annexin V阳性7AAD阴性的细胞为凋亡早期细胞,Annexin V和7AAD双阳性的细胞为凋亡晚期或坏死细胞。分析前上机细胞均进行了细胞计数,凋亡细胞参数设为1万。结果显示,与HCC827细胞相比,HCC827GR细胞凋亡率升高,转染组的HCC827GR细胞凋亡率较空白对照组升高(P<0.05),吉非替尼联合转染组的HCC827GR细胞凋亡率较单药吉非替尼处理组明显升高(P<0.05,图5)。HCC827GR细胞中G0期/G1期细胞的含量较低,S期细胞含量较高,而下调 HOTAIR能提高细胞周期中G0期/G1期细胞的含量,与阴性对照组相比,能够抑制HCC827GR细胞从G0期/G1期向S期转变,发生G0期/G1期细胞周期阻滞(P<0.05,图6)。
2.6 吉非替尼耐药后NSCLC患者血清HOTAIR表达水平升高 RT-qPCR结果显示吉非替尼耐药后NSCLC患者血清中HOTAIR的表达水平明显高于吉非替尼治疗有效的NSCLC患者(P<0.05,图7)。
2.7 PTEN及HOTAIR表达与肺腺癌患者的生存的相关性Kaplan-MeierPlotter生存分析结果表明肺腺癌患者的OS与PTEN表达呈正相关,而与HOTAIR表达则呈负相关(P<0.05,图8)。
3 讨论
吉非替尼是首个口服的EGFR-TKIs,2008年IPASS研究结果[14]显示,在腺癌、不吸烟或已戒烟的轻度吸烟者的亚裔晚期NSCLC患者的一线治疗中,与紫杉醇联合卡铂全身化疗相比,吉非替尼组的PFS显著优于化疗组,两组OS无显著差异。NEJGSG002研究[15]证实了IPASS的结果,并提出对于EGFR突变阳性的NSCLC患者,吉非替尼一线治疗优于标准方案化疗。然而在临床中,存在EGFR突变的NSCLC患者吉非替尼的有效维持时间也仅为8个月-10个月,且多数患者容易出现复发,提示此类药物存在较严重的获得性耐药。
虽然大部分的的EGFR-TKIs获得性耐药可用T790M突变及c-MET癌基因的扩增解释,但仍有约30%患者的耐药原因尚不明确[16]。HCC827是EGFR基因19del突变且对吉非替尼敏感的人NSCLC细胞株,我们的前期研究不仅成功构建了吉非替尼耐药细胞株HCC827GR,并且发现PTEN基因与肺癌发生发展有着密切的联系,下调PTEN表达可以诱导肺腺癌HCC827细胞对EGFR-TKIs耐药[17],另有研究[18]显示在NSCLC中,PTEN作为ATK通路上游重要的抑癌基因,可阻止ATK通路的活化,从而阻断ATK调控的下游信号转导,PTEN可能是通过激活PI3K/AKT而减少具有EGFR突变的细胞的凋亡,提示PTEN缺失可能是导致非小细胞肺癌患者对EGFR-TKIs发生耐药的原因之一,但其具体分子机制仍尚不明确。

图 2 下调HOTAIR后HCC827GR细胞中HOTAIR表达降低。Fig 2 The expression of HOTAIR decreased in HCC827GR cells after down-regulation of HOTAIR. ***P<0.001; NS: no significant.

图 3 下调HOTAIR逆转HCC827GR细胞对吉非替尼的耐药Fig 3 Down-regulation of HOTAIR increased the sensitivity of HCC827GR cells to gefitinib. IC50: 50% inhibitory concentration.
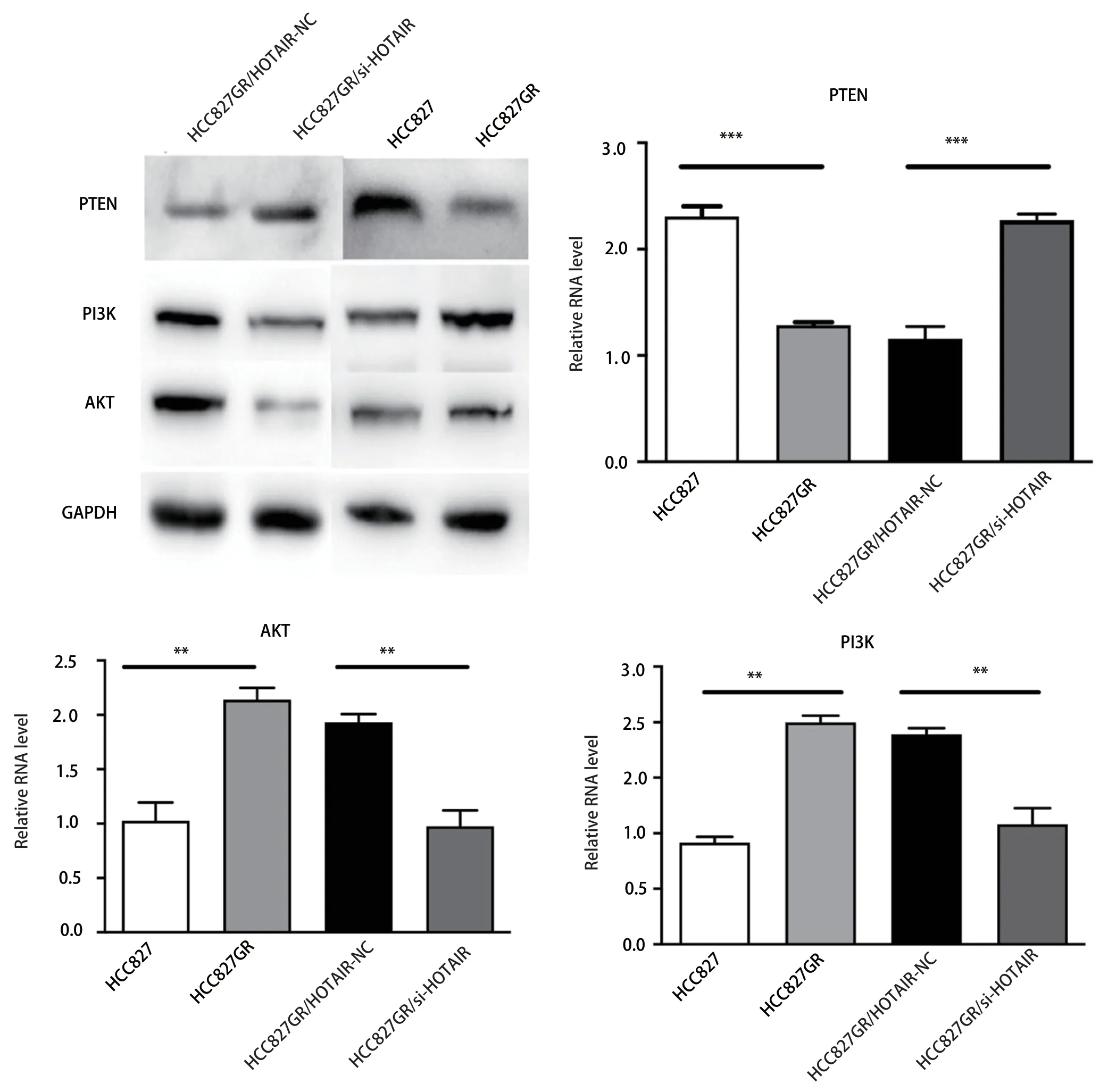
图 4 下调HOTAIR可提高HCC827GR细胞PTEN表达,降低PI3K及AKT表达Fig 4 Down-regulation of HOTAIR can increase the expression of PTEN in HCC827GR cells,and decrease the expression of PI3K and AKT.
近年来新的研究发现,lncRNA可以发挥癌基因及抑癌基因的作用,能够调控基因转录、转录后和表观遗传水平,与调节染色体的蛋白不同,lncRNA发挥作用不必入核,多以顺式调节方式发挥作用。由于lncRNA可以来源于增强子,故其也有增强子样的作用,同时lncRNA在胞浆参与调节mRNA,并可通过表观遗传学调控改变细胞结构和功能状态[19]。大量研究[20-22]表明多种lncRNA参与了肺癌的发生发展,并与肺癌患者的预后及对化疗药物的耐药有密切的关系。HOTAIR是第一个被发现的反义转录lncRNA,可通过招募PRC2使相应组蛋白发生甲基化,进而调控有关侵袭转移基因的表达进而参与癌症的进展[6-7,23]。Nakagawa等[24]发现NSCLC患者肿瘤组织中HOTAIR的表达水平与肿瘤的大小、分化程度及分期呈正相关。我们的研究发现HOTAIR在HCC827GR耐药细胞及吉非替尼耐药患者血清中表达均增高,同时我们还发现下调HOTAIR后,HCC827GR细胞的增殖能力下降,凋亡率升高,并可引起G0期/G1期细胞周期阻滞,同时能够使HCC827GR细胞恢复对吉非替尼的敏感性,提示HOTAIR可能参与介导了NSCLC的吉非替尼耐药。既往已有多项研究提示HOTAIR在子宫内膜癌、喉部鳞癌及乳腺癌中可通过靶向调控PTEN/PI3K/AKT通路促进肿瘤的增殖和转移。Ma等[25]发现HOTAIR能够和miR-130a结合,通过下调miR-130a导致PTEN等基因下调,进而激活AKT信号通路影响肿瘤的恶性表型。我们通过生物信息学分析预测到HOTARI可作为一种竞争性内源性RNA(competing endogenous RNA, ceRNA)与miR-526b-3p、miR-519d-3p及miR106b-5p相互作用,形成ceRNA的竞争机制,而PTEN为miR-526b-3p、miR-519d-3p及miR106b-5p的下游靶基因,提示高表达HOTAIR可导致miRNA对PTEN的抑制力减弱,这与既往多项研究结果不符,考虑因数据库纳入样本量不足及疾病种类不同而此造成偏差。在本研究中,我们也发现下调HOTAIR后,HCC827GR细胞中PTEN表达升高,而PI3K及AKT的表达则较前下降,同时我们从TCGA数据库中下载肺腺癌患者的临床数据,通过生存分析发现肺腺癌患者总生存与PTEN表达呈正相关,而与HOTAIR表达则呈负相关,这与我们的实验研究结果相一致。因此我们推测,HOTAIR可调节PTEN/PI3K/AKT信号通路,通过负反馈作用于PTEN,调控肿瘤细胞的增殖及凋亡,下调HOTAIR表达可以逆转HCC827GR细胞对吉非替尼的耐药。

图 5 下调HOTAIR促进HCC827GR细胞凋亡Fig 5 Down-regulation of HOTAIR promotes the apoptosis of HCC827GR. *P<0.05

图 6 下调HOTAIR抑制HCC827GR细胞增殖(P<0.05)Fig 6 Down-regulation of HOTAIR decreases the cell proliferation ability of HCC827GR (P<0.05)
本研究首次证明了HOTAIR与HCC827细胞对吉非替尼耐药之间的关系及其机制,提示HOTAIR的表达可有助于判断NSCLC患者对EGFR-TKIs类药物的治疗反应,并为NSCLC靶向治疗耐药后的选择提供了新的方向。
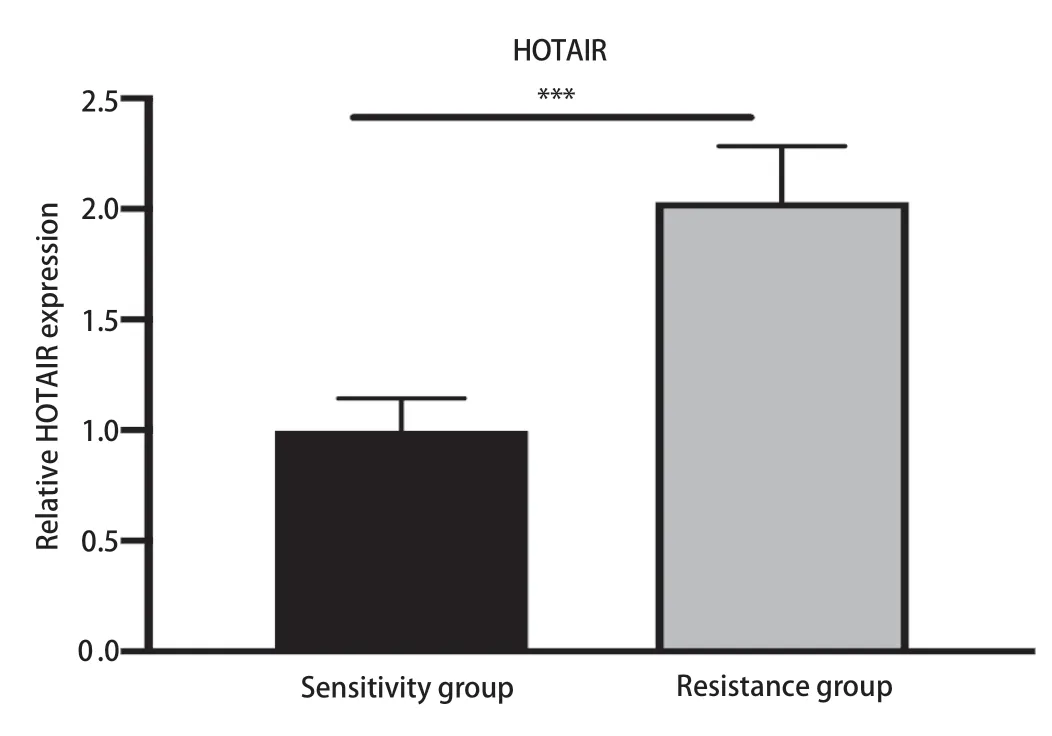
图 7 吉非替尼耐药的NSCLC患者血清中HOTAIR表达升高(P<0.05)Fig 7 The expression of HOTAIR increased in the serum of NSCLC patients with gefitinib resis-tance (P<0.05)
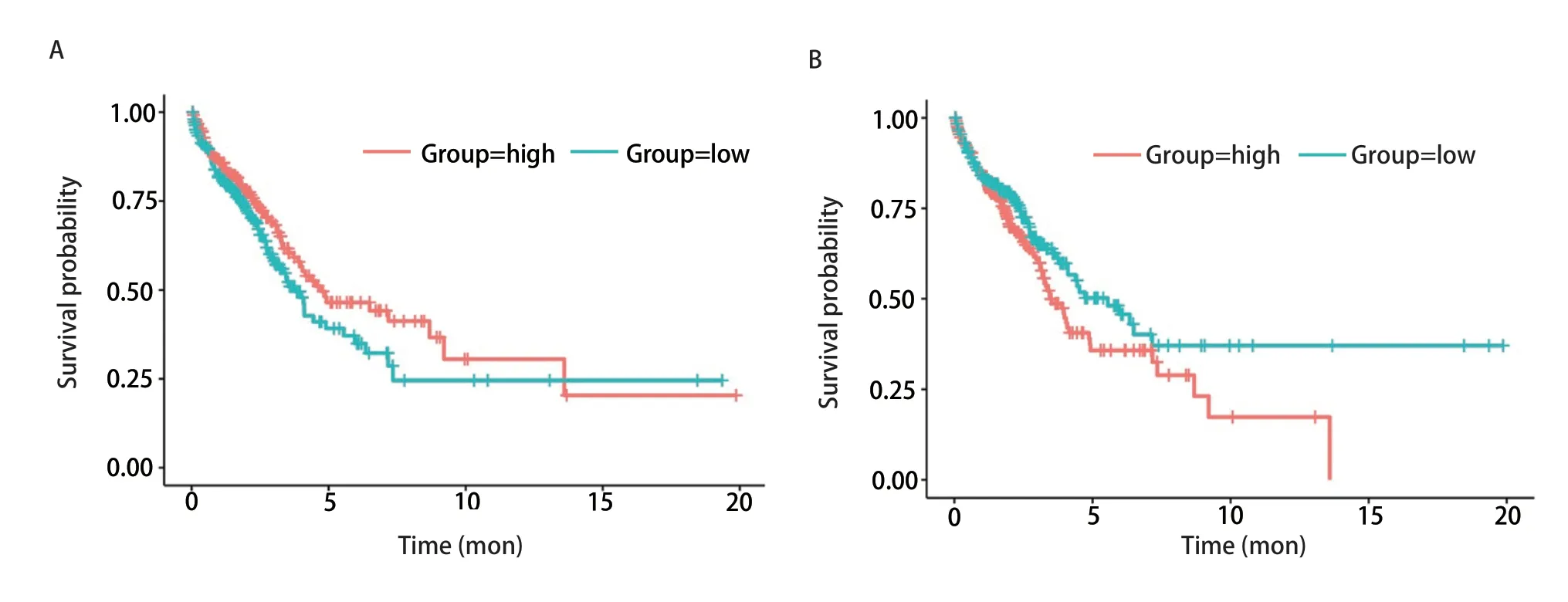
图 8 PTEN(A)及HOTAIR(B)表达与肺腺癌患者的生存的相关性Fig 8 Correlation between the expression of PTEN(A) or HOTAIR(B) and the survival of patients with lung adenocarcinoma
Author contributions
Zhai Y, Li LN and Chen Q conceived and designed the study. Zhai Y and Chen Q performed the experiments. Wang YZ and Li X analyzed the data. Zhai Y and Li LN contributed analysis tools. Zhai Y, Li LN and Chen Q provided critical inputs on design, analysis, and interpretation of the study. All the authors had access to the data. All authors read and approved the final manuscript as submitted.
