人尿液外泌体蛋白质组的糖基化修饰分析
2020-10-22王舒越贾胜男李潇影张海洋陶纬国胡良海
王舒越 贾胜男 李潇影 张海洋 冯 馨 王 诗 陶纬国,4 胡良海*
1(吉林大学生命科学学院, 长春 130023) 2(吉林大学第二医院, 长春 130041) 3(东南大学生物科学与医学工程学院, 南京210096) 4(Purdue University, West Lafayette, IN 47907)
1 引 言
外泌体是由细胞分泌的直径在40~160 nm之间的具有磷脂双分子层的胞外囊泡, 在许多生理进程中发挥至关重要的作用, 如信号传导、抗原反应和免疫应答等[1~5]。外泌体蛋白质的翻译后修饰和疾病的发生发展密切相关[6], 而且许多外泌体表面蛋白以及标志物蛋白均为糖蛋白[7~9]。因此, 深入研究外泌体蛋白的糖基化修饰具有十分重要的意义。
尿液是最为常见的临床生物体液, 可以无创伤地大量获取, 并且含有对肾脏、膀胱、尿道以及前列腺等疾病具有潜在诊断价值的外泌体, 因此, 近年来对尿液外泌体的研究逐渐增多。随着对尿液外泌体研究的深入, 外泌体提取技术也得到了迅速发展[10~12], 如利用外泌体与其它组成成分的密度差异而发展的超速离心提取外泌体的方法, 被视为外泌体提取的黄金标准。 Principe等[13]利用超速离心法提取前列腺癌患者尿液外泌体, 并成功鉴定到约900种蛋白质。然而, 这种方法需要对大量尿液进行长时间离心, 且难以实现与外泌体具有相近密度的蛋白聚合体等其它生物大分子的有效分离, 限制了其在临床上的广泛应用。常用的方法还有基于聚合物将外泌体沉淀的沉淀法(如ExoQuick-TC), 此方法操作简便、快速, 外泌体的提取效率高。Alvarez等[14]对比了超速离心法和沉淀法提取尿液外泌体中蛋白质和mRNA的提取效果, 发现沉淀法提取mRNA和外泌体时比超速离心法的效果更好; 但沉淀法提取蛋白质时, 效果略差, 还需借助体积排阻法进一步提取。体积排阻法也可实现外泌体无损分离, 但长时间的分离需要对液相色谱进行充分的洗脱和平衡, 限制了体积排阻法在外泌体分离方面的高通量应用[15]。此外, 还有利用外泌体表面的特异性蛋白(如CD9和CD63等)进行外泌体提取的免疫法, 虽然这种方法可以高纯度提取外泌体, 但其价格昂贵, 难以广泛使用。尽管尿液外泌体的提取技术有了一定的发展, 然而外泌体糖基化蛋白质组的研究进展还十分有限。早期对外泌体糖基化的研究主要局限于切除糖链后对修饰肽段和蛋白质的研究, 损失了完整糖链的信息。2015年, Saraswat等[16]利用超速离心法提取尿液中的外泌体, 从800 mL尿液中提取到来自37种糖蛋白的126条N-糖基化肽段和51个N-糖基化位点, 首次实现了尿液外泌体糖基化蛋白质组的系统性分析研究。2018年, Bai等[17]利用肼修饰的热敏性聚合物从人源血浆样品中富集出180种N-糖蛋白对应329个位点。2019年, Belczacka等[18]从238名健康人和969名患者(分别患有膀胱癌、前列腺癌、胰腺癌、胆管癌和肾细胞癌)的尿液中提取外泌体, 并进行糖基化分析, 最终在健康人尿液样本中鉴定到37条完整O-糖基化肽段和23条完整N-糖基化肽段, 并通过对不同癌症样品与健康样品之间的糖基化肽段进行定量分析发现, 有3条O-糖基化肽段和5条N-糖基化肽段的丰度变化十分显著。然而, 由于尿液外泌体中糖肽丰度低且缺乏有效的分析方法, 因此, 即使加大样本量也难以实现对其有效富集和鉴定, 更难深入研究。因此, 亟需发展更完善的尿液外泌体糖基化蛋白质组的研究方法。
本研究发展了一种基于外泌体的亲脂性和糖肽的亲水性的尿液外泌体糖基化的研究方法。EVTRAP磁珠[19]是一种表面修饰脂膜的磁珠, 基于其与外泌体的磷脂双分子层之间的疏水亲脂作用, 可实现对尿液外泌体的提取。实验表明, 利用EVTRAP磁珠可以从200 μL尿液样品中提取外泌体, 并鉴定到来自2000种蛋白质的超过16000条非冗余肽段。此方法操作简便, 可以从少量尿液中高效提取出外泌体, 实现对尿液外泌体蛋白质的高通量鉴定分析, 是一种非常适合并能有效提取尿液外泌体的材料。点击麦芽糖材料[20]是一种利用点击化学将麦芽糖修饰在硅球上的材料, 因其表面具有丰富的羟基基团而具有良好的亲水性。相比于其它材料, 如琼脂糖仅可从人源免疫球蛋白酶解液中富集到13条相对高丰度的糖肽, 点击麦芽糖材料可以进行亲水色谱法富集并捕获到27条糖肽, 具有良好的亲水富集效果, 可富集低丰度的糖肽。因此, 本研究利用EVTRAP磁珠与外泌体的磷脂双分子层之间的疏水亲脂作用, 可有效地将外泌体从尿液样品中提取出来, 经过裂解和酶解处理后, 利用具有良好亲水相互作用的点击麦芽糖材料与糖肽的糖链之间的亲水作用, 有效富集外泌体中的糖肽, 结合液相色谱-质谱联用法对尿液外泌体蛋白酶解液和糖肽样品进行检测鉴定, 成功实现了尿液的外泌体糖基化鉴定的规模化分析。
2 实验部分
2.1 仪器与试剂
U3000 RSLC纳升流速液相色谱仪和Orbitrap Fusion Lumos Tribrid质谱仪(美国Thermo公司); 胞内赖氨酸蛋白酶(Lys C)购自美国Thermo公司; 胰蛋白酶(Trypsin)、三乙胺(TEA)、甲酸(FA)、三氟乙酸(TFA)、脱氧胆酸钠(SDC)、月桂酰基氨酸钠(SLS)、三(2-羧乙基)膦(TCEP)、氯乙酸(CAA)、四乙基硼氢化铵(TEAB)、乙酸乙酯(EA), 均购自美国Sigma公司;N-糖酰胺酶F(PNGase F, 美国New England Biolabs公司)。C18膜(美国3M公司); EVTRAP磁珠(美国Tymora公司); 亲水材料点击麦芽糖材料来自大连化学物理研究所梁鑫淼课题组。样品制备实验用水为Milli-Q纯水系统(美国Millipore公司)制备的超纯水。液相色谱使用的乙腈(质谱级)和纯水购自美国Thermo公司。尿液样品由本实验室健康实验人员授权提供。
2.2 实验方法
2.2.1 外泌体提取与蛋白质酶解收集30 mL健康成人尿液, 以2500 g离心10 min, 去除尿液中的杂质和细胞成分。然后, 加入1 mL 0.1% 聚乙二醇辛基苯基醚-乙基苯基聚乙二醇, 涡旋均匀后, 加入450 mL EVTRAP磁珠, 室温条件下翻转孵育1 h。磁性分离, 用1 mL 磷酸盐缓冲液(pH 7.4)配制的0.01% 聚乙二醇辛基苯基醚-乙基苯基聚乙二醇溶液洗涤1次, 用磷酸盐缓冲液洗3次, 最后用200 mL新鲜配制的100 mmol/L 三乙胺涡旋10 min充分洗脱两次, 收集洗脱液,冻干。将冻干样品复溶于100 mL裂解液(12 mmol/L 脱氧胆酸钠,12 mmol/L 月桂酰基氨酸钠,10 mmol/L 三(2-羧乙基)膦,40 mmol/L 氯乙酸, 50 mmol/L 三(羟甲基)氨基甲烷-盐酸缓冲液(pH 8.0))中, 混合均匀后, 95℃水浴10 min, 冷却至室温, 加入5倍体积的50 mmol/L 四乙基硼氢化铵溶液稀释, 然后按酶与蛋白质量比1∶100加入胞内赖氨酸蛋白酶, 37℃酶解反应3 h, 按酶与蛋白的质量比为1∶50补加胰蛋白酶, 37℃继续酶解16 h。酶解结束后, 加入10% 三氟乙酸使其终浓度为1%。向体系中加入等体积的乙酸乙酯, 涡旋2 min后,以17000 g离心3 min, 去除上层乙酸乙酯溶液, 重复洗涤两次, 以去除体系中的表面活性剂, 然后冻干, 使用C18膜填充的除盐小柱进行除盐。除盐后的洗脱液保留100 mL, 冷冻干燥后进行质谱检测, 余下部分经冷冻干燥后, 于-20℃保存, 待糖肽富集。
2.2.2 外泌体糖基化肽段富集使用点击麦芽糖亲水材料对外泌体样品进行糖肽富集。首先, 将冻干样品复溶于200 mL上样溶液(三氟乙酸-乙腈-水(1∶80∶19,V/V))中, 将点击麦芽糖材料用上样液充分分散平衡, 超声15 min后, 离心, 弃溶液, 将样品与富集材料混合, 终体积为200 mL, 室温条件下, 1500 r/min振荡孵育1 h。孵育结束后, 将体系转移至1 mm聚四氟乙烯筛板封端的小柱中, 控制离心转速上样10 min。然后用淋洗液(三氟乙酸-乙腈-水(1∶80∶19,V/V))洗去非特异性吸附肽段。洗涤过程控制时间同上样要求。最后, 用洗脱液(三氟乙酸-乙腈-水(1∶30∶69,V/V))控制转速离心洗脱20 min。将洗脱液冷冻干燥, 于-20℃保存, 待用。
2.2.3 液相色谱-串联质谱联用分析液相色谱-串联质谱分析在U3000 RSLC纳升流速液相色谱-Lumos质谱联用系统上进行。将样品复溶于甲酸-乙腈-水(0.1∶2∶97.9,V/V)溶液中, 然后通过上样到填充C18AQ微球(粒径1.9 mm)的分析柱(长15 cm, 内径150 μm)上。流动相A为甲酸-乙腈-水(0.1∶2∶97.9,V/V)溶液, 流动相B为甲酸-乙腈-水(0.1∶80∶19.9,V/V)溶液。外泌体样品全蛋白分析先以1% B 等度洗脱10 min后, 再进行梯度洗脱(0~3 min, 1%~4% B; 3~63 min, 4%~34% B; 63~75 min, 34%~47% B; 75~78 min, 47~90% B; 78~90 min, 90% B)。 质谱采集一级谱质量窗口为m/z350~1800, 分辨率为240000, 二级谱隔离窗口为m/z0.7。外泌体样品糖基化分析时, 样品经过9 min等梯度上样后, 再进行梯度洗脱(0~3 min, 1%~4% B; 3~63 min, 4%~34% B; 63~75 min, 34%~47% B; 75~80 min, 47%~90% B; 80~90 min, 90% B)。一级谱质量窗口为m/z350~1500, 分辨率为120000, 二级谱隔离窗口为m/z1.6, 二级碎裂采用阶梯碎裂能量模式, 3个阶梯的归一化碎裂能量为22%、27%和32%。
2.2.4 数据检索与分析质谱检测得到的外泌体全蛋白样品数据的原始文件使用Proteome Discover(2.2版本)进行数据检索。使用的数据库为UniProt网站(http://www.uniprot.org)上下载的人源蛋白质数据库(27156种蛋白质, 2019), 数据检索的参数设置为:母离子质量窗口为10 ppm, 子离子质量窗口为0.02 Da, 设定为胰蛋白酶酶切, 漏切位点最多为2个, 半胱氨酸烷基化(+57.0215 Da)为固定修饰, 甲硫氨酸氧化(+15.9949 Da)为可变修饰, 分别控制肽段和蛋白层次上的结果的假阳性率(False positive rate, FDR)不超过1%。质谱检测得到的外泌体糖基化肽段样品数据的原始文件使用pGlyco(2.2版本)进行数据检索。使用数据库为从UniProt网站上下载的人源蛋白质数据库(27156种蛋白质, 2019), 数据检索的参数设置为:母离子质量窗口为5 ppm, 子离子质量窗口为20 ppm, 设置为胰蛋白酶酶切, 漏切位点最多为2个, 半胱氨酸烷基化(+57.0215 Da)为固定修饰, 甲硫氨酸氧化(+15.9949 Da)为可变修饰。检索完成后导出的数据设置总体FDR不超过1%。
3 结果与讨论
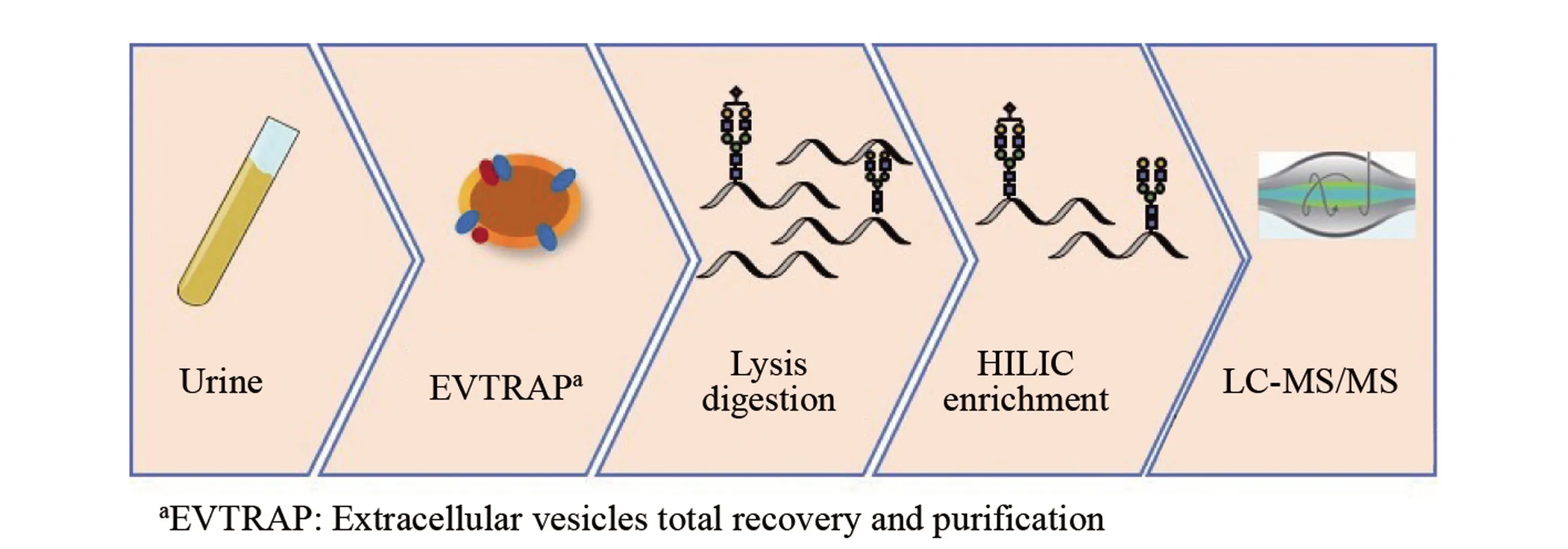
图1 尿液外泌体糖基化修饰分析流程Fig.1 Workflow of urine exosome glycosylation analysis
尿液外泌体糖基化修饰分析的流程如图1所示。 首先, 利用外泌体的磷脂双分子层, 使用EVTRAP磁珠将外泌体从尿液中富集出来; 然后, 将外泌体进行裂解和酶解; 再利用糖基化肽段的亲水特性, 使用点击麦芽糖材料将糖肽从蛋白质酶解液中富集出来; 最后, 结合LC-MS/MS对样品进行检测, 获得尿液外泌体全蛋白组成及其糖基化修饰的表达谱。
3.1 尿液外泌体提取的蛋白质组学评价
首先对EVTRAP磁珠提取人源尿液中的外泌体效果进行评价。将30 mL人源尿液经过低速离心去除细胞碎片等杂质后, 使用EVTRAP磁珠进行富集, 并进行细胞裂解和蛋白质酶解, 利用质谱法进行检测, 共鉴定到1925种非冗余的蛋白质, 对应14233条非冗余肽段,说明EVTRAP磁珠可实现对尿液外泌体的规模化提取。将EVTRAP磁珠提取到的外泌体蛋白质与ExoCarta数据库(http://www.exocarta.org)中外泌体蛋白质进行对比(图2)发现, EVTRAP磁珠提取的外泌体蛋白超过77%收录于ExoCarta数据库, 且数据库中最常鉴定到的100种外泌体蛋白中, 90%以上被EVTRAP磁珠提取鉴定到, 说明EVTRAP磁珠有效实现了大规模且高效的尿液中外泌体的提取。

图2 EVTRAP磁珠提取的外泌体蛋白质与ExoCarta数据库全部外泌体蛋白和前100种最常鉴定的外泌体蛋白对比Fig.2 Comparison of exosome proteins extracted by EVTRAP magnetic beads with the total and the top 100 exosome proteins in ExoCarta database
3.2 尿液外泌体糖基化鉴定分析

图3 外泌体糖基化修饰鉴定结果Fig.3 Glycosylation identification results of urine exosomes
对收集到的外泌体蛋白质酶解液进行糖基化富集。利用点击麦芽糖材料表面丰富的羟基亲水基团所具备的亲水性[20], 对尿液外泌体酶解液中的糖肽进行亲水富集, 将富集到的糖基化肽段通过LC-MS/MS进行检测, 将质谱检测文件利用pGlyco软件进行检索后, 保留假阳性率≤1%的糖肽谱图, 得到外泌体糖基化修饰的结果(图3)。共鉴定到88种非冗余的糖基化蛋白质, 对应分布于156条肽段骨架序列上的135个糖基化位点上的95种糖链组成, 即468条非冗余的完整糖基化肽段, 实现了对尿液外泌体糖基化蛋组的规模化鉴定, 验证了利用EVTRAP磁珠和点击麦芽糖材料结合两步提取富集方法在研究尿液外泌体糖基化蛋白质组中的有效性。
3.3 糖蛋白生物信息学分析
通过DAVID(6.8版本)进行基因功能(Gene Ontology, GO)注释分析, 对获得的外泌体糖基化蛋白质进行进一步确认和分析(图4)。首先从细胞组成上进一步验证利用EVTRAP磁珠和点击麦芽糖材料分析尿液外泌体糖肽方法的有效性, 发现有>89% 的糖蛋白经DAVID数据库分类归属于外泌体(Extracellular exosome), 说明这种方法确实可进行外泌体糖基化蛋白质组学的研究。另外, 所鉴定到的糖蛋白在分子功能上以肝素结合(Heparin binding)和丝氨酸类肽段内切酶的活性(Serine-type endopeptidase activity,serine-type endopeptidase inhibitor activity)为主,存在与免疫球蛋白受体结合(Immunoglobulin receptor binding)相关功能,说明尿液外泌体糖蛋白与多种活性和结合能力相关。从生物学进程上, 鉴定到的糖蛋白与血小板脱粒(Platelet degranulation)、受体调节的内吞作用(Receptor-mediated endocytosis)以及蛋白质水解(Proteolysis)相关,并且也与补体激活经典通路(Complement activation, classical pathway)和先天免疫应答(Innate immune response)有关, 说明尿液外泌体糖蛋白在免疫相关通路上具有一定的作用。

图4 外泌体糖基化蛋白质的基因功能分析:黄色为生物学进程; 绿色为细胞组成; 蓝色为分子功能Fig.4 Gene ontology analysis of exosome glycoproteins: molecular function biological process (yellow bar); cellular composition (green bar); molecular function (blue bar)
对鉴定到的外泌体糖蛋白利用STRING网站(https://string-db.org)进行蛋白相互作用网络分析(Protein-Protein Interaction, PPI)和KEGG富集通路分析(Kyoto Encyclopedia of Genes and Genomes, KEGG)(图5)。将相互作用关系可信度设置为最高级0.900, 发现在这些糖蛋白之间共存在144种相互作用, 具有十分复杂的相互作用关系。通过KEGG通路分析发现存在补体系统(Complement and coagulation cascades)、溶酶体(Lysosome)和肾素血管紧张素系统(Renin-angiotensin system)通路, 说明尿液外泌体糖蛋白在疾病发生和调控方面具有重要作用。同时, 在被鉴定的糖蛋白中, 有36种糖蛋白在疾病标志物相关的研究中鉴定到, 甚至具有作为癌症等疾病的生物标志物的潜力(表1), 说明本方法在研究尿液外泌体糖基化蛋白质组方面具有良好的效果, 可为临床治疗提供更多的理论支持。

图5 尿液外泌体糖基化蛋白的蛋白相互作用网络分析PPI和KEGG富集通路分析Fig.5 Protein-protein interaction (PPI) and Kyoto Encyclopedia of Genes and Genomes (KEGG) analysis of urine exosome glycoproteins
3.4 糖基化修饰分析
基于36种潜在的疾病标志物糖蛋白进行糖基化修饰分析。首先,利用TMHMM SERVER (www.cbs.dtu.dk/services/TMHMM/, 2.0版本)对这些糖蛋白进行跨膜结构域(Transmembrane domain, TMD)预测。如图6所示, 横坐标为36种潜在疾病标志物糖蛋白, 横坐标根据蛋白名称依次排列, 纵坐标为发生糖基化修饰的位点距离跨膜结构域的位置, 正数代表在跨膜域以外, 负数代表在跨膜域以内。如图6所示, 这些蛋白的糖基化位点主要发生在细胞膜外, 这与糖基化修饰的功能有关。N-糖基化主要修饰于细胞膜与细胞核, 细胞膜上的糖蛋白大多参与蛋白、小分子结合以及信号传导。

表1 已报道的潜在疾病标志物的文献中的糖蛋白鉴定情况
这些外泌体糖蛋白的糖基化修饰很可能与递增的外泌体信号相关。其中, 糖蛋白UMOD共鉴定到4个位点发生糖基化, 包括N232、N322、N396和N513, 具有53种不同的糖链组成, 其中N232位点糖链异质性最高, 共有39种糖链组成, 这也体现了糖基化修饰的高度异质性。

图6 潜在疾病标志物糖蛋白的糖基化位点相对于跨膜域的位置分布, 糖基化位点:跨膜区以外(橙色), 跨膜区以内(蓝色) Fig.6 Location of glycosylation sites relative to transmembrane domain of potential disease marker glycoproteins. Glycosylation sites: outside of transmembrane domain (TMD, orange) and inside of TMD (blue)

图7 糖链修饰信息Fig.7 Information of identified glycans
此外, 对所鉴定到的糖链分析发现, 大部分糖链发生了岩藻糖修饰和唾液酸修饰(图7), 其中同时发生岩藻糖修饰和唾液酸修饰的糖链占28.4%, 仅发生岩藻糖修饰的糖链占31.6%, 仅发生唾液酸修饰的糖链占23.2%, 说明尿液外泌体中约80%糖链具有岩藻糖或唾液酸。此外, 仍有9.5%的糖链为高甘露糖型, 并且3.2%的高甘露糖型的糖链同时发生岩藻糖化。研究表明,蛋白质的分子功能受糖链的影响, 如发生核心岩藻糖化修饰的蛋白Hp更能与蛋白Hb形成稳定的复合物; 但发生岩藻糖化的蛋白AGP则大大降低了与华法林的亲和力[28]。尿液外泌体糖基化修饰种类多样, 说明这些糖基化修饰在多种生理进程中具有重要作用。
4 结 论
利用具有亲脂性的EVTRAP磁珠提取尿液外泌体的方法, 从人源尿液中鉴定出1925种非冗余的蛋白质以及14233条肽段, 经过亲水性的点击麦芽糖材料的富集后, 共获得来自88种非冗余的糖基化蛋白质上的468条完整糖肽, 以及135个糖基化位点上的95种糖组成, 实现了对人源尿液外泌体糖基化蛋白质组的规模化鉴定。在完整糖基化肽段层次上分析, 获得了外泌体糖基化修饰的糖链信息, 可为外泌体糖基化修饰的相关研究提供更有效的实验方法和更丰富的理论依据。
