1H-MRS定量分析糖尿病大鼠腓肠肌代谢物早期评估糖尿病周围神经病变
2020-10-22肖叶玉梁晓莹李文艳
陈 杰,肖叶玉,*,梁晓莹,曹 震,李文艳
(1.汕头大学医学院第二附属医院医学影像科,广东 汕头 515041;2.广州市中西医结合医院医学影像科,广东 广州 510800)
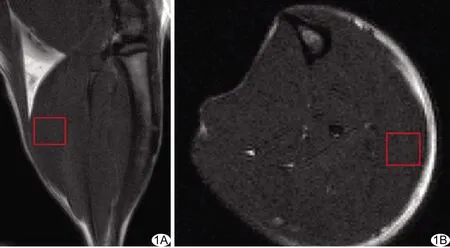
图1 于大鼠右下肢腓肠肌矢状位(A)及轴位(B)MRI定位ROI
糖尿病(diabetes mellitus, DM)是以高血糖为特征的代谢紊乱疾病[1],糖尿病足(diabetic foot, DF)为其常见慢性并发症之一,全球发病率约达6%,且每30 s即有1例患者需截肢[2];正确的预防措施及合理的治疗方法能大幅度减少截肢率[3]。DF的重要病理生理机制之一是糖尿病周围神经病变(diabetic peripheral neuropathy, DPN),相关检查方法有神经传导、振动阈值的检测及皮肤表皮内神经纤维活检[3],但各有其缺陷。氢质子磁共振频谱(Hydrogen-1 magnetic resonance spectrum,1H-MRS)可无创定量检测细胞水平代谢变化,反映骨骼肌代谢状态[4]。本研究探讨1H-MRS定量分析DM大鼠模型下肢骨骼肌代谢物变化对早期评估大鼠DM模型DPN的价值。
1 材料与方法
1.1 实验动物及建立模型 将40只3月龄、体质量约200 g的SPF级SD雄性大鼠(由汕头大学医学院实验动物中心提供)随机分为实验组(n=20)与正常组(n=20)。参照文献[5] 方法,采用高糖高脂饲料喂养+腹腔注射链脲菌素法制造大鼠DM模型。实验组大鼠予高糖高脂饲料喂养30天,之后停饲12 h,按45 mg/kg体质量腹腔注射浓度1%链脲菌素。以注射后1、3、7天剪尾测得随机血糖稳定且均16.7 mmol/L表示DM大鼠模型造模成功,造模后仍予高脂饲料喂养。对正常组大鼠予普通饲料喂养30天,后剪尾监测随机血糖均<16.7 mmol/L。本研究经院动物伦理委员会批准(批准号:SUMC2017-146)。
1.2 仪器与方法 采用安捷伦7.0 T MR小动物成像仪采集图像,配备9563两通道容积线圈。于造模前和造模后7、14、21天以浓度1.5%异氟烷行气道麻醉大鼠后固定其右下肢,采集右下肢腓肠肌MRS。经线圈调谐、3D梯度回波匀场使水峰半高宽<30 Hz,常规3平面定位后,采用单体素波谱PRESS序列采集MRS,尽量避免骨质、肌间隙及脂肪的干扰,于右下肢腓肠肌放置ROI,TR 2 500 ms,TE 15 ms,Average 300,体素3 mm×3 mm×3 mm。见图1。
1.3 数据分析 扫描结束后将数据导入LCModel软件(6.3 version, LCModel),获得胆碱复合物(choline-containing compounds, Cho)、肌酸复合物(creatine compounds, Cr)及细胞内脂质(intra-myocellular lipids, IMCL)的绝对浓度值和Cho/Cr、IMCL/Cr的相对浓度值,并自动拟合生成MRS图。
1.4 测定大鼠坐骨神经电生理传导 于造模后21天扫描结束后,以1 ml/100 g体质量腹腔注射浓度4%水合氯醛深度麻醉大鼠,剥离右下肢皮肤肌肉,尽可能暴露并分离右下肢坐骨神经。将离体坐骨神经置于37℃任氏液中浸泡10 min,待其恢复静息状态后置入干燥的神经屏蔽盒内,采用BL-420肌肉神经实验测定系统(成都泰盟科技有限公司)检测大鼠坐骨神经电生理传导,以刺激器刺激近心端电极,记录刺激电极与记录电极间的距离S,测量动作电位的潜伏期T(自刺激伪迹起始点至动作电位起始点的时间)、运动神经传导速度(motor nerve conduction velocity, MNCV)=S/T,重复电刺激3次,每次刺激间隔10 s,以其均值为最后结果;调换2个电极位置,以同样方法获得感觉神经传导速度(sensory nerve conduction velocity, SNCV)。
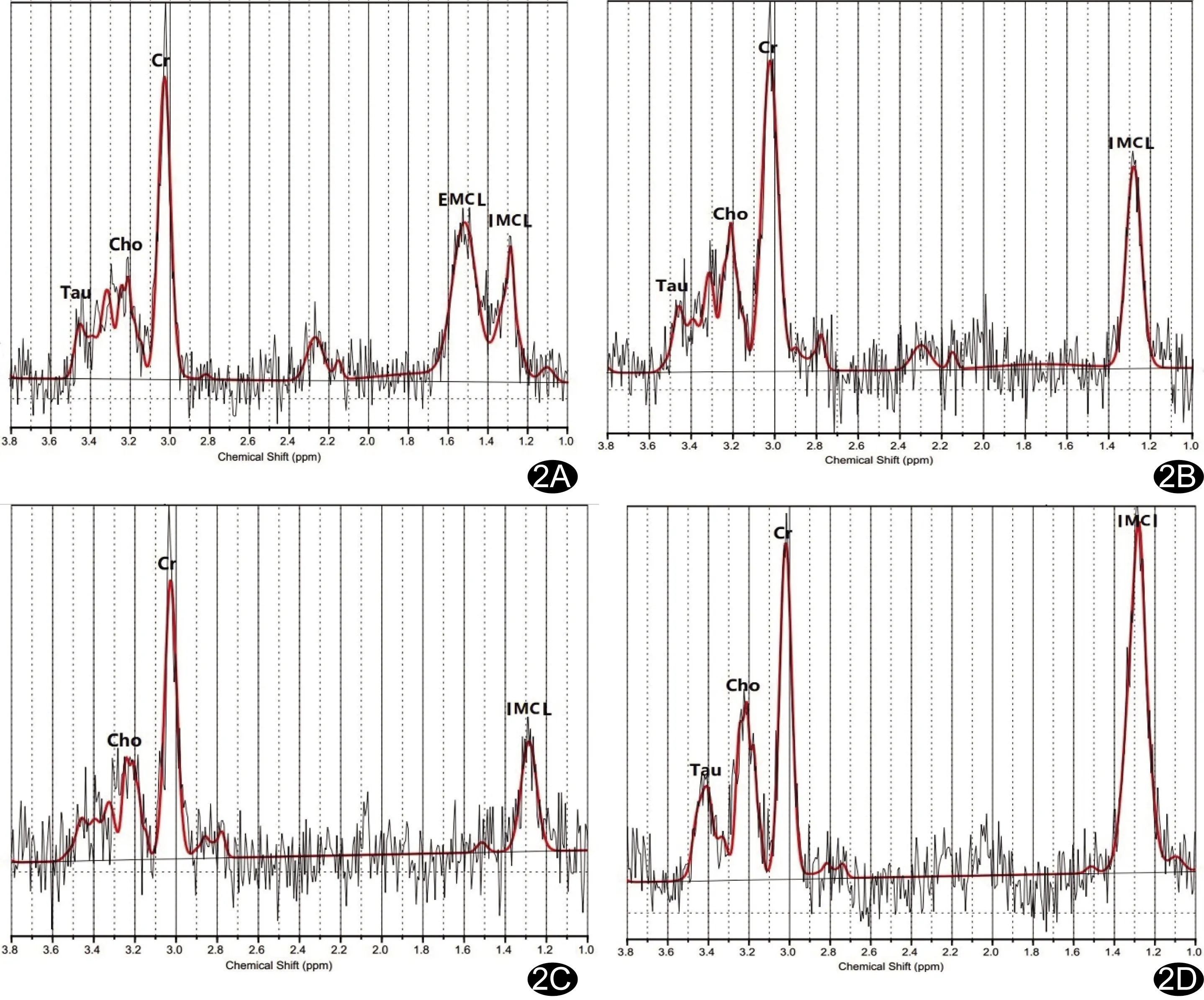
图2 实验组内不同时间点右下肢腓肠肌MRS图 A.造模前; B.造模后7天; C.造模后14天;D.造模后21天
1.5 大鼠坐骨神经HE染色 测定电生理传导后,取1 cm坐骨神经浸泡于浓度10%甲醛溶液,之后常规进行脱水、石蜡包埋、切片及HE染色。
1.6 统计学分析 采用SPSS 21.0统计分析软件。计量资料以±s表示。以Levene检验分析数据的方差齐性。采用单因素方差分析比较实验组内不同时间点代谢物浓度及相对浓度,采用Bonferrioni检验(方差齐)或Games-howell检验(方差不齐)对不同时间点数据进行两两比较;以独立样本t检验比较2组间MNCV及SNCV差异。P<0.05为差异有统计学意义。
2 结果
造模过程中实验组2只大鼠死亡,2只大鼠造模未成功,实验组共16只大鼠、正常组20只大鼠纳入研究。
2.1 实验组内不同时间点右下肢腓肠肌代谢物浓度及相对浓度值比较 不同时间点Cho、Cr、IMCL、Cho/Cr及IMCL/Cr值差异均有统计学意义(P均<0.05)。造模后7天Cho、IMCL及IMCL/Cr值高于造模前(P均<0.05),造模后14天Cho、Cr值与造模前差异有统计学意义(P均<0.05),造模后21天Cho、Cr及Cho/Cr值均高于造模前(P均<0.05),余各时间点两两比较差异均无统计学意义(P均>0.05)。见表1、图2。
表1 实验组大鼠不同时间点右下肢腓肠肌代谢物绝对浓度值及相对浓度值比较(±s)
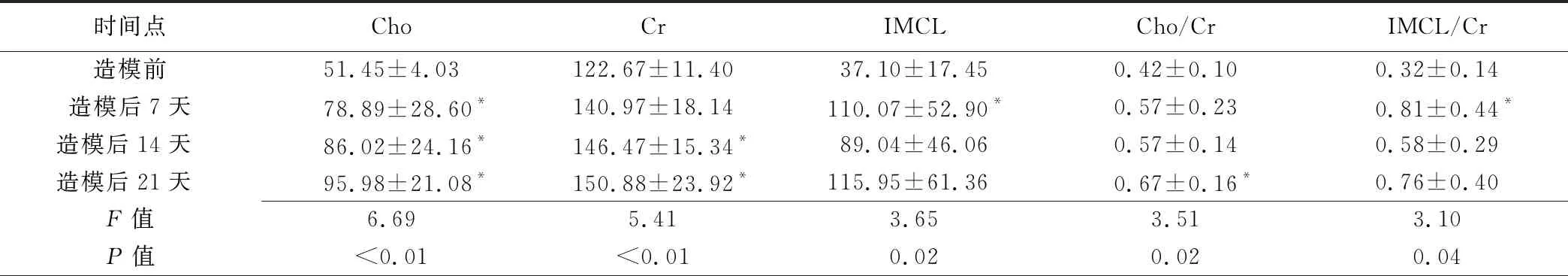
表1 实验组大鼠不同时间点右下肢腓肠肌代谢物绝对浓度值及相对浓度值比较(±s)
时间点ChoCrIMCLCho/CrIMCL/Cr造模前51.45±4.03122.67±11.4037.10±17.450.42±0.100.32±0.14造模后7天 78.89±28.60*140.97±18.14110.07±52.90*0.57±0.230.81±0.44*造模后14天86.02±24.16*146.47±15.34*89.04±46.060.57±0.140.58±0.29造模后21天95.98±21.08*150.88±23.92*115.95±61.360.67±0.16*0.76±0.40F值6.695.413.653.513.10P值<0.01<0.010.020.020.04
注:*:与造模前比较,P<0.05

图3 2组大鼠造模后21天右下肢坐骨神经病理图(HE,×20) A.实验组; B.正常组
2.2 2组大鼠右下肢坐骨神经传导速度比较 造模后21天,实验组大鼠右下肢坐骨神经MNCV及SNCV[(47.89±2.85) m/s、(46.67±3.87) m/s]均较正常组[(55.52±3.38) m/s、(53.48±4.24) m/s]减低(t=2.74、4.62,P均<0.01)。
2.3 病理所见 实验组坐骨神经HE染色见神经纤维尚连续,但纤维之间稀疏松散,排列紊乱,部分髓鞘着色浅且不均匀,轴索变细萎缩;正常组坐骨神经HE染色见神经纤维平行排列规整、密集,均匀分布,粗细均一,髓鞘着色均匀,轴索形态正常。见图3。
3 讨论
目前DM动物模型采用多种动物,以链脲菌素诱导大鼠DM模型最为常用且经济、有效[5]。本研究采用高脂饲料喂养+腹腔注射链脲菌素法制备大鼠DM模型。既往研究[6]认为造模时链脲菌素用量<35 mg/kg体质量为低剂量,40~55 mg/kg体质量为中等剂量,>65 mg/kg体质量为高剂量。本研究于停饲12 h后以中等剂量45 mg/kg体质量腹腔一次性注射链脲菌素,成模率约80%,动物死亡率较低,且成模后实验组大鼠随机血糖稳定。DM大鼠模型造模成功后,DONG等[7]继续予普通饲料喂养8周,发现坐骨神经存在脱髓鞘、轴突萎缩改变。本研究造模成功后继续予高糖高脂饲料喂养21天,发现实验组大鼠右下肢坐骨神经传导速度降低,而病理结果仅发现坐骨神经部分神经纤维之间稀疏,未见明显脱髓鞘及轴索萎缩等表现,证明实验组大鼠处于DPN较早期。
Cho与细胞膜磷脂代谢有关,参与细胞膜合成和转运;正常机体骨骼肌系统中Cho浓度稳定[8]。肿瘤性病变胆碱峰升高提示细胞膜生物合成增加,反映细胞增殖;恶性肿瘤Cho绝对值、Cho/Cr较良性肿瘤明显升高[9]。非肿瘤性病变Cho升高为细胞膜崩解标志[10],脱髓鞘病变早期即出现Cho浓度升高,且持续数月。缺血性脑卒中急性期缺血半暗带中Cho浓度升高,后逐渐下降[10]。本研究实验组造模后Cho值及Cho/Cr值较造模前升高,且随造模时间延长Cho绝对值逐渐升高,可能与神经脱髓鞘所致功能障碍有关。施万细胞为周围神经胶质细胞,高糖状态下易致脱髓鞘改变[11],出现早期DPN症状。本研究中实验组大鼠坐骨神经传导速度减低,病理检查结果示部分髓鞘着色浅且不均匀,轴索变细萎缩,推测大鼠坐骨神经功能受损可能引起神经营养功能障碍,最终导致肌细胞肿胀、胞膜逐渐崩解。
Cr可由机体内源性产生(约1 g/d),亦可从饮食中主要通过肉类摄取 (约1~5 g/d)。约95%的Cr分布于骨骼肌中,是能量利用、储存的重要物质,也是细胞能量代谢的标志[12]。研究[13]发现结扎大鼠下肢血管后,其Cr水平远低于未结扎的DM大鼠及正常大鼠,表明Cr水平与下肢毛细血管及小动脉密度减少有关。VARMA等[14]认为炎性疾病导致Cr水平升高,治疗后可下降。DM导致血管病变的主要机制包括蛋白激酶C激活、氧化应激及炎症反应等引起血管内皮细胞功能障碍,使基底膜增厚,最终血管腔进行性变窄及组织器官供血障碍[15]。本研究实验组造模后14、21天Cr浓度均高于正常组,可能原因在于DM高血糖导致早期下肢血管、肌肉炎症反应,但未出现血管狭窄、毛细血管及小动脉密度减少,血流灌注受限致Cr水平下降。
骨骼肌中的脂质作为能量来源储存于细胞外肌间质脂肪细胞,或以脂滴形式储存于肌肉细胞内,直接与线粒体接触。IMCL含量与肥胖、胰岛素抵抗、2型DM及动脉硬化等疾病相关,加以定量分析具有重要意义[16-17]。对活检组织进行生化分析可定量分型IMCL,但有创,不宜重复,且易受肌细胞外脂质(extra-myocellular lipids, EMCL)干扰引起IMCL水平假性升高。IMCL亚甲基群在脂滴内呈球形,1H-MRS是目前唯一能在体区分IMCL与EMCL的方法[18]。研究[19]发现高胰岛素抵抗2型DM患者骨骼肌IMCL水平升高,本研究结果与之一致,可能与DM导致高糖高脂、诱导线粒体活性氧增加,损伤线粒体、引起线粒体功能障碍,降低线粒体脂肪酸氧化能力,增加细胞内脂质含量有关[20]。
综上所述,1H-MRS可无创定量分析骨骼肌代谢,早期评估大鼠DM模型DPN。
