HPLC一测多评法同时测定慢肝养阴片中7种成分含量
2020-10-22赵志国姚建华王婧宁翟莹莹
赵志国,姚建华,王婧宁,翟莹莹
(1.辽宁中医药大学附属医院制剂管理部,辽宁 沈阳 110032;2.沈阳飞龙药业有限公司,辽宁 本溪 117004)
慢肝养阴片由地黄、党参、五味子、枸杞子等10味中药加工而成,主要用于慢性肝炎、肝炎后综合症的治疗[1]。现代研究表明,慢肝养阴制剂治疗慢性乙型肝炎[2]、病毒性肝炎[3]临床效果显著,可有效降低抗结核药物所致肝损害的发生率,促进患者规律、有效地完成抗结核化疗过程[4-5];其联合替比夫定强化治疗慢性乙型肝炎效果确切[6]。慢肝养阴片现行质量标准[1](国家药品标准YBZ04592009-2016)和文献报道[7-9]中仅对方中五味子醇甲进行定量研究,未对方中所含其他成分进行研究。中药及其制剂,尤其是中成药复方制剂组方药物较多,所含成分多样,通过各成分的整体协同作用达到临床的治疗效果,单一成分的质量控制模式难以全面反映中成药复方制剂的内在质量。高效液相色谱(HPLC)一测多评法利用中药各成分间存在的一定内在函数关系,通过建立内参物与各成分间的相对校正因子,实现同时测定多种成分,已在中药及其制剂的质量控制中得以逐步应用。本文参考质量标志物确认原则,采用HPLC一测多评法对慢肝养阴片方中君药地黄所含代表性成分梓醇、地黄苷D和益母草苷,党参所含主要活性成分党参炔苷和丁香苷,五味子所含代表性成分五味子醇甲和五味子乙素为检测指标,选取五味子醇甲为内参物,对慢肝养阴片中7种成分进行同时测定,为提高和完善慢肝养阴片的质量标准提供有力的数据支持。
1 仪器与试药
1.1 仪器
Agilent 1100型高效液相色谱仪(美国Agilent公司);Waters 1525型高效液相色谱仪(美国Waters公司);MSA125P 电子分析天平(德国Sartorius公司);Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm),Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm),Alltima C18色谱柱(250 mm×4.6 mm,5 μm)。
1.2 试药
丁香苷对照品(批号:111574-201605,CAS号:118-34-3,含量:95.2 %),五味子醇甲对照品(批号:110857-201815,CAS号:7432-28-2,含量:99.7 %),五味子乙素对照品(批号:110765-201813,CAS号:61281-37-6,含量:99.1 %)均来源于中国食品药品检定研究院;益母草苷对照品(批号:16052422,CAS号:52949-83-4,含量:94.6 %,上海同田生物技术股份有限公司);梓醇对照品(批号:PRF8052221,CAS号:2415-24-9,含量:99.9 %),地黄苷D对照品(批号:14061708,CAS号:81720-08-3,含量:98.8%),党参炔苷对照品(批号:PRF8092221,CAS号:136085-37-5,含量:99.0 %)均来源于成都普思生物科技股份有限公司;乙腈为色谱纯,其余试剂均为分析纯。慢肝养阴片(规格:每片重0.4 g,批号:2021809,2021811,2021903)均来源于浙江新明珠药业有限公司。
2 方法与结果
2.1 溶液的制备
2.1.1 单成分对照品储备液 精密称取梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素对照品各适量,加甲醇溶解并制成质量浓度分别为1.182,0.458,0.604,0.982,0.126,1.158,0.692 mg/ml的单成分对照品储备液。
2.1.2 混合对照品溶液 精密吸取2.1.1项下7种单成分对照品储备液2.5 ml,用甲醇稀释至50 ml,制成梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素质量浓度分别为59.1,22.9,30.2,49.1,6.3,57.9,34.6 μg/ml的混合对照品溶液。
2.1.3 供试品溶液 取慢肝养阴片数片,除去薄膜衣后,研成细粉,取1.0 g,精密称定,置入25 ml量瓶,精密加入甲醇25 ml,称重,超声提取30 min,放冷后称重,用甲醇补重后过滤,制成慢肝养阴片供试品溶液。
2.1.4 阴性样品溶液 按国家药品标准YBZ04592009-2016中慢肝养阴片的工艺处方分别制备缺地黄、缺党参、缺五味子的阴性样品,再按上述方法制成阴性样品溶液。
2.2 色谱条件
色谱柱:Diamonsil C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.2 %磷酸溶液(B),梯度洗脱(0~11.0 min,12.0 %A;11.0~25.0 min,12.0 %A→18.0 %A;25.0~39.0 min,18.0 %A→41.0 %A;39.0~52.0 min,41.0 %A→78.0 %A;52.0~60.0 min,78.0 %A→12.0 %A);体积流量:1.0 ml/min;检测波长分别为210 nm(0~25.0 min检测梓醇、地黄苷D和益母草苷)[10-12]、266 nm(25.0~39.0 min检测党参炔苷和丁香苷)[13-14]和250 nm(39.0~60.0 min检测五味子醇甲和五味子乙素)[12];柱温:30 ℃;进样量:10µl。
2.3 专属性试验
分别取2.1.2~2.1.4项下制备的各溶液和空白溶剂,按2.2项色谱条件进样检测,结果梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素峰形对称,与相邻色谱峰分离度均>1.5,理论塔板数按各成分计均≥3500,阴性样品对慢肝养阴片中梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素的测定无干扰。见图1。
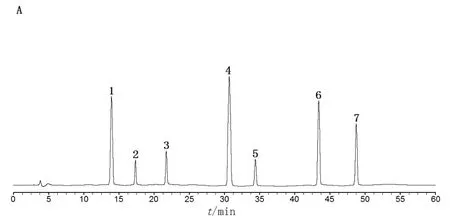
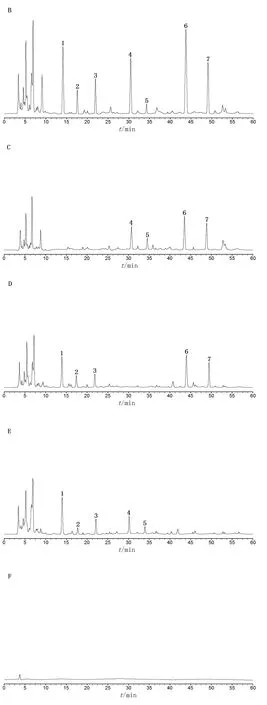
图1 专属性试验HPLC图谱
2.4 方法学考察
2.4.1 线性关系考察 精密吸取2.1.1项下单成分对照品储备液各0.1,0.2,0.5,1.0,1.5,2.5 ml,置入6个20 ml量瓶,分别用甲醇稀释至刻度,制成6个系列浓度混合对照品溶液,按2.2项色谱条件测定,记录梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素色谱峰峰面积,以峰面积为纵坐标(A),质量浓度为横坐标(ρ),绘制标准曲线。结果见表1。
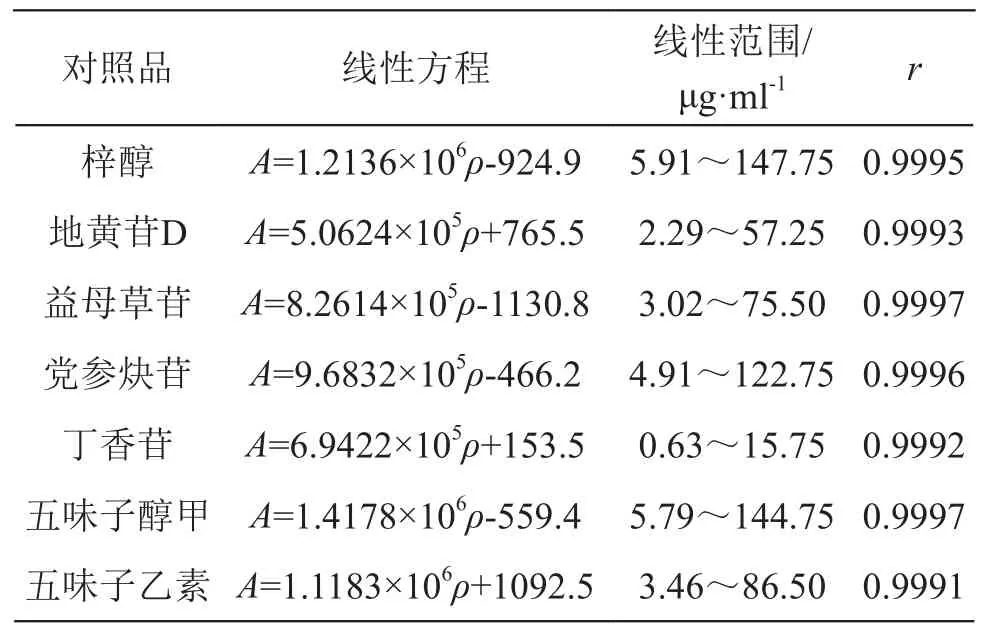
表1 7种成分的线性方程及线性范围
2.4.2 精密度、重复性、稳定性考察 精密吸取2.1.2项下混合对照品溶液,重复进样6次,测得梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素峰面积的RSD分别为0.63 %,1.09 %,0.96 %,0.77 %,1.14 %,0.52 %和0.85 %。
取同一批号慢肝养阴片样品,按2.1.3项下方法平行制备6份供试品溶液,依法进样检测梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素的峰面积,计算得7种成分含量的RSD分别为1.01 %,1.36 %,1.15 %,1.09 %,1.85 %,0.98 %和1.27 %。
取慢肝养阴片供试品溶液,于配制后0,2,4,8,12,18 h,按2.2项色谱条件进样检测梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素色谱峰的峰面积,结果慢肝养阴片供试品溶液18 h内稳定,7种成分峰面积的RSD分别为1.29 %,1.01 %,1.08 %,1.15 %,0.62 %,0.98 %和1.33 %。
2.4.3 加样回收率试验 取7种成分含量已知的慢肝养阴片样品数片,除去薄膜衣,研成细粉,取9份,每份0.5 g,精密称定,随机分成3组,每组3份,分别精密加入混合对照品溶液(梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素质量浓度分别为0.376,0.148,0.211,0.338,0.049,0.433,0.247 mg/ml)1.0,2.0和3.0 ml,使对照品加入量约为样品含有量的50 %,100 %和150 %,再按2.1.3项供试品溶液制备方法制成加样供试品溶液,依法进样检测,7种成分的加样回收率试验结果见表2。
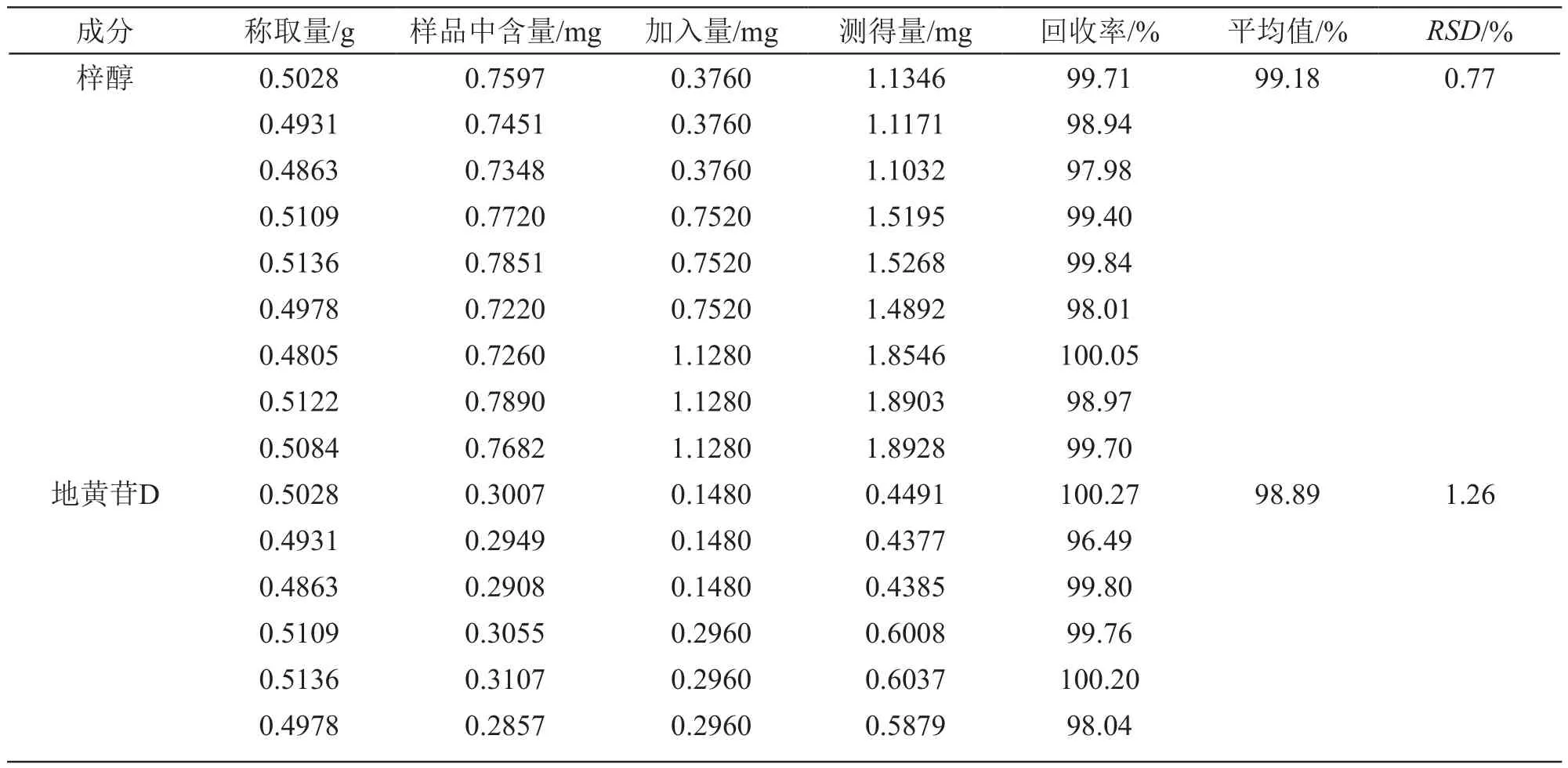
表2 7种成分的加样回收率试验结果
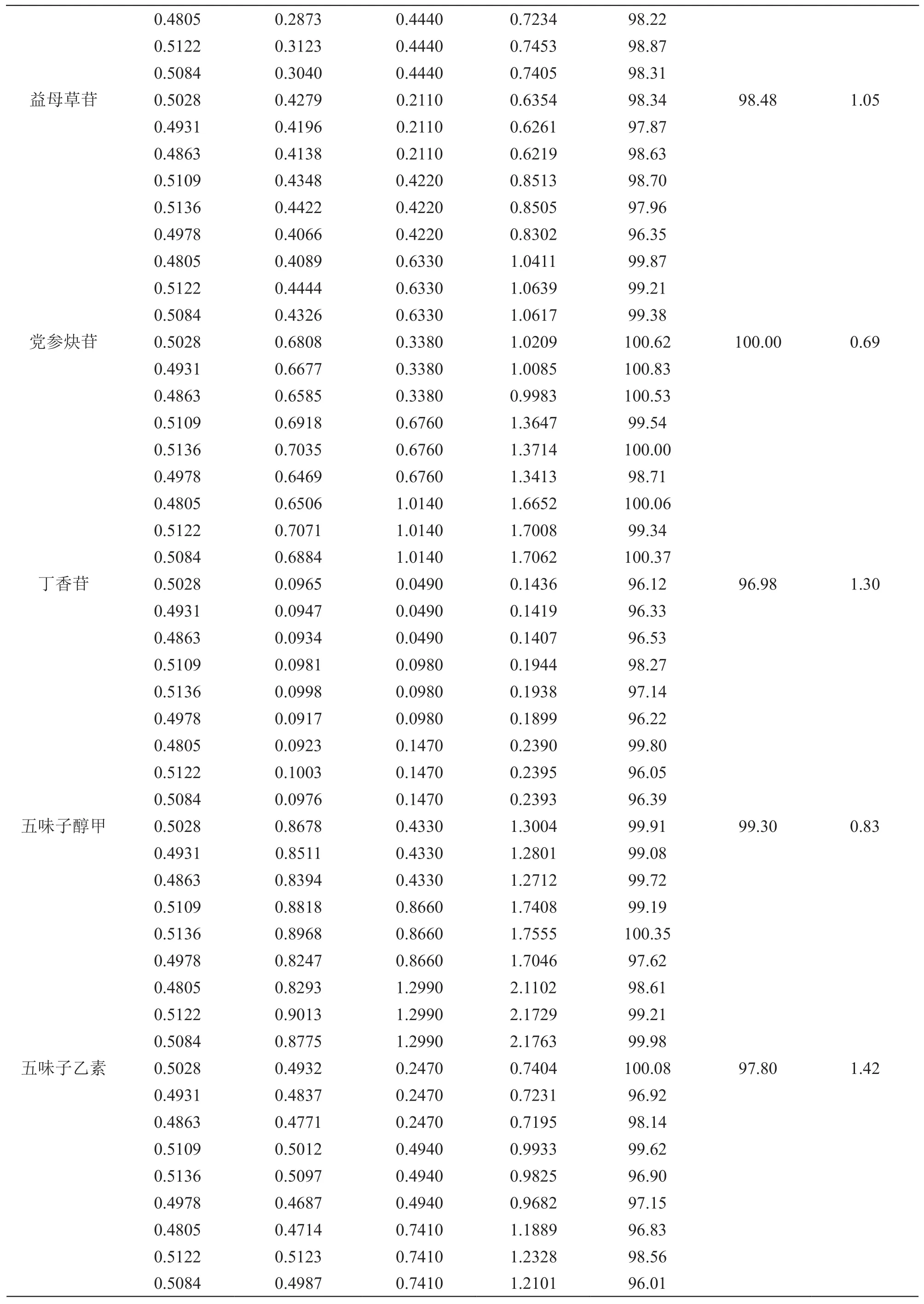
0.4805 0.2873 0.4440 0.7234 98.22 0.5122 0.3123 0.4440 0.7453 98.87 0.5084 0.3040 0.4440 0.7405 98.31益母草苷 0.5028 0.4279 0.2110 0.6354 98.34 98.48 1.05 0.4931 0.4196 0.2110 0.6261 97.87 0.4863 0.4138 0.2110 0.6219 98.63 0.5109 0.4348 0.4220 0.8513 98.70 0.5136 0.4422 0.4220 0.8505 97.96 0.4978 0.4066 0.4220 0.8302 96.35 0.4805 0.4089 0.6330 1.0411 99.87 0.5122 0.4444 0.6330 1.0639 99.21 0.5084 0.4326 0.6330 1.0617 99.38党参炔苷 0.5028 0.6808 0.3380 1.0209 100.62 100.00 0.69 0.4931 0.6677 0.3380 1.0085 100.83 0.4863 0.6585 0.3380 0.9983 100.53 0.5109 0.6918 0.6760 1.3647 99.54 0.5136 0.7035 0.6760 1.3714 100.00 0.4978 0.6469 0.6760 1.3413 98.71 0.4805 0.6506 1.0140 1.6652 100.06 0.5122 0.7071 1.0140 1.7008 99.34 0.5084 0.6884 1.0140 1.7062 100.37丁香苷 0.5028 0.0965 0.0490 0.1436 96.12 96.98 1.30 0.4931 0.0947 0.0490 0.1419 96.33 0.4863 0.0934 0.0490 0.1407 96.53 0.5109 0.0981 0.0980 0.1944 98.27 0.5136 0.0998 0.0980 0.1938 97.14 0.4978 0.0917 0.0980 0.1899 96.22 0.4805 0.0923 0.1470 0.2390 99.80 0.5122 0.1003 0.1470 0.2395 96.05 0.5084 0.0976 0.1470 0.2393 96.39五味子醇甲 0.5028 0.8678 0.4330 1.3004 99.91 99.30 0.83 0.4931 0.8511 0.4330 1.2801 99.08 0.4863 0.8394 0.4330 1.2712 99.72 0.5109 0.8818 0.8660 1.7408 99.19 0.5136 0.8968 0.8660 1.7555 100.35 0.4978 0.8247 0.8660 1.7046 97.62 0.4805 0.8293 1.2990 2.1102 98.61 0.5122 0.9013 1.2990 2.1729 99.21 0.5084 0.8775 1.2990 2.1763 99.98五味子乙素 0.5028 0.4932 0.2470 0.7404 100.08 97.80 1.42 0.4931 0.4837 0.2470 0.7231 96.92 0.4863 0.4771 0.2470 0.7195 98.14 0.5109 0.5012 0.4940 0.9933 99.62 0.5136 0.5097 0.4940 0.9825 96.90 0.4978 0.4687 0.4940 0.9682 97.15 0.4805 0.4714 0.7410 1.1889 96.83 0.5122 0.5123 0.7410 1.2328 98.56 0.5084 0.4987 0.7410 1.2101 96.01
2.5 一测多评法的建立
2.5.1 相对校正因子的计算 精密吸取2.4.1项下制备的6个线性考察混合对照品溶液,依法进样测定梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素色谱峰的峰面积,以五味子醇甲为内参物,按相对校正因子计算公式ƒk/s=ƒk/ƒs=(ρk×As)/(ρs×Ak)(式中ρk为内参物五味子醇甲质量浓度,As为其他待测成分的峰面积,ρs为其他待测成分的质量浓度,Ak为内参物五味子醇甲的峰面积)分别计算梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷和五味子乙素的相对校正因子。结果见表3。
2.5.2 不同仪器、色谱柱对相对校正因子的影响 精密吸取2.1.2项下混合对照品溶液,依法进样测定梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素色谱峰的峰面积,以五味子醇甲为内参物,分别考察2种品牌高效液相色谱仪(Agilent 1100型、Waters 1525型)和3种品牌色谱柱(Diamonsil C18色谱柱、Eclipse XDB-C18色谱柱、Alltima C18色谱柱)对梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷和五味子乙素相对校正因子的影响,结果见表4。
2.5.3 不同流速对相对校正因子的影响 精密吸取2.1.2项下混合对照品溶液,依法进样测定梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素色谱峰的峰面积,以五味子醇甲为内参物,分别考察不同流速(0.8,0.9,1.0,1.1,1.2 ml/min)对梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷和五味子乙素相对校正因子的影响,结果见表5。
2.5.4 不同实验人员对相对校正因子的影响 精密吸取2.1.2项下混合对照品溶液,依法进样测定梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素色谱峰的峰面积,以五味子醇甲为内参物,分别考察3名实验人员对梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷和五味子乙素相对校正因子的影响,结果见表6。
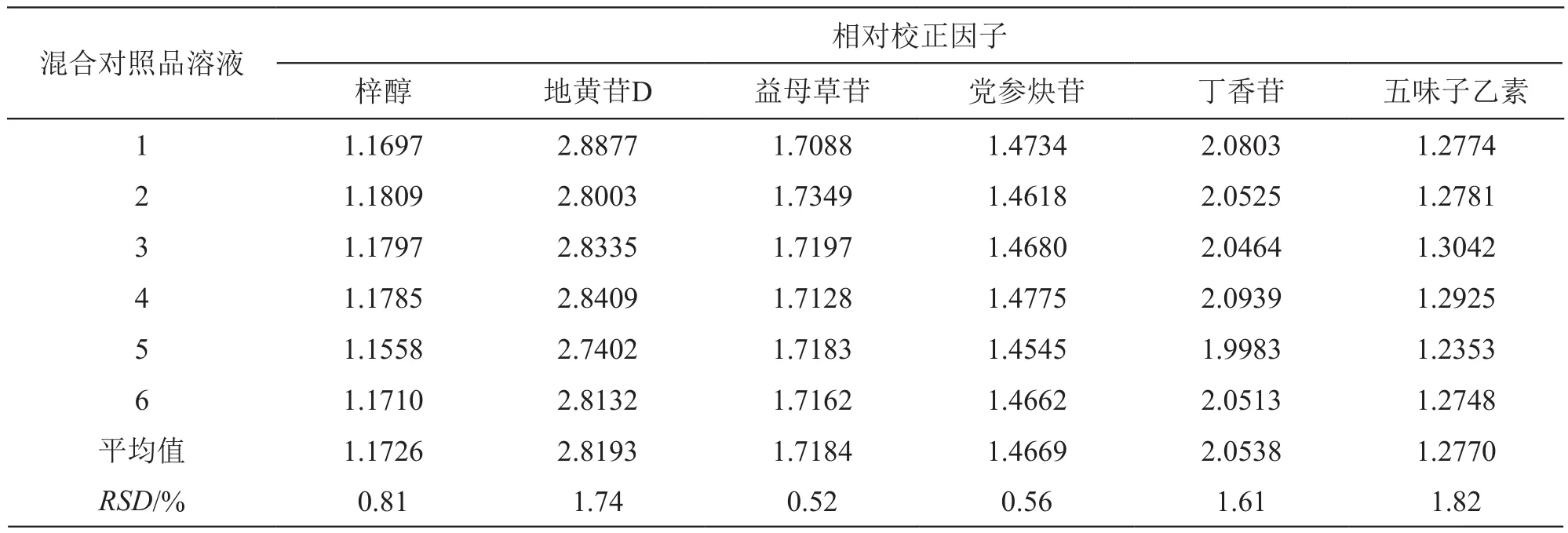
表3 慢肝养阴片中各成分的相对校正因子
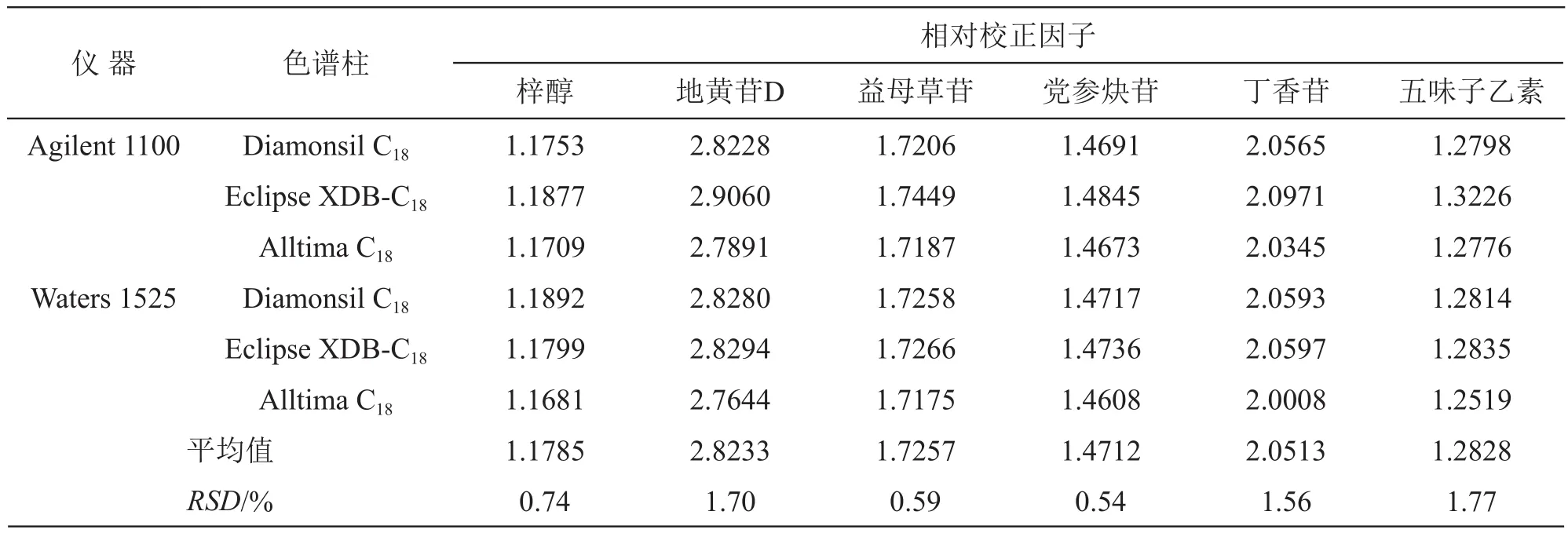
表4 不同仪器、色谱柱对相对校正因子的影响
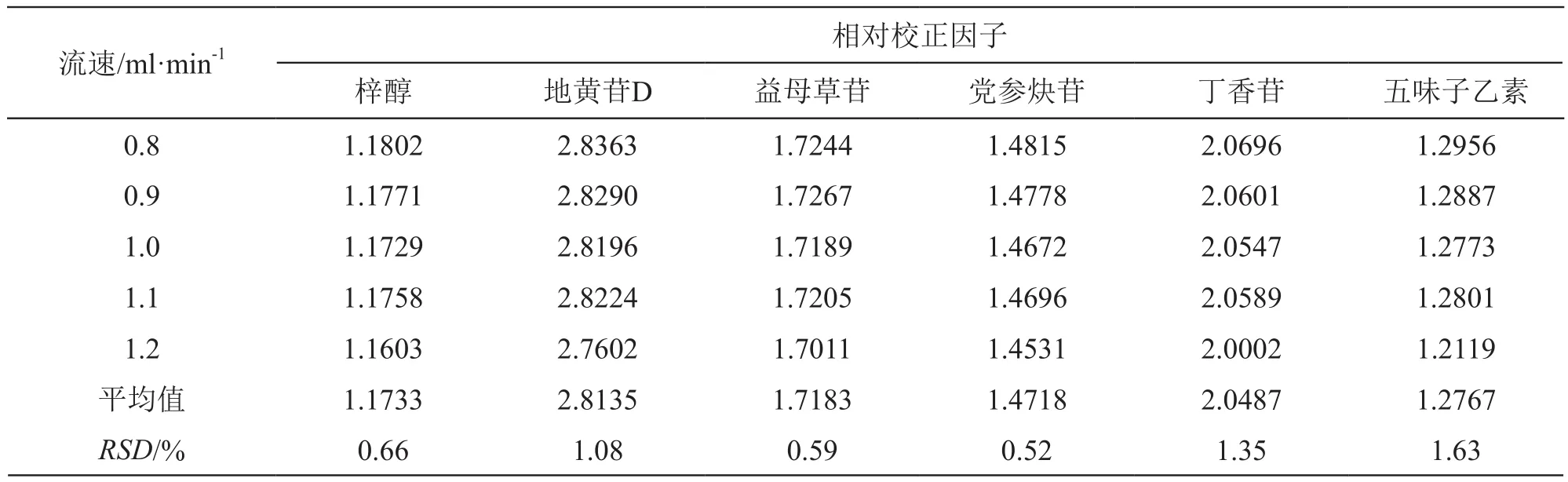
表5 不同流速对相对校正因子的影响
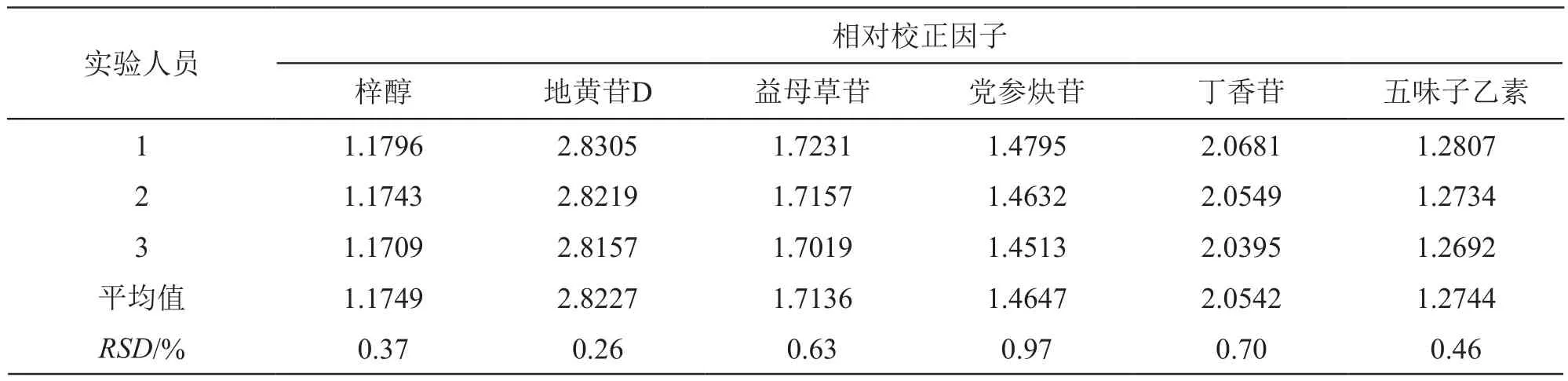
表6 不同实验人员对相对校正因子的影响
2.5.5 待测组分色谱峰的定位 精密吸取2.1.2项下混合对照品溶液,依法进样测定,记录梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素色谱峰的保留时间,以内参物五味子醇甲色谱峰为基准峰,采用相对保留时间值法对色谱峰定位,分别考察2种品牌高效液相色谱仪(Agilent 1100型、Waters 1525型)和3种品牌色谱柱(Diamonsil C18色谱柱、Eclipse XDB-C18色谱柱、Alltima C18色谱柱)对梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷和五味子乙素相对保留时间值的影响,结果见表7。
2.6 慢肝养阴片含量测定中一测多评法(QAMS)与外标法(ESM)的结果比较
取3个批号的慢肝养阴片样品适量,按2.1.3项下方法,每个批号平行制备慢肝养阴片供试品液3份,按2.2项色谱条件下依法进样测定梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素的峰面积,分别采用外标法和一测多评法计算各成分的含量,计算相对平均偏差(RAD)。结果见表8。
3 讨论
3.1 定量检测指标成分及内参物的选择
慢肝养阴片由地黄、党参、五味子、枸杞子等10味中药组方而来,方中地黄清热养阴,枸杞子滋补肝肾,合为君药;五味子生津补肾,麦冬、北沙参养阴生津,川楝子疏肝柔肝,合为臣药;党参、人参健脾补气、提高免疫力,桂枝温经通阳、防滋腻太过,合为佐药;当归引药入肝经,为使药。诸药共奏,以达养阴清热、滋补肝肾的临床功效。中药质量是中药临床疗效的保障,中药质量标志物已成为中药质量评价与质量控制的核心概念。本文参考中药质量标志物以君药为首选,同时兼顾臣佐使药的确认原则,选取慢肝养阴片方中君药地黄所含代表性成分梓醇、地黄苷D和益母草苷,党参所含主要活性成分党参炔苷和丁香苷,五味子所含代表性成分五味子醇甲和五味子乙素为定量检测指标成分,为全面评价慢肝养阴片内在产品质量提供数据支持;所选7种定量检测指标成分中五味子醇甲性质较为稳定,对照品价廉易得,同时慢肝养阴片中五味子醇甲成分含量较高,故选取五味子醇甲作为内参物,采用HPLC一测多评法同时测定慢肝养阴片中7种成分。
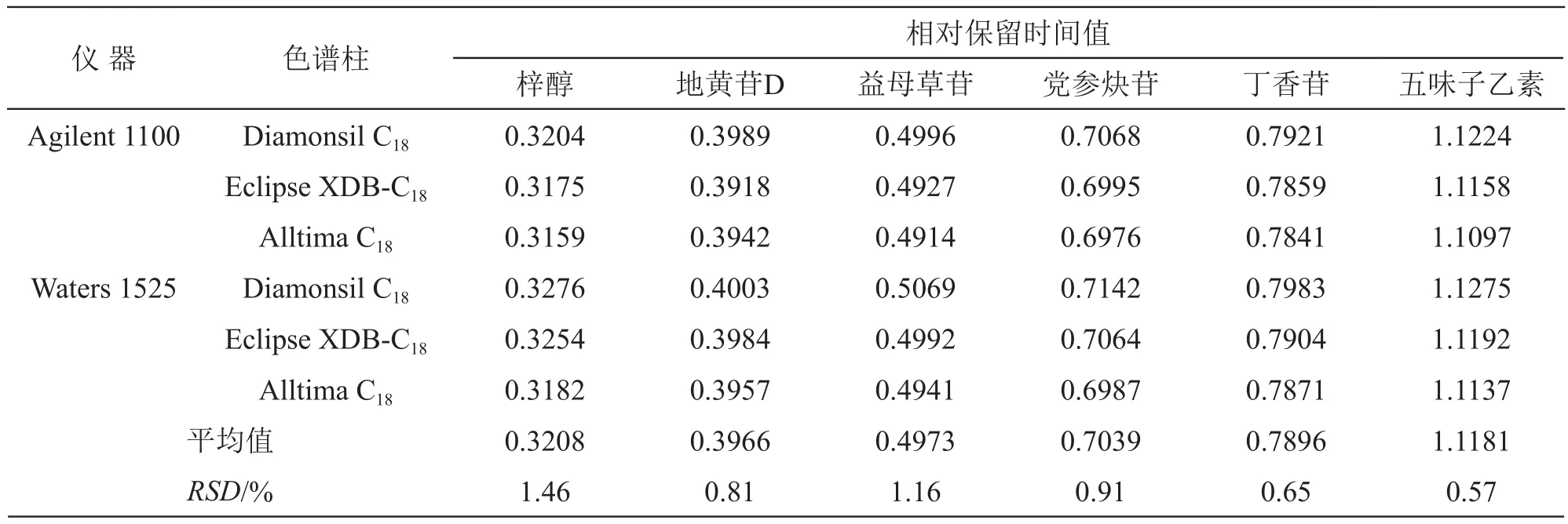
表7 不同仪器、色谱柱条件下各成分的相对保留时间值
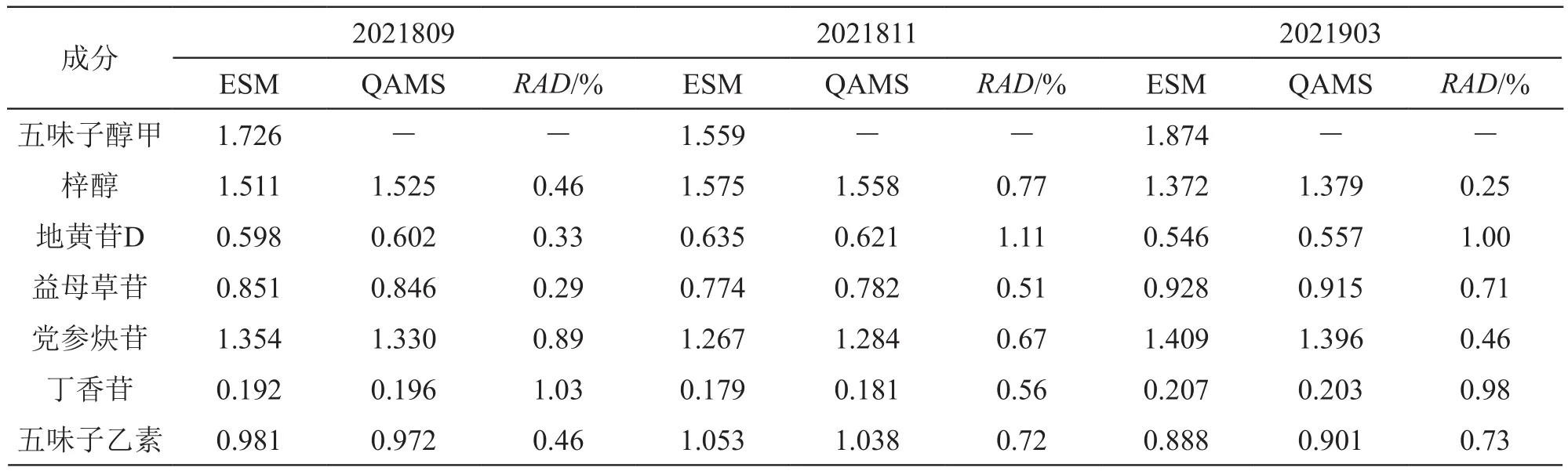
表8 一测多评法与外标法测得的慢肝养阴片中各成分的含量(n=3)/mg·g-1
3.2 供试品溶液制备方法的选择
本实验参考相关文献,以指标成分梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素的综合提取率为首选指标,同时兼顾杂质峰干扰情况,依次对比考察了不同提取溶剂:甲醇[11-17]、95 %乙醇溶液、60 %甲醇溶液[10]和不同提取方式:超声提取法、加热回流提取法。结果表明,以甲醇为提取溶剂时,待测成分综合提取率最佳,杂质成分干扰相对较小;超声提取和加热回流提取所测成分综合提取率无显著差异,但加热回流提取杂质干扰较大。同时通过试验摸索,最终确定以甲醇超声提取30 min制备慢肝养阴片供试品溶液。
3.3 流动相的选择
本实验以指标成分梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素的峰形及分离效果为首先指标,同时兼顾色谱峰基线的平稳情况,首先考察基础流动相甲醇-水和乙腈-水[13-17],结果表明,以甲醇-水为流动相时,色谱图基线漂移严重,干扰各成分检测;乙腈-水流动相体系检测时基线平稳,但丁香苷和五味子醇甲色谱峰拖尾严重,与相邻峰分离度不符合要求。考虑到磷酸溶液可改善峰形,遂采用乙腈-0.2 %磷酸溶液[11-12]为流动相,同时不断优化流动相中乙腈和0.2 %磷酸溶液比例,最终确定以乙腈-0.2 %磷酸溶液为流动相,同时测定慢肝养阴片中7种指标性成分。
本实验首次采用HPLC一测多评法同时测定慢肝养阴片中梓醇、地黄苷D、益母草苷、党参炔苷、丁香苷、五味子醇甲和五味子乙素的含量,建立的方法操作便捷、结果准确。建立了慢肝养阴片多指标成分质量控制模式,为提升慢肝养阴片质量控制标准和全面评价其内在产品质量提供了数据支持。
