miR-10b对胃癌细胞增殖和凋亡的影响及机制*
2020-10-21张雪莲吴维宇何峰
张雪莲, 吴维宇, 何峰
(成都医学院第一附属医院 消化内科, 四川 成都 610500)
胃癌是最常见的消化道恶性肿瘤之一,在中国的发病人数约占全球的40%[1],提示中国人群具有胃癌高风险性。近年来,虽然胃癌的治疗效果有所提高,但是进展期胃癌患者的生存率仍不理想,多数患者就诊时已发展至中晚期,导致干预滞后。因此,寻找有效胃癌分子标志物,尽早诊断胃癌,对于改善患者预后至关重要。随着表观遗传学研究的深入,发现胃癌的发生发展与很多复杂基因和信号通路有关[2-4]。miRNA作为一类内源性非编码单链小RNA,在进化过程中高度保守的特点,且参与多种生物学过程,可通过不同的调控途径影响细胞的增殖和凋亡[5-6]。miR-10是近年来肿瘤研究领域的热点分子,已被证实与多种肿瘤的发生发展密切相关[7-8],但是其对胃癌细胞增殖和凋亡的影响还有待进一步研究。本研究采用荧光定量PCR方法,检测了20例胃癌患者癌组织及癌旁组织中miR-10b的表达,探讨其与胃癌细胞增殖和凋亡之间的相关性及其作用机制。
1 材料与方法
1.1 标本采集和主要试剂
2018年12月确诊的20例胃癌患者,男13例、女7例,年龄31~65岁、中位年龄49岁,取胃癌组织标本和配对的癌旁正常组织标本(距癌组织约5 cm),立即采用液氮冻存,-80 ℃保存。人类胃癌细胞株:高分化AGS、中分化N87、中分化SGC-7901、低分化MKN-45、低分化BGC-823和正常胃黏膜上皮细胞GES-1细胞系均购自中国科学院上海细胞库。DMEM(Gibco),胎牛血清(杭州四季青),Trizol提取试剂 (Invitrogen公司),青霉素、链霉素和DMSO(Gibco BRL公司), MTT(碧云天),AnnexinV/PI细胞凋亡试剂盒(武汉谷歌科技公司),Lip2000转染试剂盒和Taqman mRNA反转录试剂盒(Invitrogen公司)。
1.2 方法
1.2.1细胞培养和转染 胃癌细胞常规培养于含青霉素、链霉素及10%胎牛血清的培养基中,于37 ℃,5%CO2孵箱中培养,2 d换液1次,3 d传代1次。将miR-NC(阴性对照物)和miR-10b转染至对数生长期的人胃癌细胞系MKN-45细胞中,按Lip2000转染试剂盒所提供的方法操作,转染24 h后将细胞正常培养,24 h后换液继续培养至48 h。
1.2.2胃癌组织和细胞中miR-10b及上皮型钙黏蛋白(epithelial cadherin, E-cadherin)检测 取癌组织以及癌旁组织研磨粉碎后,加入Trizol提取总RNA,经1%琼脂糖凝胶电泳及紫外分光光度法进行质量控制和浓度测定,确定D260/D280比值在1.7~2.0,参照Taqman mRNA反转录试剂盒说明书进行逆转录反应合成cDNA;以 GAPDH 或U6为内参, 使用扩增试剂盒对 cDNA 进行扩增。反应条件为预变性94 ℃、10 min、1个循环、扩增反应95 ℃、30 s,60 ℃、30 s,30个循环。以2-△△ct计算相对表达量,完成 PCR 。取5株不同分化程度的胃癌细胞株,根据其不同分化程度分为三组,即高分化组(AGS)、中分化组(N87、SGC-7901)、低分化组(MKN-45、BGC-823),以胃黏膜上皮永生化细胞GES-1为正常对照组,检测不同分化组细胞中miR-10b和E-cadherin的表达(检测步骤同上);在人胃癌细胞系MKN-45细胞分别转染miR-10b siRNA阴性对照物后,检测细胞内E-cadherinmRNA水平表达。反转录引物miR-10b F为5′-TACCCTGTAGAACCGAATTGTG-3′,R:5′-CAGTGCGTGTCGTGGAGT3′,以U6为内参,反转录引物为R:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCAAAATATGGAACTGC-3′;F:5′-GGGTGCTCGCTTCGGCAGC-3′。E-cadherin: F:5′-ATTCTGATTCTGCTGCTCTTG-3′;R:5′-AGTAGTCATAGTCCTGGTCTT-3′;GAPDH:F:5′-CATGAGAAGTATGACAACAGCCT-3′;R:5′-AGTCCTTCCACGATACCAAACT-3′。
1.2.3E-cadherin和凋亡蛋白Bcl2、Bax表达 取癌组织研磨粉碎后、加入裂解液裂解,使用蛋白质提取试剂盒提取总蛋白,确定浓度后采用SDS-PAGE检测E-cadherin和凋亡蛋白Bcl2、Bax表达量;在MKN-45细胞中分别转染miR-10b siRNA、阴性对照物,在GES-1中转染miR-10b mimics后[9-10],检测细胞内E-cadherin以及凋亡蛋白表达。
1.2.4MKN-45细胞增殖能力 收集MKN-45对数生长期细胞并转染miR-10b siRNA,阴性对照物为MKN-45对数生长期的细胞转染miR-10b mimics、阴性对照物GES-1细胞后,调整浓度为5×107/L的单细胞悬液,接种于96孔板中,每组设置5个复孔,置于培养箱中24、48 h,终止前每孔加入噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)试剂 20 mL,继续培养4 h,上机前吸弃培养液,每孔加入DMSO 150mL,水平摇床摇动30 min,在酶标仪(570 nm波长)上测量吸光度OD值,计算细胞生长增殖抑制率(IR)=(1-试验组OD值/对照组OD值)×100%。
1.3 统计学分析
2 结果
2.1 miR-10和E-cadherin在胃癌组织及癌旁组织中的表达
qRT-PCR结果显示,与癌旁组织比较,胃癌组织中miR-10b的表达升高,差异有统计学意义(P<0.05);与癌旁组织比较,胃癌组织中E-cadherin的表达降低,差异有统计学意义(P<0.05)。见图1。
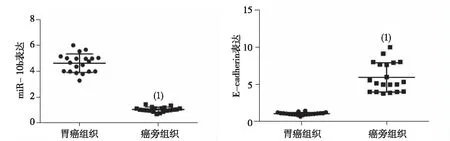
注:(1)与癌旁组织比较,P<0.05。图1 miR-10和E-cadherin在胃癌及癌旁组织中的表达Fig.1 The expression of miR-10b and E-cadherin in gastric cancer and adjacent tissues
2.2 miR-10b和E-cadherin在胃癌细胞株中的表达
分别以U6和GAPDH作为内标对照结果显示,正常的对照细胞(GES-1)几乎不表达miR-10b,在高分化细胞株AGS和中分化N87和SGC-7901中仅弱表达,但是在低分化的BGC-823、MKN-45细胞株中,miR-10b的表达高于对照细胞,差异有统计学意义(P<0.05);相反,E-cadherin在高分化组中表达较高,在中分化组中表达有所降低,而在低分化组中降低最为明显,与对照细胞相比,差异均具有统计学意义(P<0.05)。见表1。

表1 miR-10b和E-cadherin在胃癌细胞株中的表达Tab.1 The expression of miR-10b and E-cadherin in gastric cancer cell lines
2.3 胃癌细胞MKN-45的凋亡
与MKN-45对照组相比,MKN-45-siRNA组转染miR-10b siRNA抑制miR-10b的表达后,人胃癌细胞MKN-45中E-cadherin的表达升高;进一步在GES-1中转染miR-10b mimics后,与GES-1对照组相比,细胞内E-cadherin表达降低(P<0.05),提示在MKN-45细胞内,miR-10b对细胞凋亡因子的调控可能是通过影响E-cadherin的表达实现的。见图2。
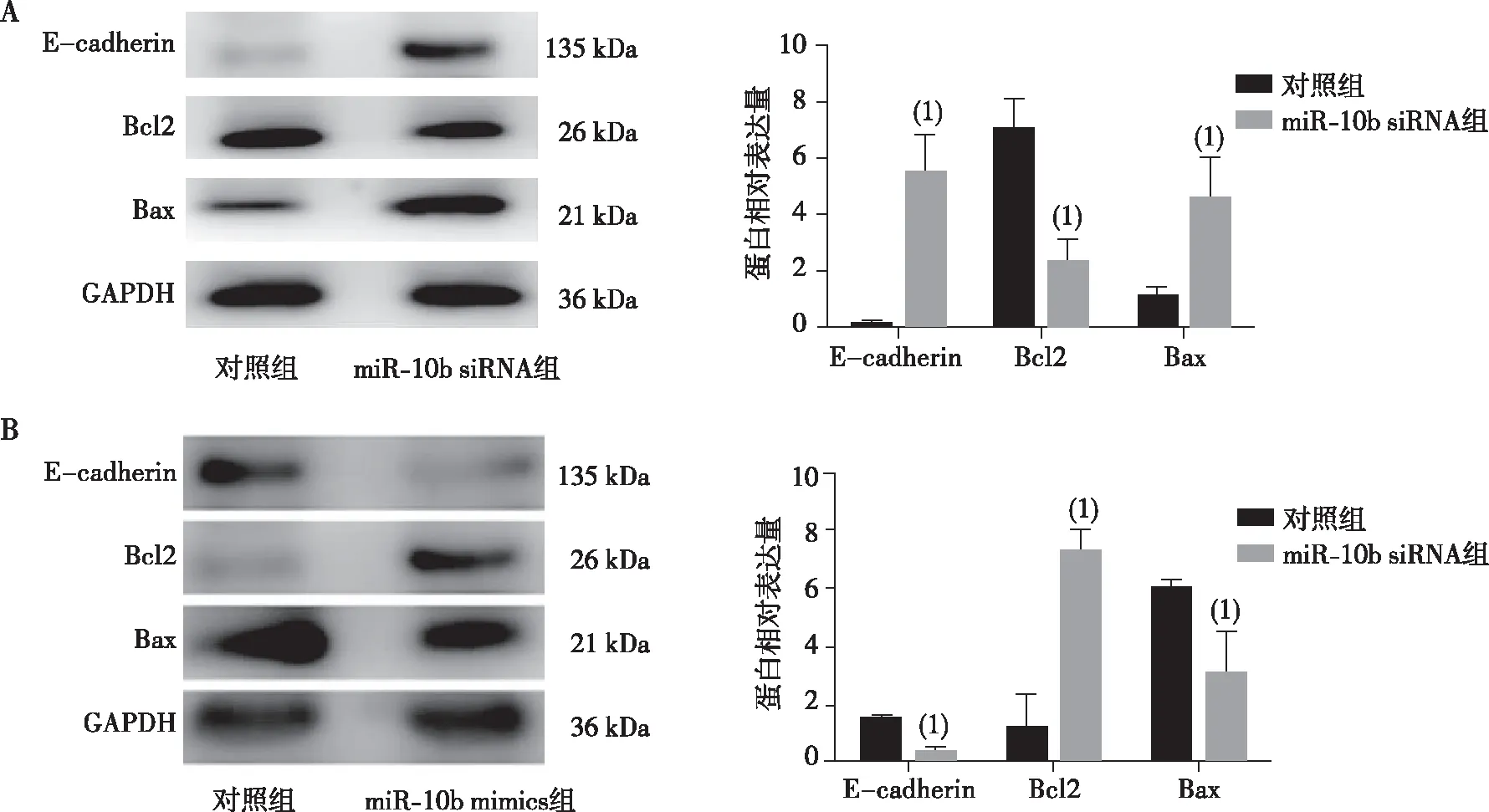
注: A为在MKN-45细胞内转染miR-10b siRNA抑制其表达后的相关蛋白的表达, B为在GES-1细胞内转染miR-10b-mimics增强其表达后的相关蛋白的表达;(1)与对照组比较,P<0.05。图2 miR-10b对人胃癌细胞MKN-45中E-cadherin表达的影响Fig.2 Effects of miR-10b on E-cadherin expression in human gastric cancer cell line of MKN-45
2.4 miR-10b对人胃癌细胞MKN-45增殖的影响
与MKN-45对照组相比,MKN-45-siRNA组转染miR-10b siRNA 24和48 h,胃癌细胞MKN-45的生长增殖抑制率降低,差异有统计学意义(P<0.05);与GES-1对照组相比,在GES-1中转染miR-10b mimics后发现细胞生长增殖抑制率增加,差异有统计学意义(P<0.05)。见表2。

表2 转染miR-10b siRNA 24和48 h后细胞生长增殖抑制率的影响Tab.2 Effects of miR-10b siRNA transfection on cell growth and proliferation in 24 and 48
3 讨论
胃癌作为临床常见疾病,其发病机制繁杂,一直以来是困扰胃癌治疗的瓶颈,目前研究结果显示,胃癌细胞株分化级别与其转移能力呈现负相关,提示低分化的胃癌细胞更易发生恶性转变[11]。因此,尽早的识别低分化胃癌细胞危险标志物,为胃癌可防可治提供了可能性。随着研究的深入,发现胃癌的众多发病机制中,表观遗传学改变可能发挥重要作用。microRNA(miRNA)作为表观遗传学说的重要组成部分,是近些年在真核生物中发现的一类内源性非编码小分子单链RNA,长度约为18~25个核苷酸,具有高度的物保守性。生物体内的miRNA对其靶基因的转录后表达调节气道非常重要的作用,当miRNA和靶向mRNA完全或几乎完全互补时,可导致目的mRNA的降解,而当miRNA和靶向mRNA不完全互补时,则参与负调控翻译过程,阻碍蛋白质翻译[12-13]。miRNA-10b在包括乳腺癌[14-16]、胰腺癌[17-18]等多种肿瘤中的异常表达已有报道,但是对于其在胃癌中的表现还尚不明确。本研究结果显示,不同分化程度的胃癌组织和细胞内miR-10b表达情况存在较大差异,其中在低分化胃癌组织和细胞中,均观察到miR-10b表达明显高于对照组,提示miR-10b作为胃癌细胞低分化异常改变的可疑靶分子具有重要意义,但是其对细胞生物学影响机制仍有待进一步明确。
目前,miRNA参与调控细胞增殖和凋亡异常是最常见,也最显著的生物学功能[19-21],但所涉机制复杂,E-cadherin是介导上皮细胞间粘附的跨膜糖蛋白,在上皮细胞中均有表达,在细胞外钙因子参与下介导同种亲和性细胞间的粘附。当其表达下调或功能障碍时,将使同种细胞失去黏附,易从原发病灶脱落分离,向局部淋巴结转移或远处转移[22]研究结果显示,在不同分化的胃癌组织和细胞中,高分化组细胞内E-cadherin表达最高,中分化组中表达有所降低,而在低分化组中降低最为显著,提示低分化组易发生转移。
有报道显示,E-cadherin可能是miR-10b的潜在靶基因[23]提示在低分化组胃癌细胞和组织中,E-cadherin的异常低表达可能与miR-10b有关。为此,我们在低分化胃癌细胞中转染miR-10b siRNA抑制miR-10b的表达后,细胞内E-cadherin表达增加,同时,细胞凋亡蛋白表达升高,抗凋亡蛋白表达下降,增殖下降;而在正常对照组中进一步转染miR-10b mimics促进miR-10b的表达后,细胞内E-cadherin蛋白表达下降,同时,细胞凋亡蛋白表达降低,抗凋亡蛋白表达增加,增殖增加。
综上所述,在低分化胃癌细胞株内,miR-10b的异常表达可作为可疑靶标,且异常高表达的miR-10b可影响细胞的增殖与凋亡,而这种调控作用可能是通过影响E-cadherin的表达实现的。
