珠江三角洲滨海湿地土壤微生物群落多样性与养分的耦合关系
2020-10-21孟妍君
孟妍君, 秦 鹏
(1.桂林旅游学院, 广西 桂林 541006; 2.桂林理工大学 博文管理学院, 广西 桂林 541006)
从生态环境的角度来讲,由于其构成要素众多且存在显著的交互作用,因此其复杂性和多样性尤为突出,对于陆地生态而言更是如此,由于其直接作为人类生存发展的载体,动植物的生长发育受其直接制约,因此其具有复杂性的同时更突显了其重要性[1-2]。立足于陆地生态环境,其中关键的构成部分离不开土壤和微生物,绝大多数植被的生长发育离不开土壤,在物质和能量交换过程中离不开微生物,从而形成了土壤—植物局地生态系统[3]。作为土壤生态的重要构成部分,微生物对于凋落物的分解发挥着无可替代的效果,同时在酶的参与下进一步提升了分解效果,二者是息息相关的,此外,环境因子也发挥着明显的制约效应[4-5]。离开了微生物,凋落物等腐殖质的降解将无从谈起,这在土壤养分转化过程中尤为关键,直接制约着土壤肥力及活性,因此,在土壤质量分析过程中微生物常常作为关键指标加以分析。近些年来,微生物数量及分布特点等方面受到了大量学者的关注,并对此开展了长期的实地研究,加之研究方法及研究技术的不断改进优化,对其研究更为深入,尤其是其结构及区系等方面,研究更为深入、多样,其多样性产生的影响进一步探究,尤其是随着分子研究水平的不断提升,微生物多样性等方面的分析更为深入[6-8]。目前来讲,对于微生物多样性研究,首先要探究其物种分布,此外还需要对其功能及遗传方面加以探究,在此过程中常用的研究方法不仅包括碳素利用法[9-10],还包括核酸分析法等多元化研究方法;有机质分解在土壤养分积累的过程中尤为关键,尤其是凋落物的降解,不仅与植被生长息息相关,同时与微生物活动关系密切,凋落物降解依赖于微生物分解[11-12],同时又为微生物新陈代谢提供能量支撑,因此来说,探究土壤与微生物及植被之间的关系具有重要的现实意义。
对于珠江三角洲湿地而言,其形成主要受制于珠江和海洋的交互效应,是入海口地带的产物,由于其河口地质构造突出,受制于河口地带水动力作用等,形成了突出的河口三角洲地带,呈现出明显的湿地生态环境[13-15],这也是当地较为独特的地貌之一。随着海平面的不断上升,大量泥沙沉积于河口区域,从而不仅形成了滨海湿地,同时出现了大量的浅滩,出现了大量的颗粒沉积物,对于珠江三角洲生态产生了重要影响和变化,甚至出现了水下三角洲的独特生态,其泥质沉积体现象较为突出[16-17]。然而,从20世纪80年代开始,在工业化进程的不断发展过程中,珠江三角洲湿地生态发生了巨大变化,不仅湿地面积大幅下降,同时局地生态变化突出,呈现出明显的退化现象,导致原有的湿地景观衰退,还直接导致生物多样性下降,破坏了其原有的生态平衡[18]。尤为突出的环境问题影响了当地的生态环境,对于湿地保护尤为不利,基于此,本研究从2015年开始进行连续3 a的实地观测研究分析,长期观测珠三角滨海湿地[互花米草(Spartinaalterniflora)湿地、碱蓬滩(Suaedaglauca)湿地、芦苇(Phragmitescommunis)湿地、红树林(Rhizophoraapiculata)湿地],探究该区域的土壤状况及微生物特点,揭示养分和微生物之间的内在关系,探究微生物群落分布特性,探寻其交互作用机理,从而为湿地保护提供有益参考和借鉴,为修复退化的湿地环境提供借鉴。
1 材料与方法
1.1 研究区概况
本研究选取珠江河口的淇澳岛(113°36′40″—113°39′15″E,22°23′40″—22°27′38″N),该区域面积约为24 km2,受地理位置制约而具有较为突出的亚热带海洋气候特点,通过近些年来该地区的气象资料分析得知,年均气温达到22℃,即使是气温最低1月,其月均温度依然能达到15℃,其最低温为2.4℃。受地理位置及水文特点的影响,其潮汐现象呈现出半日潮的特点,且具有不规则的变化特点,潮涨潮落的规律难以找寻,潮差变化较大,容易受枯水季的影响,潮差一般不超过2 m。通过对其气象数据进行分析得知,该区域受热带气旋的影响较为常见,每年出现的次数甚至达到了12次,对于珠江口的影响较大。
1.2 样品采集
2015年8月,在淇澳岛选取芦苇、红树林、互花米及碱蓬湿地,每种湿地选取3个重复样地(每个样地面积为50 m×50 m),每个样地长期布设15个2 m×2 m的重复样方,共计180个样方,连续观测3 a。连续3 a在每个样方采集土壤混合样品,采集深度为20 cm,采样四点混合法采集约为2 kg新鲜土壤样品,每年采集180个土壤样品,3 a共计540个土壤样品。取样完成之后把样品分为两部分处理,一部分带回实验室进行风干操作,并对其杂质进行去除之后来科学地测定其养分和有效养分含量,另一部分则在取样现场过100目筛后保存在4℃保温冰箱之中,并对其土壤中各种微生物量进行测定[7-8]。
本研究过程中对土壤养分开展了一系列的测定,对有机碳、全氮及全钾的测定分别采取氧化法、定氮法及光度计法,同时借助于烘干法来测定其含水量,要求温度达到105℃,对于其pH值的测定则借助于电位法。
通过平板梯度稀释法来测定土壤中各种微生物的数量。值得注意的是,高氏一号琼脂培养基、马丁氏培养基、牛肉膏蛋白胨琼脂培养基这3种培养基分别为放线菌、真菌以及细菌的培养基,这样能够获得多次重复的菌落平均数,用其乘以相应的稀释倍数就得到了相应的微生物菌落数。对于微生物量碳、氮及磷的测定借助于浸提法进行。所有指标测定均重复3次后取平均值。
1.3 土壤微生物群落功能多样性
微生物对于凋落物的分解发挥着无可替代的效果,同时在酶的参与下进一步提升了分解效果,二者是息息相关的,离开了微生物,凋落物等腐殖质的降解将无从谈起,这在土壤养分转化过程中尤为关键,直接制约着土壤肥力及活性,因此,在土壤质量分析过程中微生物常常作为关键指标加以分析。本研究过程中对于微生物多样性的测定主要立足于McIntosh,Shannon和Simpson等指数的角度[19]。
在微生物呼吸的测定过程中,主要借助于碱液吸收法,其与微生物量碳之间的比值即为代谢熵:qCO2=MR/MBC[19]。本研究对于水解酶进行相应的测定,研究过程中借助于对硝基苯酚(pNP)法,对于微生物群落分布主要通过McIntosh,Simpson等多样性指数进行衡量,对于Simpson指数计算而言,首先对相应的数据进行放大1 000倍的处理,这样将不会出现负数的现象;对于微生物的碳源利用水平进行衡量过程中主要借助于AWCD值衡量法[20],即:
AWCD=∑[(Ci-R)/31]
(1)
H=-∑Pi(lnPi)
(2)
Pi=(Ci-Ri)/∑(Ci-Ri)
(3)
在开展指标统计分析之前对数据进行相应的均值处理,并充分考虑标准误差,然后借助于Excel 2010整理相关数据,并开展SPSS 21.0统计检验,尤其是相关分析及显著性检验等,并对不同的置信水平开展相应检验。在探究微生物和养分之间关系的过程中主要运用了CANOCO 4.5,此外还对其与环境因子之间的关系进行探讨。
2 结果与分析
2.1 滨海湿地不同植物群落土壤养分
由图1可知,滨海湿地不同植物群落土壤pH值变化范围为7.13~7.56,基本表现为:互花米草湿地>碱蓬滩湿地>芦苇湿地>红树林湿地,其中不同湿地植物群落土壤pH值差异均不显著(p>0.05);土壤有机碳变化范围为9.63~13.98 g/kg,基本表现为:互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中芦苇湿地和红树林湿地差异不显著(p>0.05),二者显著高于互花米草湿地和碱蓬滩湿地(p<0.05);土壤全氮变化范围为0.91~1.18 g/kg,基本表现为:互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地差异均显著(p<0.05);土壤全氮变化范围为26.52~43.09 g/kg,基本表现为:互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,红树林湿地显著高于其他湿地(p<0.05)。

注:不同小写字母表示差异显著(p<0.05),下同。
2.2 滨海湿地不同植物群落土壤微生物数量
由图2可知,滨海湿地不同植物群落土壤细菌数量占绝对优势,占微生物总数的70%左右,其次是放线菌,真菌最少。土壤微生物总数变化范围为(2.03~2.81)×107cfu/g,基本表现为:互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地土壤微生物总数差异均显著(p<0.05);土壤细菌数目变化范围为(1.23~1.57)×107cfu/g,基本表现为:互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中芦苇湿地和红树林湿地差异不显著(p>0.05),互花米草湿地显著低于其他湿地(p<0.05);放线菌数目变化范围为(3.1~6.1)×106cfu/g,基本表现为:互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地放线菌数目差异均显著(p<0.05);真菌数目变化范围为(4.5~8.4)×105cfu/g,基本表现为:互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地真菌数目差异均显著(p<0.05)。综合分析可知,微生物总数、细菌、真菌和放线菌数量最大值出现在红树林湿地,最小值出现在互花米草湿地。
2.3 滨海湿地不同植物群落土壤微生物量
由图3可知,滨海湿地不同植物群落土壤微生物量存在一定差异,土壤微生物量碳变化范围为124~169 mg/kg,基本表现为互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地差异均显著(p<0.05);土壤微生物量氮变化范围为68~92 mg/kg,基本表现为互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地差异均显著(p<0.05);微生物量磷变化范围为13~16 mg/kg,基本表现为互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地差异均不显著(p>0.05)。
2.4 滨海湿地不同植物群落土壤微生物群落多样性
由图4可知,滨海湿地不同植物群落土壤微生物群落功能多样性指数存在一定差异,土壤微生物物种丰富度指数(H)变化范围为1.63~3.35,基本表现为互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地差异均显著(p<0.05);土壤微生物均匀度指数(E)变化范围为0.24~0.75,基本表现为互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中互花米草湿地和碱蓬滩湿地差异均不显著(p>0.05);优势度指数(Ds)变化范围变化范围为0.686~0.701,基本表现为互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地差异均不显著(p>0.05);碳源利用丰富度指数(S)变化范围为7.15~16.79,基本表现为互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地,其中不同湿地差异均显著(p<0.05)。
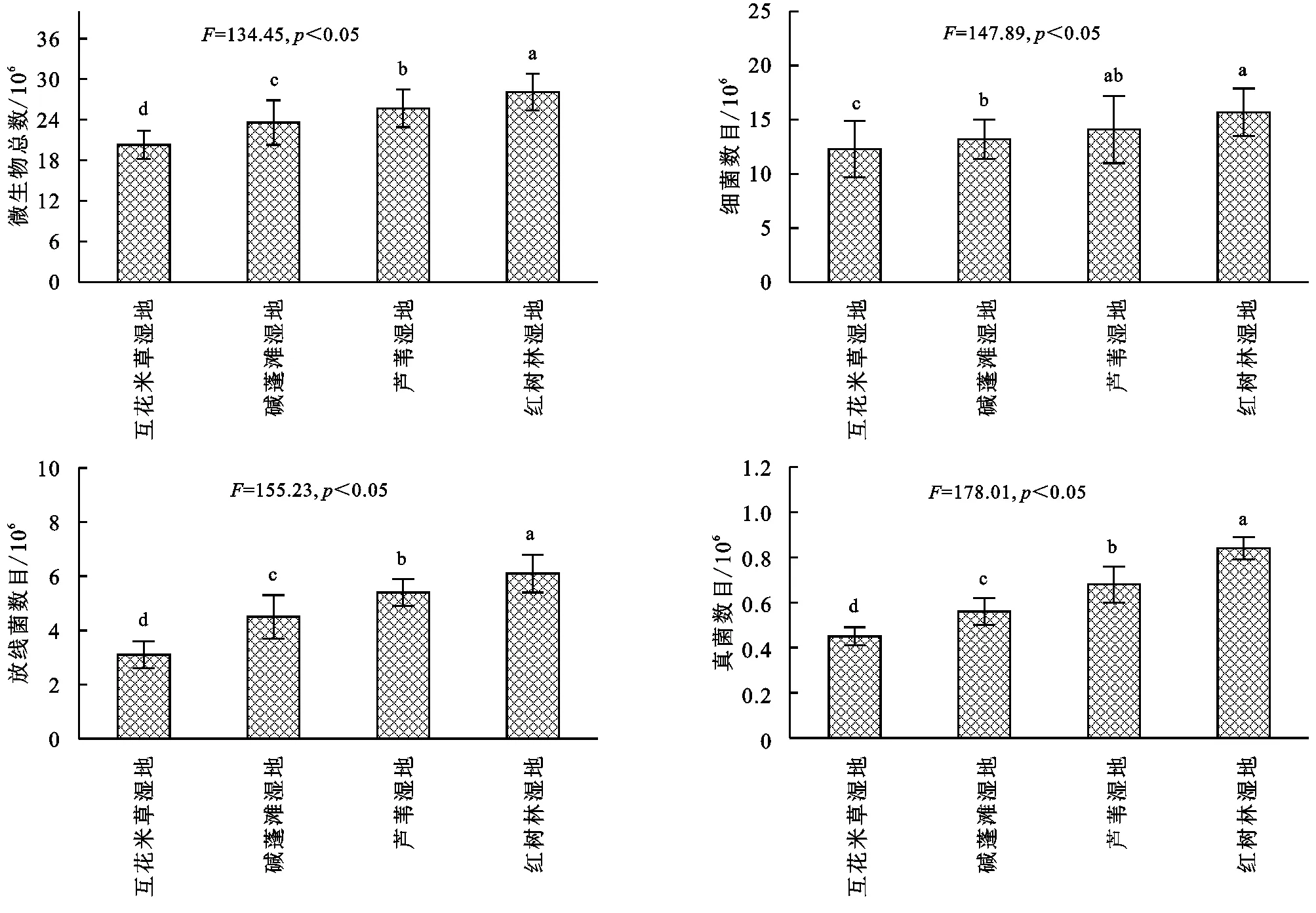
图2 滨海湿地不同植物群落土壤微生物数量的变化
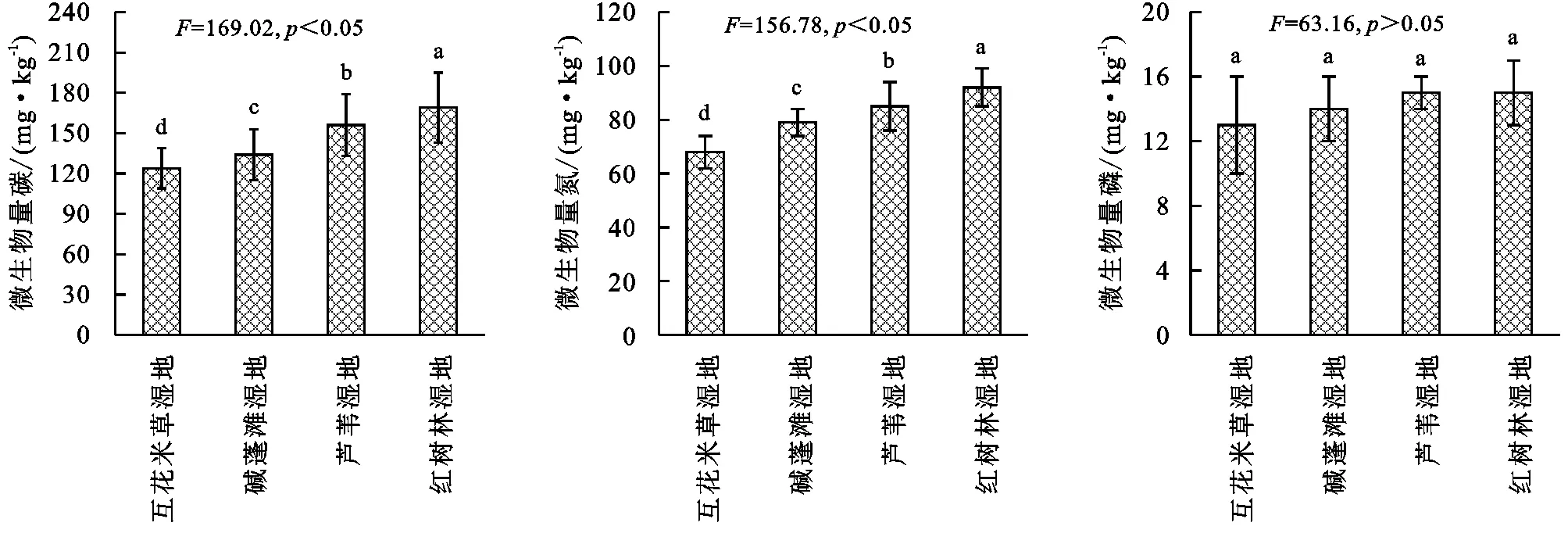
图3 滨海湿地不同植物群落土壤微生物量的变化
2.5 土壤微生物及其与土壤养分之间的耦合关系
由表1可知,土壤微生物群落功能的变化与土壤养分的变化呈正比例关系。与土壤pH值之间的关系为负相关。土壤微生物碳源利用丰富度指数(S)、均匀度指数(E)和物种丰富度指数(H)土壤养分各指标的相关系数,均高于优势度指数(Ds)。概而言之,土壤养分、土壤pH值和微生物群落功能多样性之间,是相互依赖和影响的,土壤养分的贡献程度较高,土壤pH值的贡献程度较低。由以上推断可知,滨海湿地不同植物群落土壤微生物群落多样性会存在较大差异。
研究表明(表2),不同湿地4个特征值的累积方差贡献率分别为70.23%,75.15%,72.27%,73.09%,基本能反映出大部分的变量信息,由此建立两两之间的4对典型变量的构成(表3),由于第1,2对典型变量相关系数大,第3,4对典型变量的影响较小,因此,只取第一、二对典型变量进行分析。
互花米草湿地,土壤微生物特征和土壤养分的第一、二对典型相关系数分别为0.992和0.856,表明土壤养分的第一、二对变量对土壤微生物第一、二对变量的影响较大(表3);碱蓬滩湿地,0.987**和0.814**(p<0.01),表明土壤养分的第一、二对变量对土壤微生物第一、二对变量的影响较大;芦苇湿地,0.956**和0.809**(p<0.01),表明土壤养分的第一、二对变量对土壤微生物的第一、二对变量的影响较大;红树林湿地,0.986**和0.814**(p<0.01),表明土壤养分的第一、二对变量对土壤微生物第一、二对变量的贡献较大。
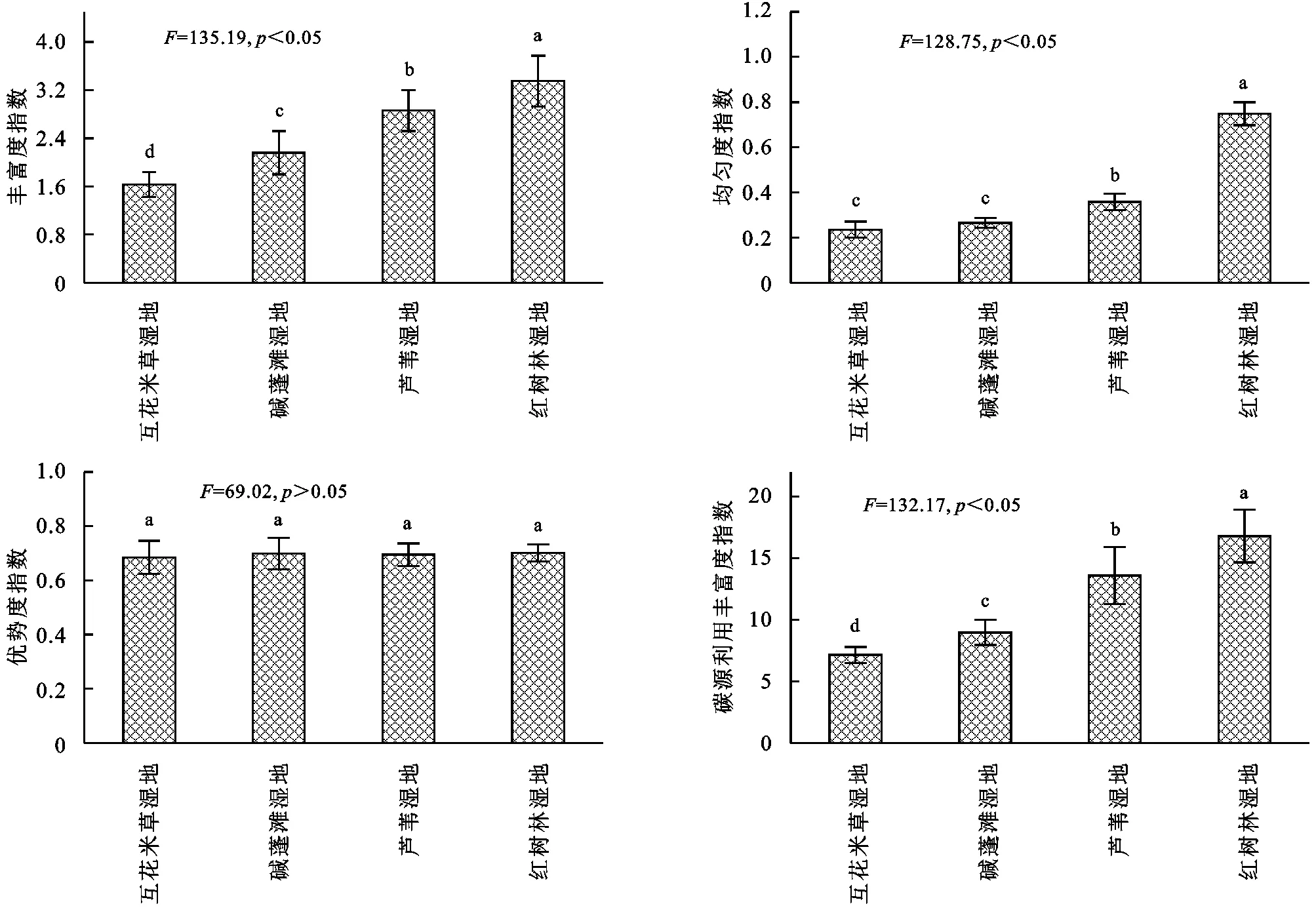
图4 滨海湿地不同植物群落土壤微生物群落多样性
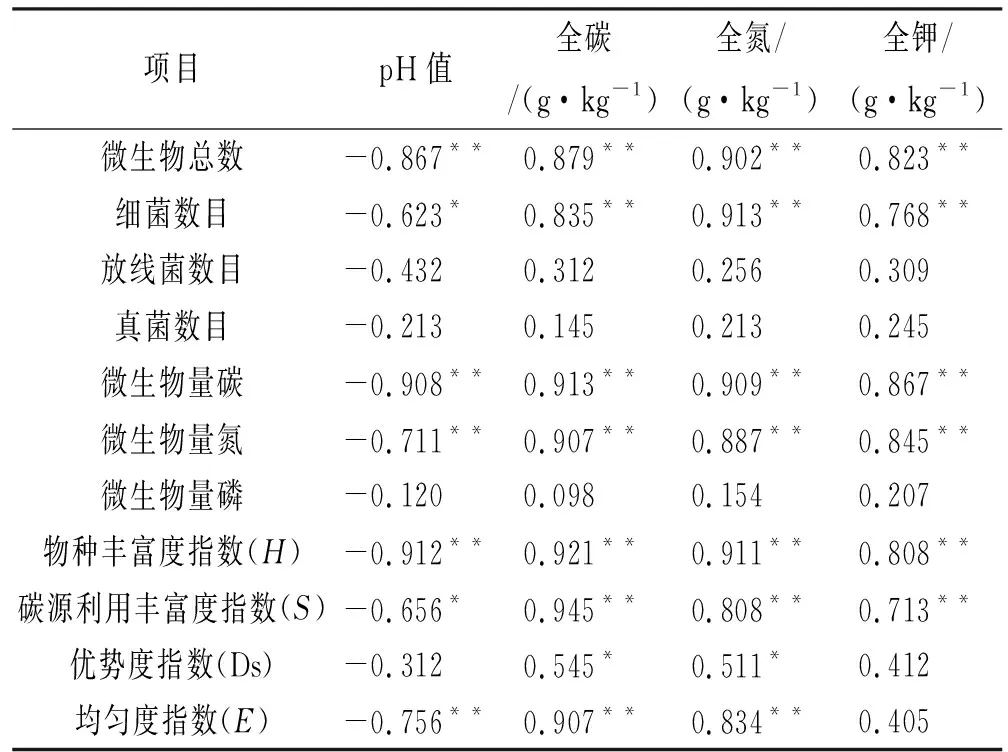
表1 土壤养分与微生物多样性之间相关性(n=540)
3 讨 论
对于陆地生态系统,土壤微生物在物质和能量交换过程中起着重要的调节作用;土壤微生物也常常用于衡量土壤质量,一方面微生物活动改变着土壤理化特性,另一方面土壤环境为微生物活动创造更为适宜的新陈代谢环境,二者具有明显的相互促进性[21]。
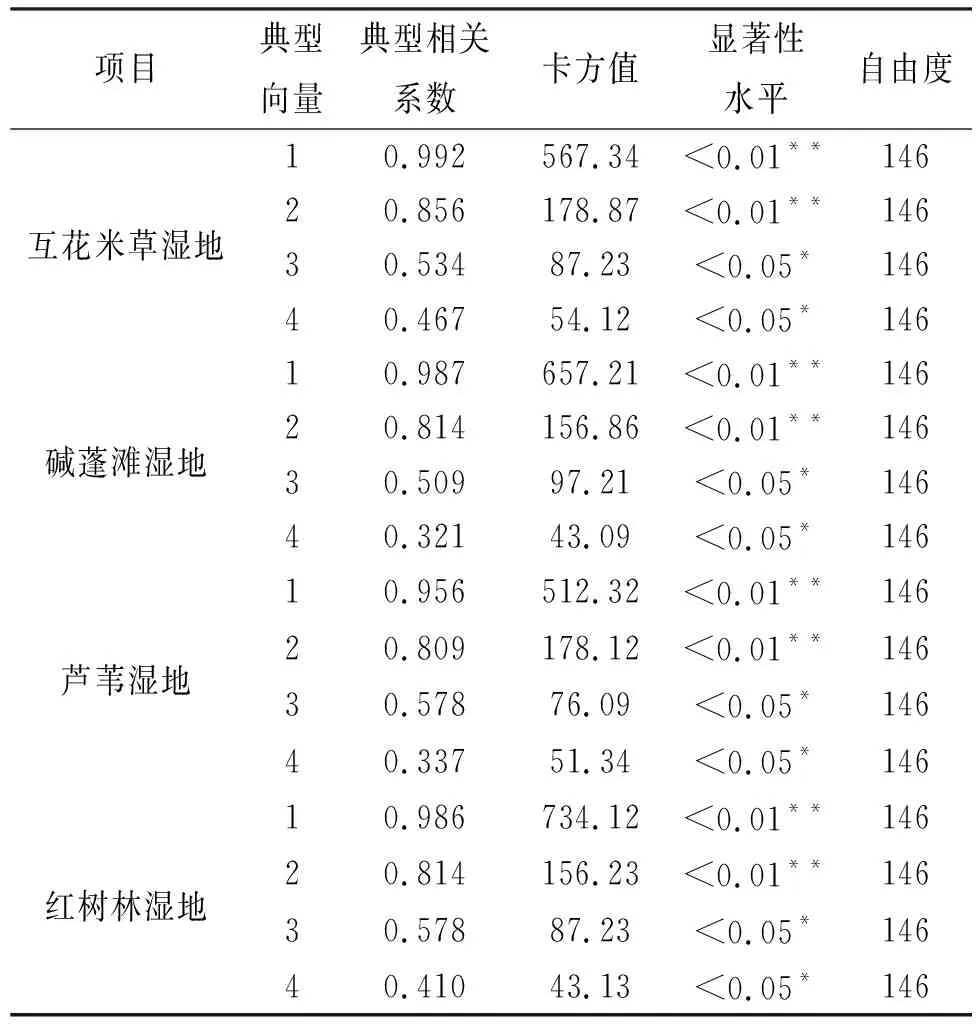
表2 土壤微生物与土壤养分典范相关分析的卡方检验

表3 土壤微生物与土壤养分的前两对典型变量的构成
通过本试验连续3年的观测研究得知,虽然土壤的有机碳、全氮及全钾存在较大的差异,但是其整体变化规律较为接近,其中分布含量最高的是红树林湿地,其次是碱蓬滩、芦苇湿地,而最低的是互花米草湿地,对于微生物菌群而言,数量方面难以匹敌的依然是细菌,其占比高达70%,而真菌数量最不占据优势;从其数量分布方面来讲,其规律性较为明显,数量最高的湿地依然是红树林,而数量最少的湿地依然是互花米草区域,对于不同湿地而言,其微生物数量呈现较大差异,且这种差异具有显著性,达到了0.05的显著性检验水平。对于红树林湿地区域而言,大量的枯枝落叶等凋落物形成了大量的腐殖质来源,在微生物作用下,其被分解为有机质,为土壤养分的积累奠定了基础,同时,凋落物能够有效促进土壤水分的保持,利于涵养降雨等水分,从而在促进林木生长的同时提升微生物新陈代谢的条件。此外,对于红树林区域而言,其具有更适宜微生物活动的表土结构,增强微生物对有机质的分解效率,加速了能量转换。通过相关性分析得知,微生物数量及其生物量受到土壤养分的显著制约,二者正向变化关系尤为突出,且其协调发展效应较强,具有较强的互补性[15]。微生物活动离不开必要的养分支撑,相反,凋落物等有机质的分解离不开微生物,从而促进养分积累,二者关系尤为密切,对于不同湿地而言,虽然其碳、氮含量存在较大差异,但是其含量的提升将会促进微生物量碳及氮的聚集。通过研究对比分析得知,对于微生物量而言,其与养分的关系密切,作为养分的核心来源之一,有机质含量起着关键作用;综合来看,对于滨海湿地而言,虽然群落分布有所差异,但是微生物和养分之间的关系具有不可分割性,微生物的新陈代谢等活动利于养分的积累[22-23],对于有机质的降解效应尤为关键,二者具有较强的协同发展效应。
在土壤有机碳中,微生物量碳的含量一般不超过5%,对于全氮而言,微生物量氮的占比一般在6%左右,有些学者认为这并不是普遍现象,碳、氮含量的变化具有不确定性,也不是土壤的固化特点[22-23]。通过连续3年的观测分析得知,对于微生物量碳、氮、磷而言,虽然在不同湿地区域来说,其含量存在较大差异,但是其依然具有一定的规律性,其中含量最高的是红树林湿地,其次芦苇湿地区域,而互米花草湿地的含量最低,除了微生物量磷之外,碳、氮含量均呈现了显著性差异。对于滨海湿地而言,微生物不同菌群在数量方面的差异较大,且其变化特点与总微生物数量基本接近,相比而言,细菌更具有数量优势。不同的湿地区域,其不仅具有差异较大的土壤结构,其土壤肥力及活性方面也会出现较大差异,加之土壤通透性的差异,其将会对微生物活动产生显著的制约,对于红树林区域而言,其不仅具有多样性的植被分布,同时生物量突出,受凋落物影响,其水源涵养能力得以有效提升,土壤养分状况相对较好,加之河水冲击形成了养分集聚,对于提升该区域的养分水平效果显著,受此影响,微生物活动进一步加强,对于有机质降解效果更好。虽然菌群的数量存在较大差异,但是不同的菌群对于环境的酸碱性喜好并不相同,对于真菌而言,其更适宜于在酸性条件下生长[24],而对于其他两种菌群而言,则更喜好中性环境。
综合来看,微生物活动改变着土壤理化特性,另一方面土壤环境为微生物活动创造更为适宜的新陈代谢环境,二者具有明显的相互促进性,在湿地生态保护过程中要充分注重微生物和养分的协调,合理控制氮、磷等含量,发挥微生物效应。
