猪瘟E2亚单位疫苗单剂量免疫攻毒保护效力试验
2020-10-21王遵宝李俊辉刘宏杰鲁立柱候玉珍
王遵宝,李俊辉,王 元,贺 笋,刘宏杰,鲁立柱,候玉珍,杨 静
(天康生物股份有限公司,新疆 乌鲁木齐 830032)
猪瘟是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种猪高度接触性传染病,可造成养猪业巨大损失。长期以来中国猪瘟防控以免疫猪瘟减毒活疫苗(Modified live vaccine,MLV)为主。近年来,猪瘟亚临床或隐性感染已经成为国内常见的临床类型,国家在猪瘟防控政策也逐渐由免疫防控转向免疫净化。猪瘟减毒活疫苗的安全性和免疫效力虽毋庸置疑,但由于其不能区分疫苗毒株与野毒株,很难应用于当前猪瘟免疫净化政策中。
猪瘟病毒E2黏膜糖蛋白是主要的保护性抗原蛋白,它不仅能参与感染过程还能够诱导产生中和抗体,成为猪瘟亚单位疫苗的主要研究对象[1]。众多学者利用不同的技术策略开发了多种猪瘟E2亚单位疫苗,并进行了全面、细致的应用性研究[2-4]。本试验所用的猪瘟E2亚单位疫苗,是在流行毒株C株E2基因基础上进行了修饰、合成,增加了E2保护力的广谱性,同时应用分子生物学技术将该E2基因重组于杆状病毒内,在昆虫细胞上培养表达猪瘟病毒E2蛋白而制成的新型基因工程疫苗,只诱导猪体产生E2蛋白抗体,可以通过对E2、E0或NS3蛋白抗体检测区分免疫和野毒感染猪,有助于猪场净化猪瘟。
本实验室前期试验结果表明,E2亚单位疫苗2次免疫后的保护效力与活疫苗相当,可为靶动物提供可靠的免疫保护效力[5]。本试验用临床中单剂量免疫1次的猪瘟E2亚单位疫苗和免疫2次猪瘟减毒活疫苗的商品猪进行攻毒保护试验,通过比较分析攻毒前后靶动物体温变化、临床症状、病理剖检变化、猪瘟抗体消长及带毒情况,综合评价E2亚单位疫苗单剂量免疫对猪瘟野毒的保护效力。
1 材料与方法
1.1 疫苗及主要试剂 (1)疫苗:猪瘟E2亚单位疫苗,天康生物股份有限公司提供;猪瘟减毒活疫苗(MLV),购自某公司。(2)试验动物:长大二元母猪及其所产仔猪。(3)饲料:试验猪教槽料、保育期、育肥期全价颗粒料,均由天康生物饲料事业部提供。(4)攻毒用毒株:猪瘟石门系强毒,购自中国兽医药品监察所菌毒种保存保藏中心。(5)主要试剂:猪瘟病毒抗体检测试剂盒(货号:99-43220)、猪瘟病毒血清抗原检测试剂盒(货号:99-40939),均购自IDEXX公司。
1.2 方法
1.2.1 试验设计 本试验在新疆某猪场A、B两区进行,A区母猪在妊娠中期经耳部深层肌肉注射猪瘟E2亚单位疫苗,1头份/头,21 d后加强免疫1次;在B区选择分娩时间接近的母猪采用相同方式免疫2次MLV,每组免疫不低于180头。用以上2个区的免疫母猪所产仔猪进行不同猪瘟疫苗对商品猪的有效性试验。
本试验共设3组,第1组为E2亚单位疫苗组(E2组),第2组为猪瘟减毒活疫苗组(MLV组),第3组为非免疫对照组。孕猪分娩后,A区母猪所产仔中随机打耳标200头作为E2组的供试猪,在母源抗体阳性率低于70%时免疫猪瘟E2亚单位疫苗1次。B区母猪所产仔随机选择200头在4、8周龄免疫MLV 2次,作为MLV组试验猪;另选100头仔猪不免疫作为非免疫对照组,跟踪监测试验猪体重、猪瘟抗体至24周龄。试验猪的饲养管理及其他疫苗免疫均按本场程序进行,保证猪舍正常的通风和温度、湿度。
试验猪24周龄左右时,在3个试验组中各随机选取5头猪运至天康生物制药事业部检验动物房,保健3~5 d后用猪瘟石门系强毒进行人工感染,根据试验猪感染后16 d内临床表现、存活率等综合评价猪瘟E2亚单位疫苗单剂量免疫对靶动物的保护效力。
1.2.2 采血与抗体监测 定期在3个组的供试猪群中随机抽样采血,抽样量要求每组不低于50头仔猪/次。采集的血清送天康生物制药事业部测定猪瘟抗体。
1.2.3 供试猪增重试验 3个试验组在首次免疫MLV前进行称重,免疫后每4周称重1次,统计不同组试验猪的增重情况,连续跟踪监测至24周龄。
1.2.4 人工感染 3个试验组的15头供试猪运至检验动物房后,在独立的负压区域中饲养,由3组试验人员单独饲喂、观察,保证有效隔离。猪只保健3~5 d后,用猪瘟病毒石门系血毒1 mL(含105.0最小致死量)经耳后颈部肌肉注射进行人工感染。
攻毒后每日定时测定并记录试验猪体温、死亡情况,观察临床症状,包括食欲、呼吸、精神状态、腹泻与便秘、结膜炎、体表是否有出血点等。
攻毒后16 d内定期采集试验猪血样,用于测定猪瘟病毒和特异性抗体。被检样本S/N≤0.10,为CSFV阴性;S/N≥0.30,为阳性;0.12 结果
2.1 商品猪抗体监测 商品猪不同生长阶段猪瘟病毒抗体检测结果显示,MLV组仔猪4周龄母源抗体阳性率为77.78%,4周龄首免后2周阳性率有所下降,二免前升高至80.56%,10~12周龄时抗体阳性率最高,可达94.44%,之后猪群猪瘟抗体阳性率缓慢下降,至24周龄时阳性率为72.22%。E2组4~8周猪瘟抗体阳性率为100%,10~12周时母源抗体阳性率逐渐下降,12周龄时降至76.47%,用E2亚单位疫苗进行免疫,免疫后4周抗体阳性率升至100%,24周龄 时阳性率可达86.67%。对照组仔猪4周龄母源抗体阳性率与MLV组相近,为75%,此后逐步下降,8周龄时抗体阳性率为15%,10周龄时母源抗体阳性率已降至0%,因此未继续跟踪监测。
E2组猪群仅在10~12周龄(首免前2周)抗体阻断率均值略低于MLV组,离散度较MLV组高,其余监测点均优于MLV组,即整个监测过程,E2组的抗体水平更高,整齐度更好,见表1。
以上结果表明,猪群单次免疫E2亚单位疫苗后的猪瘟抗体阳性率、阻断率、离散度略优于免疫2次MLV猪群,两者差异不显著(P>0.05)。
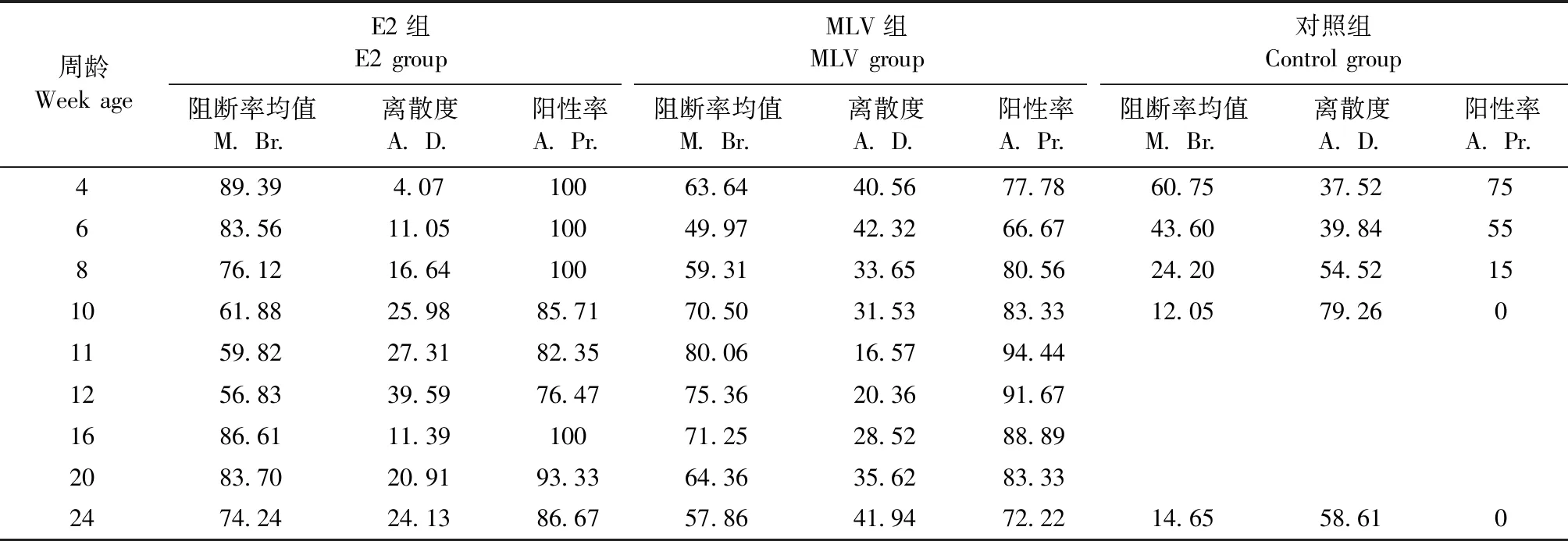
表1 试验猪群不同生长阶段猪瘟病毒抗体监测统计分析结果Table 1 Statistical analysis of ELISA antibody against CSFV at different growth stages in immuned piglets (%)
2.2 生长猪增重试验 在猪场定期将标记的商品猪称重,统计分析了同等饲养条件及免疫背景下不同猪瘟疫苗对其生长性能影响的试验。结果表明,24周龄时,单次免疫E2亚单位疫苗的商品猪平均体重最高为(101.61±1.95)kg,平均体重为(100.46±2.16)kg,对照组次之,免疫2次MLV的试验猪体重最小,在每个监测点各组平均体重差异不显著(P>0.05),但E2组与MLV组的净增重(24周龄体重与4周龄体重之差)差异显著(P<0.05),见图1。
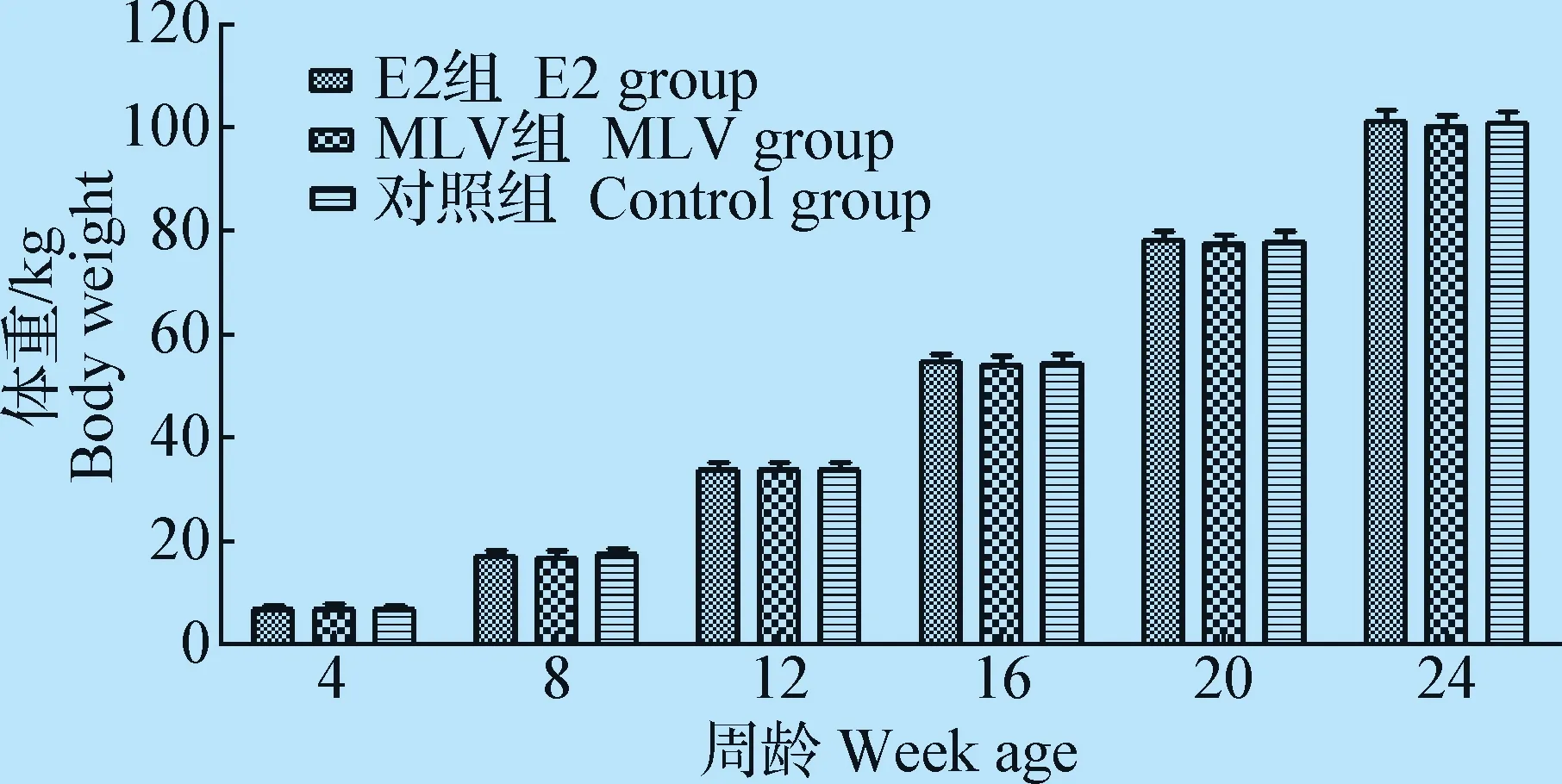
图1 免疫不同猪瘟疫苗商品猪体重变化监测结果Fig.1 Results of body weight changes of pigs immunized with different CSF vaccines
2.3 猪瘟病毒人工感染试验
2.3.1 试验猪攻毒前后体温及临床观察 攻毒后试验猪体温测定结果表明,对照猪在攻毒后体温逐渐升高,攻毒后5~7 d时体温最高,可达42 ℃,之后高热稽留,直至濒死时体温有所降低。E2组攻毒后体温未见升高,每个温次均不高于基础体温1 ℃,观察期内介于38.6~39.6 ℃;MLV组1头猪在攻毒后6~7 d出现低热,体温高于基础体温1 ℃,之后恢复正常,其他猪只体温正常,见中插彩版图2。
攻毒后3 d,对照猪活力下降,陆续表现出精神沉郁、畏寒怕冷、聚集躺卧等状况;食欲明显下降;眼睛发红,并伴有脓性分泌物,呈典型的结膜炎症状;便秘、腹泻交替发生;在攻毒后8 d,2头猪发生急性死亡,12 d内全部发病死亡,见中插彩版图3。E2组未见任何异常;MLV组仅1头猪有轻微一过性发热及厌食症状。
2.3.2 病理剖检 对照组猪只死亡后剖检可见典型的猪瘟引起的组织、器官病变,如扁桃体溃疡,膀胱、肾脏表面出现出血点,各部位淋巴结出血,脾边缘梗死。E2组剖检未见异常,结果见表2和中插彩版图4、5。MLV组仅发热的1头猪剖检时在膀胱上发现出血点,且下颌及腹股沟淋巴结有轻微肿大、出血,但不能确定是否是由猪瘟病毒引起该病变。
2.3.3 攻毒前后血样抗体、猪瘟病毒测定 攻毒前E2组CSFV抗体阻断率均值为74.66%,MLV组为59.83%,阳性率均为100%,对照组CSFV抗体均为阴性。试验结束时,E2组和MLV组血样的猪瘟抗体阻断率均明显升高,见图6;对照组的试验猪攻毒后发病直至死亡,CSFV抗体始终为阴性,提示未免疫个体被猪瘟强毒株感染后,机体出现免疫抑制,未能产生猪瘟中和抗体有效阻断病毒大量增殖,最终形成病毒血症,导致急性发病死亡。
攻毒后4 d可在对照组猪血液中持续检出猪瘟病毒,直至病猪死亡;攻毒期间E2组猪血液中未检出猪瘟病毒,MLV组供试猪仅1头在攻毒后4~8 d的0.1
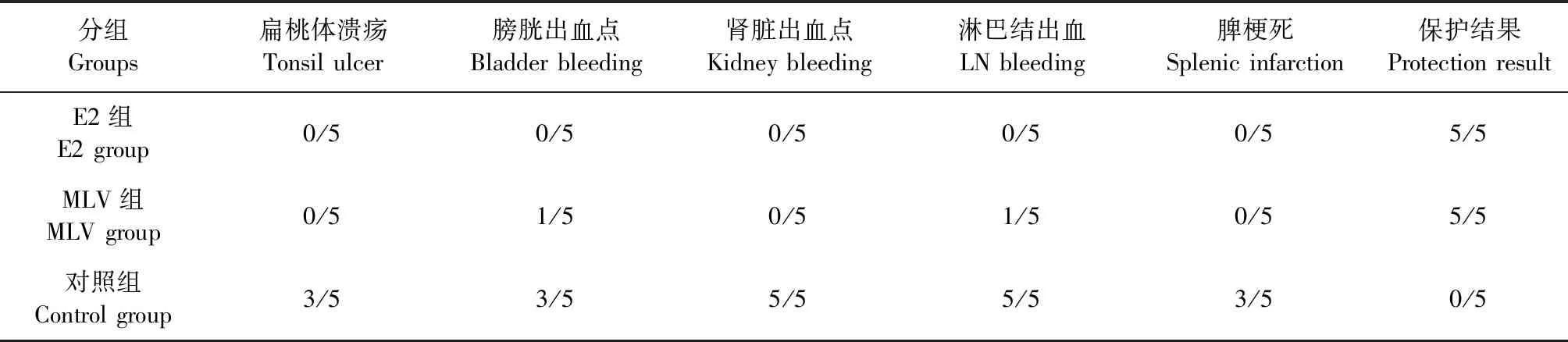
表2 攻毒后猪剖检病变统计表Table 2 Results of postmortem lesions in pigs (头)
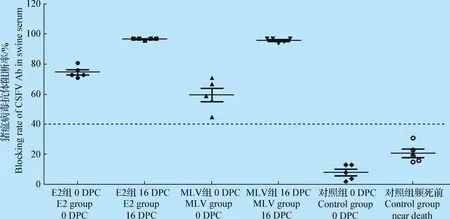
图6 攻读前后试验猪CSFV Ab阻断率变化情况Fig.6 Change of CSFV Ab blocking rate in test pigs
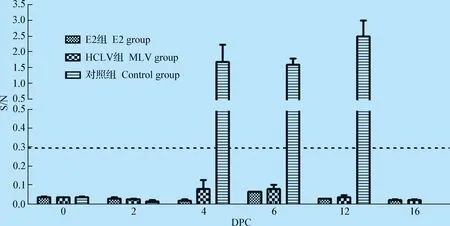
图7 试验猪血样中CSFV检测结果Fig.7 Results of CSFV Ag in swine plasma
3 讨论
研究表明,长期、持续的IgG水平和/或记忆B细胞激活引起的继发性记忆抗体反应产生的中和抗体是机体能够对抗CSFV感染的重要武器[6]。猪只接种MLV疫苗后,猪瘟病毒的复制可以刺激T、B淋巴细胞的活化、复制和分化,从而更有效地产生2种类型的大量记忆细胞。但对于灭活疫苗而言,局部炎症反应较小,所以通常需要加强免疫以诱导保护性免疫应答。随着佐剂制剂的发展,亚单位疫苗的免疫应答反应及持续时间得到了极大的改善。
Hua R H等筛选了能稳定产生分泌型猪瘟病毒E2蛋白(ME2)的BHK-21细胞,用该蛋白与不同佐剂乳化的疫苗免疫动物,一免后2周中和抗体效价为1∶40~1∶320,二免后28周中和抗体效价均仍不低于1∶80,此后将试验猪攻毒,所有免疫猪存活,无明显猪瘟症状,证实了该蛋白的免疫效力;不同佐剂配制的E2亚单位疫苗免疫动物后存在较大的反应差异,水包油佐剂ISA 15A VG诱导的免疫应答快,油包水佐剂ISA 61 VG诱导抗体效价最高,衰减最慢,免疫后32周中和抗体效价仍可高达1∶10 240,即油性佐剂诱导免疫应答更强,抗体持续时间长,适合提供长效的免疫保护[7]。
Madera R等用试验疫苗KNB-E2免疫猪,可在其血清中检出高水平的E2特异性抗体和抗CSFV中和抗体[8]。免疫后35 d,用 CSFV(Honduras / 1997)毒株经肌内注射和鼻内感染试验猪。单剂量免疫KNB-E2的猪攻毒后持续生长,未见任何异常临床表现,仅能在少数血液和鼻拭子样品中检测到低拷贝CSFV核酸,未免疫的对照猪停止生长,持续发热、白细胞严重减少,表现出典型的猪瘟症状,并能在血液及鼻拭子中检测到高拷贝的CSFV核酸。
Smit A J de等用拜耳的猪瘟E2亚单位疫苗单剂量免疫猪,间隔3、6、13个月后分别人工感染CSFV (Brescia)强毒株[6]。未接种疫苗的对照猪发生急性猪瘟引起死亡,接种疫苗的猪群具有高水平CSFV中和抗体,全部存活,同群哨兵猪未见异常,表明单次接种E2亚单位疫苗后,不仅可以保护猪13个月内免受CSFV强毒株的攻击致死,而且阻止了病毒在猪群的水平传播。
本试验结果表明,在临床中单剂量免疫1次猪瘟E2亚单位疫苗,不仅能够诱导机体产生高水平的猪瘟病毒E2蛋白特异性抗体,有效保护商品猪在出栏前免受猪瘟强毒的攻击,而且降低了免疫过程中抓猪和免疫应激造成的生长影响,减小了感染非洲猪瘟的风险,可以为猪场减少免疫及劳动力成本,具有重要的推广意义。
