EZH2 蛋白在非小细胞肺癌顺铂耐药中的作用及其机制研究
2020-10-21苏乌云贾永峰陈连香曹冉华乌日罕
齐 慧,呼 群,苏乌云,贾永峰,陈连香,曹冉华,乌日罕
肺癌是目前我国发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%[1],严重危害人类健康。 虽然近年在肺癌化疗及分子靶向治疗方面取得了很大的进步,但总体治疗效果仍不理想,抗肿瘤药物耐药是导致肿瘤治疗失败的重要原因之一。 探讨肺癌耐药的分子机制,有助于为治疗肺癌提供新的靶点和途径,在化疗药物选择方面为临床提供指导意见。 Zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)蛋白是多梳蛋白抑制复合体2(polycomb repressive complex 2,PRC2)的催化活性亚单位,是多聚梳群蛋白家族的主要成员,定位于人类染色体7q35 位置,可对组蛋白H3 第27 位赖氨酸进行甲基化修饰,从而介导目的基因沉默和转录抑制作用[2]。 EZH2 蛋白在促进细胞增殖、抑制细胞凋亡、改变细胞周期、促进肿瘤转移以及参与耐药等方面发挥重要作用[3]。 目前已发现EZH2 蛋白在前列腺癌、乳腺癌、肝癌等多种肿瘤中高表达[4-6]。 近年研究显示EZH2 蛋白在NSCLC 中高表达,并与患者预后相关[7],可能与NSCLC 的发生发展密切相关[8]。且EZH2 蛋白的过表达促进了肺癌细胞的侵袭和转移[9]。 此外,EZH2 蛋白在肿瘤耐药中也发挥作用,在卵巢癌细胞中抑制EZH2 蛋白表达能有效逆转卵巢癌细胞对顺铂的耐药性[10]。 在肝癌细胞中沉默EZH2 基因后可使其对氟尿嘧啶的耐药性降低[11]。目前EZH2 蛋白对NSCLC 顺铂耐药的作用尚不明确,而且对其调控肺癌耐药的机制了解甚少。 本研究采用RNA 干扰技术抑制人肺腺癌细胞顺铂耐药株A549/DDP 中EZH2 的表达,研究EZH2 蛋白与顺铂耐药的关系及其调控机制。
1 材料和方法
1.1 实验材料和试剂 人肺腺癌细胞株A549 购自江阴康众康民生物医药技术有限公司,人肺腺癌细胞顺铂耐药株A549/DDP 购自北京银紫晶生物医药技术有限公司(中国医学科学院肿瘤医院肿瘤研究所)。 主要试剂:RPMI-1640 培养基、胎牛血清均购于美国HyClone 公司,DH5α 感受态大肠杆菌菌株购自美国Invitrogen 公司,质粒提取试剂盒购自天根生化科技(北京)有限公司,Lipofectamine 2000 reagent 购自美国Invitrogen 公司,总RNA 提取试剂盒、反转录试剂盒及实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)试剂盒购自天根生化科技(北京)有限公司,PCR 引物由中美泰和生物有限公司合成,顺铂购自山东齐鲁制药厂,细胞增殖-毒性检测试剂盒购自日本株式会社同仁化学研究所。
1.2 方法
1.2.1 细胞培养 按照贴壁细胞培养方法常规培养A549 及A549/DDP。 使用含1%青链霉素混合液及10%胎牛血清的改良型RPMI-1640 培养基配制而成的完全培养基,置于37 ℃、5% CO2细胞培养箱中培养。
1.2.2 质粒扩增及提取 取2 种序列重组质粒piGene-shEZH2 和空质粒piGene-shNega 进行扩增,该重组质粒由本课题组呼群教授前期合成,具体序列为:piGene-shEZH2:5′-GGACGGCTCCTCTAACCA TGTTTACAACT-3′,piGene-shNega:5′-GTGCATGATG TGTACCCTTTGGTTCATAGA-3′。取重组质粒和空质粒导入感受态大肠杆菌菌株,于LB 培养基中扩增,获得大量扩增的质粒,使用试剂盒进行质粒提取。
1.2.3 脂质体介导质粒转染A549/DDP 细胞 使用Lipofectamine2000 试剂将重组质粒piGene-shEZH2与空质粒piGene-shNega 转染到A549/DDP 细胞中。将A549/DDP 细胞接种于6 孔细胞培养板中,常规培养24 h。 按照Lipofectamine2000 试剂说明进行转染,转染24 h 后,加400 μg/mL G418 抗生素筛选14 d,常规换液。 14 d 后见具有抗药性的克隆形成,获得稳定表达的细胞A549/DDP-shEZH2、A549/DDPshNega,后续以200 μg/mL G418 维持培养。qRT-PCR鉴定转染效率。
1.2.4 细胞毒性实验 细胞接种于96 孔细胞培养板中,接种密度为5000个细胞/孔,细胞培养24 h后加顺铂作用,顺铂浓度依次为0.1、1、10、50、100和150 μmol/L。 同时设置阴性对照组。 加顺铂培养24 h 后,加入细胞毒性实验检测试剂。 继续培养2~4 h 后,用酶标仪测定450 nm 处的光密度(optical delnsity,OD)值,实验重复3 次。 分别检测A549 与A549/DDP 及转染前后的A549/DDP 对顺铂的耐药性差异,计算公式:抑制率=(阴性对照组OD 值-实验组OD 值)/(阴性对照组OD 值)×100%,计算半数抑制浓度(half-inhibitory concentration,IC50)值。
1.2.5 qRT-PCR 检测 分别提取A549、转染前后的A549/DDP 细胞总RNA,反转录获得cDNA,进行qRT-PCR,选择甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)作为内参照,引物序列为:EZH2-上游引物:5′-CAGGCTGGGGGATTTTT ATC-3′,EZH2-下游引物:5′-CACTTTCCCTCTTCTGT CAGCTTC-3′;P21-上游引物:5′-ACCTGTCACTGTCTT GTACC-3′,P21-下游引物:5′-GGCGTTTGGAGTGGTA GAA-3′;Bad-上 游 引物:5′-CCAGCAGGAGCAGCCA AC-3′,Bad-下游引物:5′-CCCATCCCTTCGTCGTCCT-3′;Puma-上游引物:5′-CGACCTCAACGCACAGTAC-3′,Puma-下游引物:5′-CAGGCACCTAATTGGGCTC-3′;GAPDH-上游引物:5′-CCTCAACGACCACTTTGT CA-3′,GAPDH-下游引物:5′-TTACTCCTTGGAGGCC ATGT-3′。 按照试剂盒说明书操作,反应使用ABI7300 qRT-PCR仪。此实验重复3 次。采用2-△△Ct法计算数据。
1.2.6 流式细胞术检测 采用碘化丙啶单染色法对 A549/DDP、 A549/DDP-shEZH2、 A549/DDPshNega 进行流式细胞检测,测定细胞周期。 取对数生长期细胞,加入70%乙醇于4 ℃固定1 h,然后加入RNA 酶(终浓度20 μg/mL),置于37 ℃水浴中孵育30 min,加500 μL 碘化丙啶PI 染液,置于4 ℃冰箱,避光孵育30 min,流式细胞仪检测细胞周期。
1.3 统计学处理 应用SPSS 24.0 软件进行分析,计量资料以均数±标准差(±s)表示,两组间比较使用t检验,多组间比较使用单因素方差分析;计数资料采用率表示,行χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 A549/DDP 和A549 对顺铂的敏感性 A549/DDP 的IC50 值为(34.57±3.70)μmol/L,A549 的IC50 值为(5.89±0.97)μmol/L,P<0.05 为差异有统计学意义,A549 细胞对顺铂较敏感,而A549/DDP 则对顺铂敏感性差,图1。
2.2 A549 和A549/DDP 中EZH2 mRNA 的表达情况 qRT-PCR 检测结果显示,EZH2 的mRNA 在A549/DDP 中呈高表达,其相对表达水平为A549 的(1.97±0.02)倍,差异有统计学意义(P<0.05),图2。

图1 顺铂作用后A549 和A549/DDP 的细胞存活率
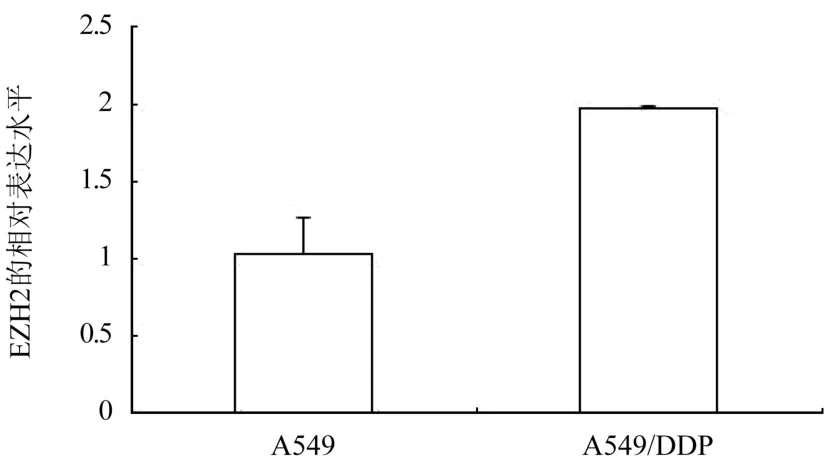
图2 A549/DDP 中EZH2 的mRNA 表达
2.3 A549 和A549/DDP 中P21、Puma、Bad mRNA的表达情况 qRT-PCR 检测结果显示,在A549/DDP 中P21、Puma 的mRNA 表达水平明显低于A549,P21 为(0.20±0.02)倍,Puma 为(0.18±0.02)倍,差异有统计学意义(P<0.05);Bad 的mRNA 在A549/DDP 中也呈低表达,Bad 为(0.78±0.04)倍,但差异无统计学意义(P>0.05),图3。

图3 A549 和A549/DDP 中P21、Puma、Bad 的mRNA 的表达
2.4 A549/DDP 和转染后细胞中EZH2 的mRNA的表达情况 A549/DDP-shEZH2 细胞相对表达量为A549/DDP 的(63.54±3.42)%,抑制EZH2 表达的效果明显,差异有统计学意义(P<0.05),选择该组细胞继续培养进行后续实验。 A549/DDP-shNega组的相对表达量为A549/DDP 的(98.03±1.21)%,差异无统计学意义(P>0.05),图4。

图4 A549/DDP 和转染后细胞中EZH2 的mRNA 的表达
2.5 顺铂作用后A549/DDP 和转染后细胞存活率细胞毒性实验检测转染前后细胞耐药性的变化,A549/DDP-shEZH2 的IC50 为(18.91±2.07)μmol/L,与A549/DDP 的IC50(34.57±3.70)μmol/L 比较,差异有统计学意义(P<0.05);A549/DDP-shNega 的IC50 为(35.43±2.39)μmol/L,与A549/DDP 比较,差异无统计学意义(P>0.05),图5。
2.6 A549/DDP 和转染后细胞中P21、Puma、Bad mRNA 的表达情况 qRT-PCR 检测转染前后细胞中P21、Puma、Bad 表达的变化,结果显示,抑制EZH2 基因表达后,P21、Puma、Bad 的mRNA 表达均上调,P21 mRNA 相对表达量为A549/DDP 的(5.81±0.21)倍,Puma 为(3.12±0.04)倍,Bad 为(1.53±0.02)倍,差异有统计学意义(三者均P<0.05)。A549/DDP-shNega组的表达量与A549/DDP 比较,差异无统计学意义(P>0.05),图6。
2.7 抑制EZH2 基因表达后A549/DDP 细胞周期变化情况 流式细胞仪检测转染前后细胞的细胞周期,结果显示,A549/DDP-shEZH2组细胞G0/G1 期所占比例为(58.85±5.67)%,S 期为(16.95±4.84)%,G2/M 期为(22.8±4.29)%;A549/DDP-shNega组细胞G0/G1 期所占比例为(78.35±1.03)%,S 期为(10.05±1.96)%,G2/M 期为(12.55±1.56)%;A549/DDP 细胞G0/G1 期所占比例为(76.83±5.11)%,S 期为(9.08±1.77)%,G2/M 期为(14.13±3.58)%。 抑制EZH2 基因表达后A549/DDP 细胞的G0/G1 期细胞比例下降,而G2/M 期细胞比例增加,差异有统计学意义(P<0.05);A549/DDPshNega 与A549/DDP 细胞周期的变化比较,差异无统计学意义(P>0.05),图7,图8。

图5 顺铂作用后A549/DDP 和转染后细胞存活率

图6 A549/DDP 和转染后细胞中P21、Puma、Bad mRNA 的表达

图7 A549/DDP 和转染后细胞的细胞周期分布
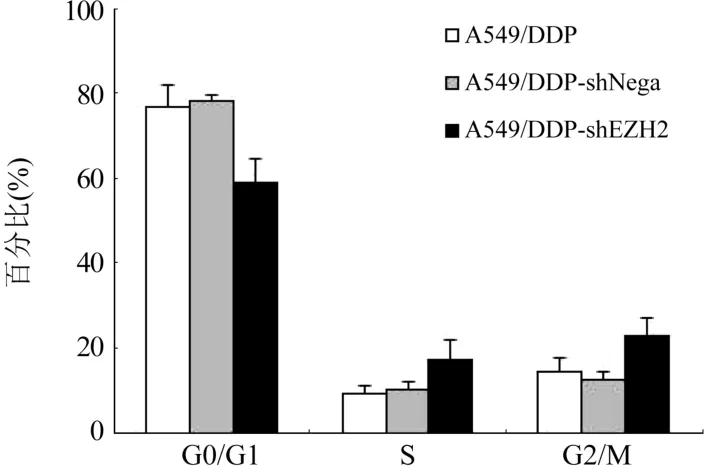
图8 A549/DDP 和转染后细胞的细胞周期变化
3 讨论
肺癌耐药已经成为目前临床治疗中的一大难题,而肺癌对顺铂形成耐药的机制十分复杂,有多种耐药相关分子参与其中,调控方式涉及到药物转运、药物代谢、DNA 损伤修复、血管生成、细胞凋亡以及细胞周期调节等方面。
恶性肿瘤中存在着广泛的表观遗传学改变,如DNA 甲基化和组蛋白修饰等,其与恶性肿瘤的发生发展密切相关。 而DNA 甲基化和组蛋白乙酰化在肿瘤化疗耐药中也起重要作用。 在DNA 形成染色质的过程中,组蛋白作为重要的组成部分调控基因的表达。 研究表明[12],DNA 甲基化转移酶抑制剂可逆转因DNA 甲基化所致的化疗敏感基因抑制,使其表达恢复上调,从而使肿瘤对顺铂的敏感性恢复。而在组蛋白去乙酰化酶抑制剂的研究中也观察到类似的作用[13]。
研究表明,EZH2 蛋白高表达与NSCLC 预后不良有关[7]。 近年的文献报道EZH2 蛋白可能参与肿瘤细胞的耐药。 在卵巢癌细胞中抑制EZH2 表达能有效逆转卵巢癌细胞对顺铂的耐药性[10]。 EZH2 蛋白在胰腺癌中高表达,其与胰腺癌恶性程度和细胞增殖密切相关,抑制EZH2 基因表达可使肿瘤细胞对阿霉素和2-脱氧-2,2-盐酸二氟脱氧胞苷的敏感性增加,引起细胞凋亡[14]。
本研究选择NSCLC 细胞株A549 及其耐药株A549/DDP 为研究对象,首先检测验证A549 和A549/DDP 中EZH2 蛋白的表达和对顺铂的耐药性。 结果显示耐药株A549/DDP 中EZH2 蛋白呈高表达,提示EZH2 与A549/DDP 的耐药性相关。 为了进一步的研究EZH2 蛋白与NSCLC 耐药的关系,采用RNA干扰技术抑制A549/DDP 中EZH2 蛋白的表达,选择EZH2 特异性的shRNA 重组质粒转染A549/DDP细胞,获得稳定抑制EZH2 蛋白表达的A549/DDP细胞。 通过对该细胞的耐药性检测发现,A549/DDP 对顺铂的耐药性下降,提示抑制EZH2 蛋白可以部分逆转A549/DDP 对顺铂的耐药性。 说明EZH2 蛋白在NSCLC 对顺铂的耐药中发挥作用。
为了进一步探讨EZH2 蛋白是通过何种机制在NSCLC 对顺铂的耐药中发挥作用,本课题组检测分析了EZH2 对细胞凋亡相关基因和细胞周期相关基因的影响。 首先,对细胞凋亡通路中的相关基因Puma 和Bad 进行了检测,结果显示,与A549 相比,A549/DDP 中Puma、Bad 的mRNA 均呈低表达,虽然Bad 无统计学差异,但仍有下降趋势。 抑制A549/DDP 中EZH2 表达后,Puma、Bad 的mRNA 表达上调,提示EZH2 对凋亡基因Puma、Bad 具有抑制作用。 有研究发现[15],在肺癌中抑制EZH2 基因表达,可引起细胞增殖抑制,并促进细胞凋亡。EZH2 抑制剂GSK343 与吉非替尼联合应用能够克服肺癌细胞PC9/AB2 对吉非替尼的耐药作用,能够显著抑制耐药细胞的活性,降低细胞的迁移能力并诱导耐药细胞的凋亡[16]。 由此推测,EZH2 可能通过抑制凋亡基因Puma、Bad 的表达参与对细胞凋亡通路的调控,使细胞凋亡减少,拮抗化疗药物引起的细胞凋亡,从而诱导NSCLC 产生耐药。 然而细胞凋亡通路的调控非常复杂,各通路之间存在交叉作用,所以EZH2 对NSCLC 耐药中凋亡的调控机制仍有待进一步研究。
本研究对细胞周期素依赖性蛋白激酶抑制因子P21 进行了检测,发现P21 的mRNA 在A549/DDP中呈低表达,通过RNA 干扰使EZH2 表达抑制后,P21 的mRNA 表达上调,提示EZH2 对P21 具有抑制作用。 采用流式细胞仪对转染前后的A549/DDP进行细胞周期检测,结果显示抑制A549/DDP 中EZH2 表达后,细胞周期中G0/G1 期细胞减少,而G2/M 期细胞比例增加,细胞发生了G2/M 期阻滞,提示EZH2 可能通过影响细胞周期在肺癌耐药细胞的增殖中发挥作用。 研究报道[17],在前列腺癌和乳腺癌中,抑制EZH2 的表达同样可使细胞发生G2/M期阻滞。 在对pRB-E2F 生长调控通路的研究中发现[17],抑制EZH2 可使增殖相关基因cyclinDl,cyclinEl 表达减少,说明EZH2 可能通过调控增殖相关基因而对细胞周期产生影响,从而在肿瘤细胞增殖中发挥作用。 因此,我们推测,EZH2 可能通过抑制P21 表达而使其调控细胞周期、抑制细胞增殖的作用减弱,从而促进NSCLC 细胞周期进展,使其恶性增殖能力增强,诱导NSCLC 产生耐药。 然而,也有文献报道,在肾癌细胞中抑制EZH2 使细胞阻滞在Gl 期[18],上调EZH2 使HeLa 细胞S 期延长[17],表明EZH2 对不同细胞的细胞周期的影响存在差异。
综上所述,EZH2 蛋白在NSCLC 对顺铂的耐药中发挥作用,抑制EZH2 基因可以部分逆转NSCLC对顺铂的耐药性,其参与耐药的机制可能与抑制细胞凋亡、促进细胞周期进展、增强细胞增殖能力有关。
